12年生物化学复习提纲Word文档格式.docx
《12年生物化学复习提纲Word文档格式.docx》由会员分享,可在线阅读,更多相关《12年生物化学复习提纲Word文档格式.docx(17页珍藏版)》请在冰豆网上搜索。
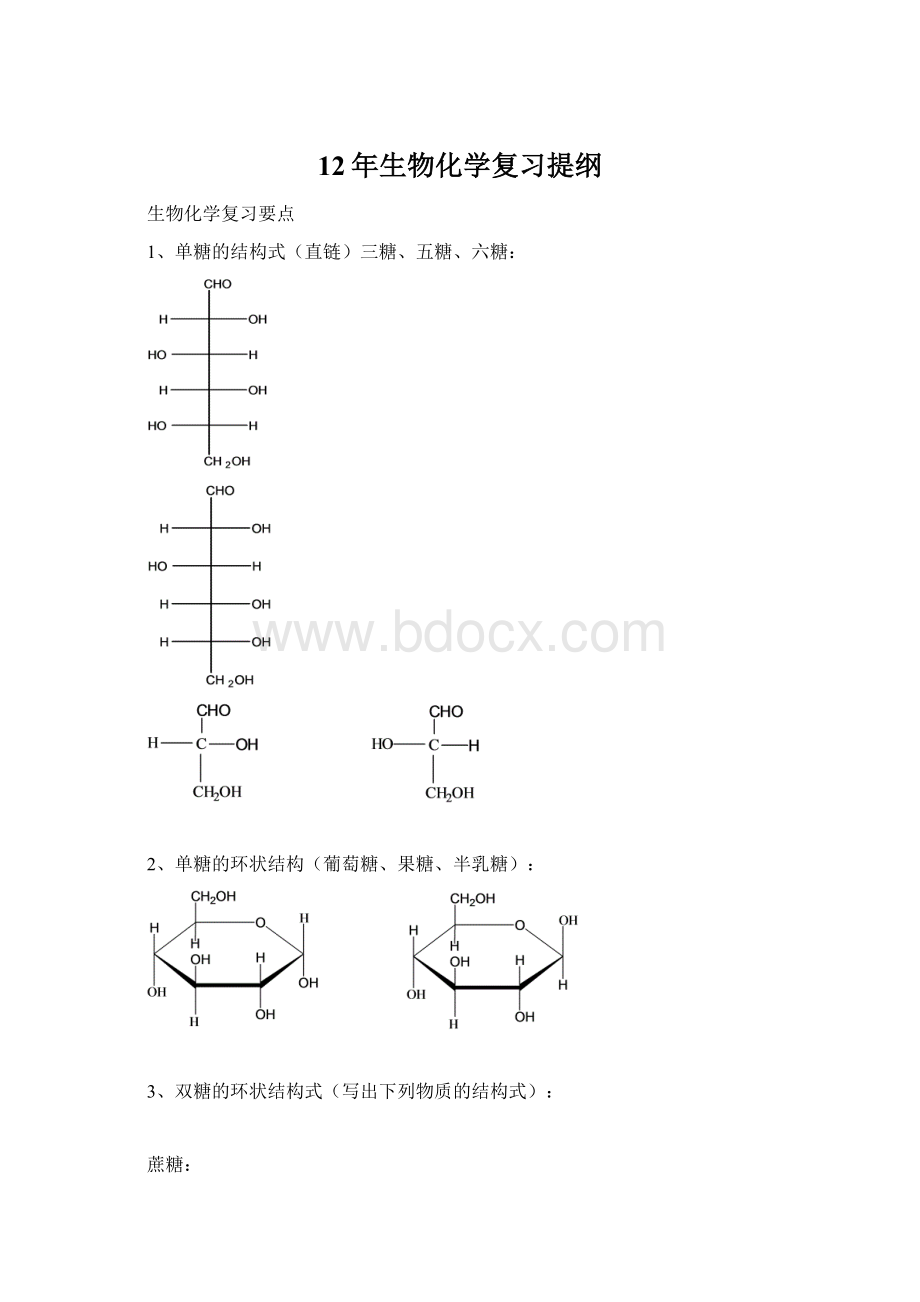
蛋白质是生命的物质基础,是含氮元素恒定的生命物质。
2、20种常见的氨基酸,它们的名称、结构、缩写式。
(了解氨基酸的结构特点)(P课本44-46)
3、氨基酸的性质
(1)氨基酸的光学性质:
(2)氨基酸的解离和两性:
(3)氨基酸的化学性质:
(4)氨基酸的等电点、等电点的特点、计算:
4、什么是肽和肽的命名?
(1)肽:
氨基酸通过肽键连接形成的链状化合物叫做肽。
(2)几种重要的肽的命名:
①谷胱甘肽(由谷氨酸、半胱氨酸和甘氨酸构成的三肽)—参与体内氧化还原反应反应的重要物质;
②神经肽——神经肽与神经体液调节;
③抗菌肽——细菌的一种防御武器。
5、蛋白质的一级结构:
蛋白质的一级结构特指肽链中的氨基酸顺序。
6、必需氨基酸:
定义:
必需氨基酸指的是人体自身不能合成或合成速度不能满足人体需要,必须从食物中摄取的氨基酸。
对成人来讲必需氨基酸共有八种:
赖氨酸、色氨酸、苯丙氨酸、蛋氨酸、苏氨酸、异亮氨酸、亮氨酸、缬氨酸。
2、蛋白质的基本组成单位是什么?
在蛋白质分子中,它们如何彼此相连?
蛋白质的基本组成单位是氨基酸。
在蛋白质分子中,氨基酸通过成肽反应形成肽键将氨基酸分子连接在一起。
3、何谓蛋白质的空间结构?
有哪些维系力量?
蛋白质的空间结构又称为构象、高级结构、立体结构、三维结构,指的是蛋白质分子中所有原子在三维空间中的排布,分为二级结构、三级结构、四级结构三个不同层次。
维系力量:
氢键、静电引力、范德华力、疏水相互作用、二硫键。
4、哪些因素可引起蛋白质变性?
蛋白质变性的物理因素?
为什么?
蛋白质变性后哪些性质发生显著改变?
有何实际应用。
(1)蛋白质变性的定义:
蛋白质受到外界各种理化因素影响,使其维系空间结构的次级键受到破坏,引起蛋白质空间结构(使蛋白质分子从一种紧密的状态变成松散的状态),从而使蛋白质的理化性质和生物活性改变或丧失,这种作用称为蛋白质的变性作用。
(2)引起蛋白质变性的因素:
①物理因素:
加热、紫外线、超声波、振荡、射线等;
②化学因素:
重金属盐、强酸、强碱、有机溶剂等。
(3)蛋白质变性的本质——变性是空间结构的解体。
(4)①变性后,蛋白质的理化性质发生改变,例如失去结晶力、溶解度降低(水膜被破坏)、结构松散(空间结构解体)、黏度增加(球状变为线团等),同时,生物功能减弱或丧失,这就是变性蛋白质的主要特征,例如酶失去活性、血红蛋白失去与氧的结合能力。
②变性蛋白质常常相互凝聚成块,这种现象称为凝固,凝固是蛋白质变性深化的表现。
因此,利用变性的深浅程度,在实际应用中具有重要意义。
例如,在防治病虫害、消毒、灭菌等时,就应利用高温、高压、紫外线及高浓度有机溶剂等促使和加深蛋白质的变性程度;
在生产制备酶制等活性的蛋白质产品时,又要防止蛋白质的变性,避免不利因素的影响。
5、蛋白质二级结构中有哪些构型?
(1)定义:
蛋白质的二级结构是指它的多肽链中有规则重复的构象,限于主链原子的局部空间排列,不包括与肽链其他区段的相互关系及侧链构象。
(2)构型有:
α-螺旋、β-折叠、β-转角和无规卷曲等。
1、核酸:
是从生物体中分离出来的一类溶于水而不溶于乙醇等有机溶剂的酸性化合物,含有丰富的磷。
根据核酸的化学组成,把核酸分为两类?
根据核酸的化学组成,把核酸分为脱氧核糖核酸(DNA)和核糖核酸(RNA)
核糖核酸(RNA)又分为:
mRNA(信使RNA)、tRNA(转运RNA)、rRNA(核糖体RNA)。
2、核酸的组成?
(1)元素组成:
C、H、O、N,较多的P和少量的S;
(2)经过不同程度水解,可得到多核苷酸、寡核苷酸和核苷酸;
彻底水解产物包括糖、含氮碱和磷酸。
3.RNA与DNA完全水解后产物的特点是什么?
RNA彻底水解后的产物是核糖核苷酸,DNA彻底水解后的产物是脱氧核糖核苷酸,两者核糖不同,一个是核糖,一个是脱氧核糖,核糖核苷酸的碱基有腺嘌呤、鸟嘌呤、胞嘧啶、尿嘧啶,脱氧核糖核苷酸的碱基有腺嘌呤、鸟嘌呤、胞嘧啶、胸腺嘧啶。
4、引起蛋白质变性的因素有哪些?
引起蛋白质变性的因素:
1、DNA和RNA在组成成分上有哪些相同和不同之处?
2、DNA的碱基组成有哪些规律、维系双螺旋结构稳定的因素是什么?
(1)DNA是由四种脱氧核糖核苷酸按一定顺序以磷酸二酯键相连形成的多聚脱氧核苷酸链。
(2)维系双螺旋结构的因素:
氢键、碱基堆集力、磷酸基上负电荷被胞内组蛋白或正离子中和、碱基处于疏水环境中。
3、DNA的二级结构是什么?
有何特点?
DNA的二级结构—双螺旋结构模型。
特点:
两条反向平行的多聚核苷酸连沿一个假设的中心轴右旋相互盘绕而形成,磷酸和脱氧核糖单位作为不变的骨架组成位于外侧,作为可变成分的碱基位于内侧,链间碱基按A—TC—G配对,螺旋直径2nm,相邻碱基平面垂直距离0.34nm螺旋结构每隔10个碱基对重复一次,间隔3.4nm。
4、什么是基因?
基因(遗传因子)是遗传的物质基础,是DNA或RNA分子上具有遗传信息的特定核苷酸序列。
3、什么叫碱基配对(互补),DNA和RNA分子中与哪些配对关系?
(1)两条核苷酸链依靠彼此碱基之间形成的氢键而结合在一起。
为了让碱基间尽可能多的形成氢键,A只能与T配对,形成2个氢键,G与C配对,形成3个氢键.
4、
4、什么叫核酸分子的变性、复性?
什么叫增色效应、减色效应和变性温度(Tm)?
答:
(1)变性:
DNA受到某些物理化学因素的影响,分子中的氢键、碱基堆积力等被破坏,双螺旋结构解体,分子由双链变为单链的过程称为变性。
(2)复性:
DNA的变性是可逆的,解除变性条件,满足一定条件后,解开的两条DNA互补链可以重新恢复形成双螺旋结构,并恢复有关的性质和生理学功能,这个过程为DNA复性。
(3增色效应:
核酸(DNA或RNA)变性后引起的光吸收增加称为增色效应,也就是变性后核酸(DNA或RNA)溶液的紫外吸收作用增强的效应。
(4)减色效应:
若变性DNA复性形成双螺旋结构后,其260nm紫外吸收会降低,这种现象叫减色效应。
(5)变性温度:
DNA的变化温度发生在一个很窄的温度范围内,通过把热变性过程中A260达到最值一半时的温度成为NDA的溶解温度,用Tm表示。
2、戊糖:
核酸中的戊糖有核糖和脱氧核糖两种,它们均为ß
-呋喃型。
RNA中的戊糖为ß
-D-核糖
DNA中的戊糖为ß
-D-脱氧核糖
3、碱基的结构、名称:
尿嘧啶(U)胞嘧啶(C)
(2,4-二氧嘧啶)(2-氧-4-氨基嘧啶)
腺嘌呤鸟嘌呤
黄嘌呤次黄嘌呤尿酸
4、几种常见的核苷名称、结构
腺苷(A)鸟苷(G)
尿苷(U)胞苷(C)
5、几种常见的核苷酸:
3’-磷酸腺苷5’-磷酸腺苷
3’-AMP5’-AMP
三磷酸腺苷(ATP)
6、RNA可分为几种不同的类别?
核糖核酸(RNA)分为:
7、核酸的一级结构,及连接方式?
核酸的一级结构是指核苷酸的排列顺序,包括核苷酸间的连接键。
连接方式:
核苷酸间的连接键:
磷酸二酯键。
1、什么是酶?
它在生命活动过程中起何重要作用?
催化特定化学反应的蛋白质、RNA或其复合体。
是生物催化剂,能通过降低反应的活化能加快反应速度,但不改变反应的平衡点。
绝大多数酶的化学本质是蛋白质
(2)作用:
①几乎所有生命活动或过程都有酶参加;
②酶的组成和分布是生物进化与组织功能分化的基础;
③在生物的长期进化过程中,为适应各种生理机能的需要,为适应外界条件的千变万化,还形成了从酶的合成到酶的结构和活性各种水平的调节机制。
2、酶与一般催化剂比较,其催化作用有何特点?
(1)高效率——酶具有很强的催化能力;
(2)专一性——酶对底物具有选择性。
(3)3、什么是结合蛋白酶?
什么是酶蛋白、辅酶、辅基和全酶?
举例说明酶蛋白、辅酶(基)在酶促反应中的作用?
(1)结合蛋白酶:
有些酶的活性仅仅取决于它们的蛋白质结构,如水解酶类(淀粉酶、蛋白酶、脂肪酶、纤维素酶、尿酶等),这些酶由简单蛋白质构成,叫做单纯酶;
有一些酶,其结构中除含有蛋白质外,还含有非蛋白质组分,如大多数氧化还原酶类,这些酶由结合蛋白质构成,叫做结合酶,即结合蛋白酶。
(2)酶蛋白:
在结合酶中,蛋白质部分称为酶蛋白。
(3)辅酶:
与酶蛋白结合比较疏松(一般为非共价结合),并可用透析方法出去的称为辅酶。
(4)辅基:
与酶蛋白结合牢固(有共价键结合,也有非共价键结合),不能用透析方法除去的称为辅基。
(5)全酶:
酶蛋白与辅因子结合成的完整分子叫做全酶。
(6)酶蛋白、辅酶(基)在酶促反应中的作用:
酶蛋白决定着酶作用的专一性,而辅酶或辅基在酶促反应中常参与化学反应,主要起着传递氢、传递电子、传递原子或化学基团以及“搭桥”(某些金属元素)等作用。
它们决定着酶促反应的类型。
4、如何证明酶的化学本质是蛋白质?
辅酶是小分子物质?
5、什么是酶的必需基团和酶的活性中心?
(1)酶的必需基团:
参与构成酶的活性中心和维持酶的特定构象所必需的基团叫做酶分子的必需基团。
(2)酶的活性中心:
酶分子中直接与底物结合,并和酶催化作用直接有关的区域叫酶的活性中心或活性部位。
6、什么叫米氏Km常数?
米氏Km常数:
酶促反应速率达到最大反应速率一半时的底物浓度。
8、影响酶促反应的因素有哪些?
其中温度,酸度,酶浓度的影响?
(1)影响酶促反应的因素有:
①酶浓度;
②底物浓度;
③pH值;
④温度;
⑤激活剂;
⑥抑制剂。
(2)①酶浓度的影响:
在酶催化的反应中,酶先要与底物形成中间复合物,当底物浓度大大超过酶浓度时,反应速率随酶浓度的增加而增加(当温度和pH不变时),两者成正比。
②温度的影响:
在较低的温度范围内,酶反应速率随温度升高而增大,但超过一定温度后,反应速率反而下降。
③pH的影响:
酶的活性受pH值的影响较大。
在一定pH值下酶表现最大活力,高于或低于此pH值,活力均降低。
9、激活剂、抑制剂?
激活剂:
凡能提高酶的活性,加速酶促反应进行的物质都叫做激活剂或活化剂。
抑制剂:
有些物质不引起酶蛋白的变性,但能使酶的必需基团或活性部位的化学性质改变而引起酶活性降低,甚至丧失,这些物质叫做抑制剂,即能引起酶抑制作用的物质叫抑制剂。
1、什么是维生素?
(了解维生素的结构特点、维生素的俗称与化学名称的联系)
生素是人和动物