药品不良反应事件报告表.docx
《药品不良反应事件报告表.docx》由会员分享,可在线阅读,更多相关《药品不良反应事件报告表.docx(8页珍藏版)》请在冰豆网上搜索。
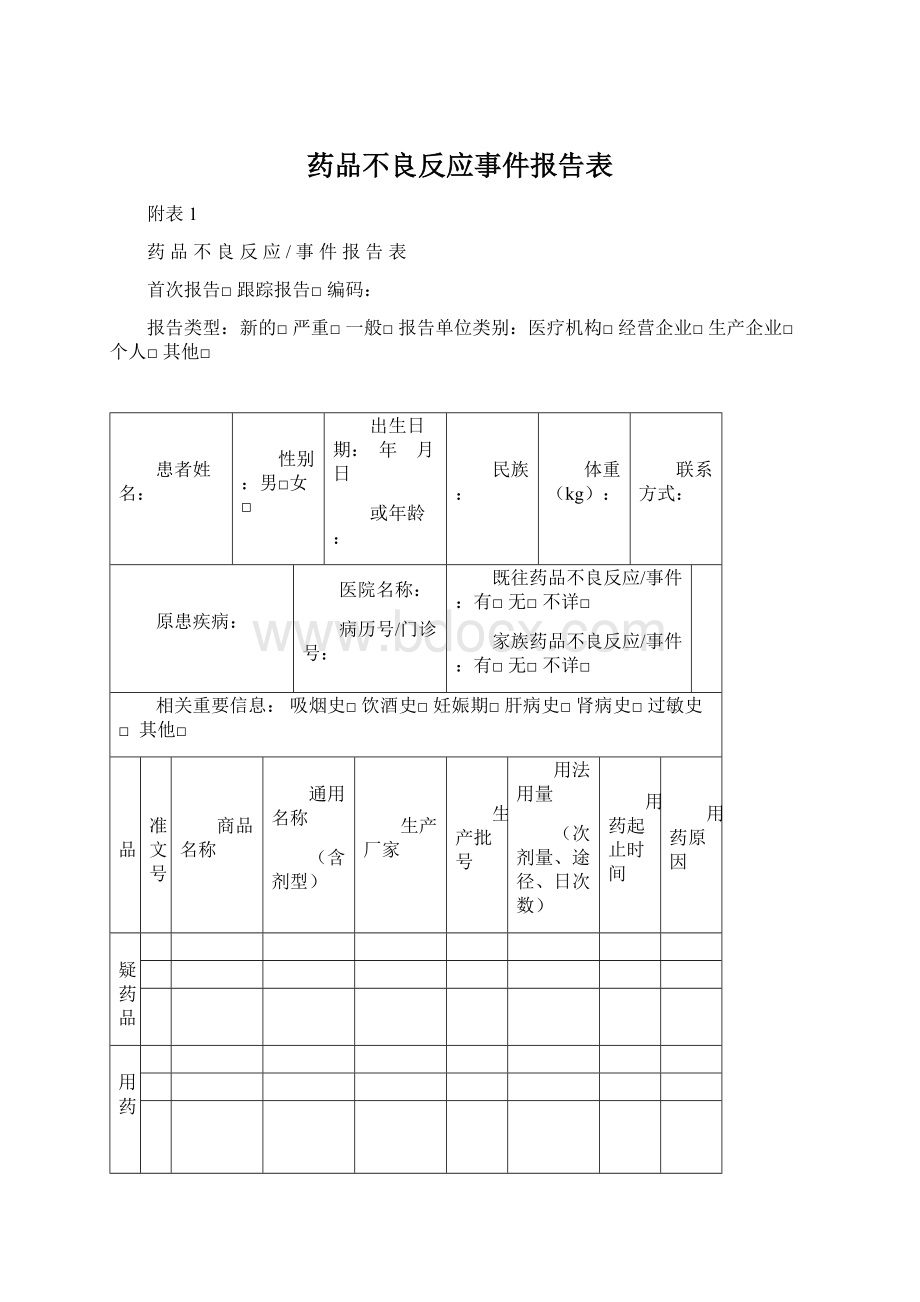
药品不良反应事件报告表
附表1
药品不良反应/事件报告表
首次报告□跟踪报告□编码:
报告类型:
新的□严重□一般□报告单位类别:
医疗机构□经营企业□生产企业□个人□其他□
患者姓名:
性别:
男□女□
出生日期:
年 月 日
或年龄:
民族:
体重(kg):
联系方式:
原患疾病:
医院名称:
病历号/门诊号:
既往药品不良反应/事件:
有□无□不详□
家族药品不良反应/事件:
有□无□不详□
相关重要信息:
吸烟史□饮酒史□妊娠期□肝病史□肾病史□过敏史□其他□
药品
批准文号
商品名称
通用名称
(含剂型)
生产厂家
生产批号
用法用量
(次剂量、途径、日次数)
用药起止时间
用药原因
怀疑药品
并用药
品
不良反应/事件名称:
不良反应/事件发生时间:
年 月 日
不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况(可附页):
不良反应/事件的结果:
痊愈□好转□未好转□不详□有后遗症□表现:
死亡□直接死因:
死亡时间:
年月日
停药或减量后,反应/事件是否消失或减轻?
是□否□不明□未停药或未减量□
再次使用可疑药品后是否再次出现同样反应/事件?
是□否□不明□未再使用□
对原患疾病的影响:
不明显□病程延长□病情加重□导致后遗症□导致死亡□
关联性评价
报告人评价:
肯定□ 很可能□ 可能□ 可能无关□ 待评价□ 无法评价□ 签名:
报告单位评价:
肯定□ 很可能□ 可能□ 可能无关□ 待评价□ 无法评价□ 签名:
报告人信息
联系电话:
职业:
医生□ 药师□ 护士□其他□
电子邮箱:
签名:
报告单位信息
单位名称:
联系人:
电话:
报告日期:
年 月 日
生产企业请
填写信息来源
医疗机构□经营企业□个人□文献报道□上市后研究□其他□
备注
填写说明
一、严重药品不良反应是指因使用药品引起以下损害情形之一的反应:
1)导致死亡;
2)危及生命;
3)致癌、致畸、致出生缺陷;
4)导致显著的或者永久的人体伤残或者器官功能的损伤;
5)导致住院或者住院时间延长;
6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
二、新的药品不良反应是指药品说明书中未载明的不良反应。
药品不良反应在说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
三、报告时限
新的、严重的药品不良反应应于发现或者获知之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应30日内报告。
有随访信息的,应当及时报告。
四、关联性评价指标
肯定:
用药及反应发生时间顺序合理;反应符合该药已知的不良反应类型;停药或减量后,反应停止或减轻;再次使用可疑药品,反应再现;已排除并用药、原患疾病等其它因素影响。
很可能:
用药及反应发生时间顺序合理;反应符合该药已知的不良反应类型;停药或减量后,反应停止或减轻;已排除并用药、原患疾病等其它因素影响。
可能:
用药及反应发生时间关系密切;反应表现与已知该药ADR不相吻合;无法排除并用药、原患疾病等其它因素影响。
可能无关:
用药及反应发生时间相关性不密切;反应表现与已知该药ADR不相吻合;无法排除并用药、原患疾病等其它因素影响。
待评价:
需要补充材料才能评价。
无法评价:
评价的必需资料无法获得。
五、其他说明
怀疑药品:
是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:
指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
用法用量:
包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
六、报告的处理
所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系。
根据药品风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入警示信息,更新药品如何安全使用的信息等。
在极少数情况下,当认为药品的风险大于效益时,药品也会撤市。
附表2
药品群体不良事件基本信息表
发生地区:
使用单位:
用药人数:
发生不良事件人数:
严重不良事件人数:
死亡人数:
首例用药日期:
年月日
首例发生日期:
年月日
怀疑药品
商品名
通用名
生产企业
药品规格
生产批号
批准文号
器械
产品名称
生产企业
生产批号
注册号
本栏所指器械是与怀疑药品同时使用且可能与群体不良事件相关的注射器、输液器等医疗器械。
不良事件表现:
群体不良事件过程描述及处理情况(可附页):
报告单位
意见
报告人信息
电话:
电子邮箱:
签名:
报告单位
信息
报告单位:
联系人:
电话:
报告日期:
年 月 日
学生登记表
系别:
专业:
学制:
姓名:
填写日期年月日
学生工作处制
姓
名
现名
照
片
曾用名
籍贯
家庭住址
民族
现在家庭
详细住址
是否华侨
侨居何处
本人身体
健康状况
何时何地参加共产党和共青团
家庭经济情
况及主要
经济来源
何时何地因何种原因受过何种奖励或
处分
本人学历及社会经历
自何年何月起
至何年何月止
在何地、何校(或单位)
学习(或任何职)
证明人
家庭主要成员
和主要社会关
系,他们的姓
名、年龄、在
何地、何单位
、任何职、政
治面貌,现在
与本人的关系
何如
自我鉴定:
本人签名:
年月日
辅导员评定意见
辅导员签名
年月日
系意见
公章
年月日
毕业实习
单位和
主要内容
毕业论文
题目
本人有
何特长
懂何种外语
程度如何
本人工作
志愿
备注
院主管部门意见
公章年月