专题二 研究物质的实验方法 解析版Word格式.docx
《专题二 研究物质的实验方法 解析版Word格式.docx》由会员分享,可在线阅读,更多相关《专题二 研究物质的实验方法 解析版Word格式.docx(16页珍藏版)》请在冰豆网上搜索。
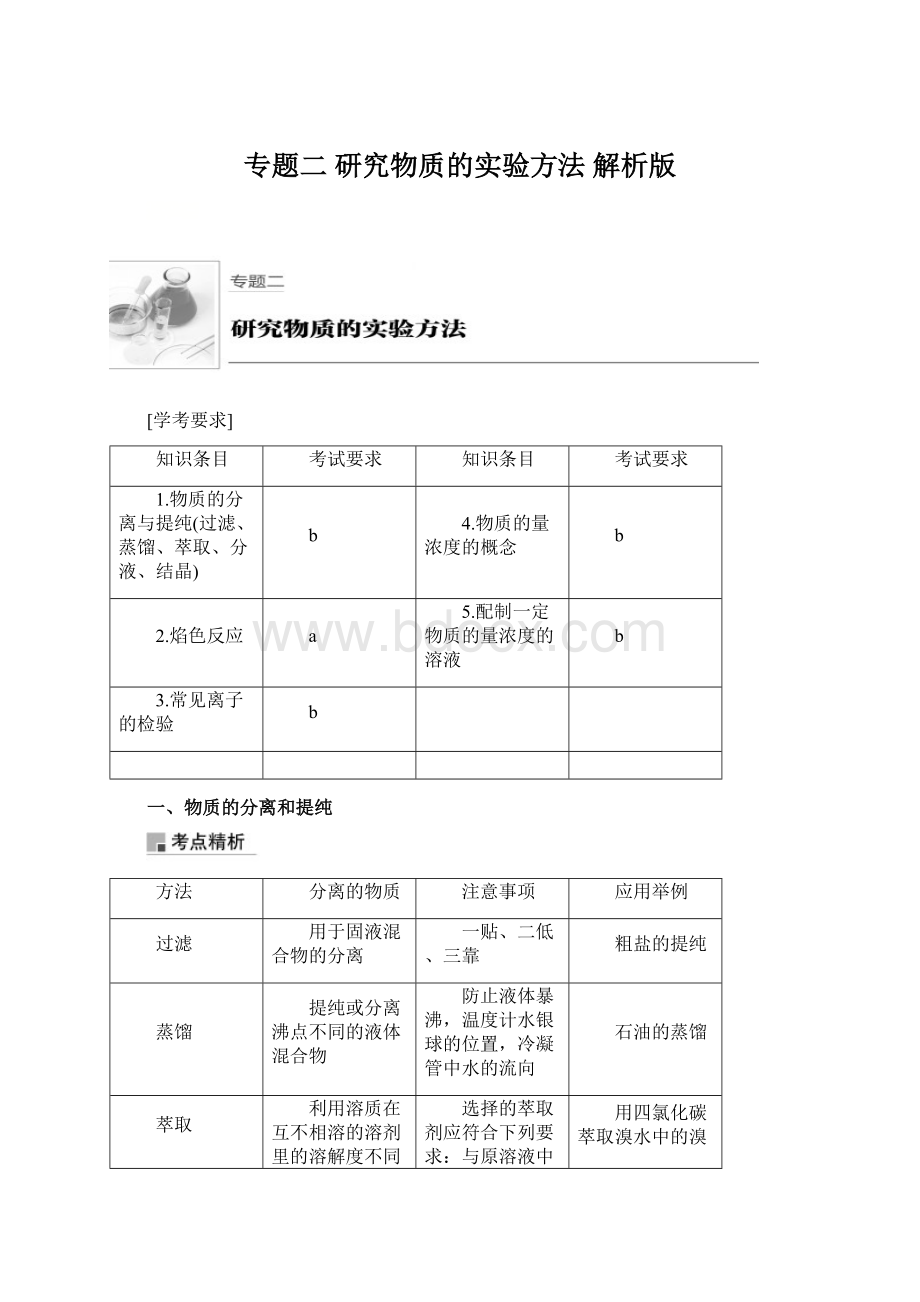
防止液体暴沸,温度计水银球的位置,冷凝管中水的流向
石油的蒸馏
萃取
利用溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂把溶质从它与另一种溶剂所组成的溶液中提取出来的方法
选择的萃取剂应符合下列要求:
与原溶液中的溶剂互不相溶;
对溶质的溶解度要远大于原溶剂
用四氯化碳萃取溴水中的溴
分液
分离互不相溶的液体
打开上端活塞或使活塞上的凹槽对准漏斗上的小孔,使漏斗内外空气相通。
打开活塞,使下层液体慢慢流出,及时关闭活塞,上层液体由上口倒出
用四氯化碳萃取溴水中的溴后再分液
蒸发和结晶
用来分离和提纯几种可溶性固体的混合物
加热蒸发皿使溶液蒸发时,要用玻璃棒不断搅拌溶液;
当蒸发皿中出现较多的固体时,应停止加热
分离NaCl和KNO3混合物
特别提醒
分离与提纯方法的选择是根据分离提纯物质的性质和状态来决定,混合物的状态主要有三类:
气体型、液体型、固体型。
(1)固—固混合分离型:
灼烧、热分解、结晶(或重结晶)。
(2)固—液混合分离型:
过滤、蒸发。
(3)液—液混合分离型:
萃取、分液、蒸馏。
(4)气—气混合分离型:
洗气。
1.(浙江学考组合题)下列操作合理的是( )
A.(2018·
浙江4月学考)可用蒸发结晶的方法从碘水中提取碘单质
B.(2017·
浙江4月学考)可用酒精代替CCl4萃取碘水中的碘单质
C.(2016·
浙江10月学考)用过滤的方法可以除去食盐水中的泥沙
D.(2016·
浙江4月学考)粗盐的提纯试验中,滤液在坩埚中加热蒸发结晶
答案 C解析 碘在有机溶剂中的溶解度比在水中的大,可用萃取的方法从碘水中提取碘,A错误;
酒精与水互溶,不能用酒精代替CCl4萃取碘水中的碘,B错误;
泥沙不溶于水,可用过滤的方法除去食盐水中的泥沙,C正确;
滤液蒸发时应在蒸发皿中进行,D错误。
2.下列实验操作中错误的是( )
A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B.蒸馏时,应使温度计水银球位于蒸馏烧瓶支管口处
C.萃取时,应选择有机萃取剂,且萃取剂的密度必须比水大
D.蒸发时,蒸发皿中出现大量固体时应停止加热
答案 C解析 为防止液体污染,分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,A正确;
蒸馏的原理:
通过控制沸点的不同来实现物质的分离,所以温度计水银球要靠近蒸馏烧瓶支管口处,B正确;
萃取剂的密度不一定比水大,C错误;
蒸发溶液当大量固体析出时,停止加热,靠余热蒸干,D正确。
3.(2018·
新高考研究联盟二模)下列实验操作中,不用于物质分离的是( )
答案 A解析 A操作是配制一定物质的量浓度的溶液,不用于分离,正确;
B操作是蒸发,用于物质分离,错误;
C操作是分液,用于物质分离,错误;
D操作是过滤,用于分离,D错误。
二、物质的检验
1.焰色反应
(1)实验用品:
铂丝、酒精灯、稀盐酸、蓝色钴玻璃(检验钾时用)。
(2)实验要点:
①将铂丝蘸稀盐酸在无色火焰上灼烧至无色,蘸取试样,在无色火焰上灼烧观察火焰颜色(检验钾需透过蓝色钴玻璃);
②钠元素的焰色反应为黄色,钾元素的焰色反应为紫色。
(3)焰色反应的应用:
检验某些用常规化学方法不能鉴定的金属元素,用于制作节日燃放的烟花等。
2.常见离子的检验
(1)Cl-检验:
加硝酸银产生的白色沉淀不溶于稀硝酸。
(2)SO检验:
加稀盐酸后无现象,再加入BaCl2溶液,产生白色沉淀。
(3)NH检验:
加入NaOH并加热,产生的气体使湿润的红色石蕊试纸变蓝。
(4)Fe3+检验:
加入KSCN溶液出现血红色,Fe3++3SCN-===Fe(SCN)3。
(5)Fe2+检验:
加入KSCN溶液不变色,滴加氯水后,溶液变为血红色。
3.常见气体的检验
气体
检验方法和现象
H2
(1)纯氢气在空气中燃烧,火焰呈淡蓝色,产物能使无水CuSO4变蓝
(2)点燃不纯的氢气有爆鸣声
CO2
通入澄清的石灰水中,石灰水变浑浊
O2
使带火星的木条复燃
Cl2
能使湿润的淀粉�KI试纸变为蓝色
SO2
(1)能使品红溶液褪色(加热后红色复现)
(2)使澄清石灰水变浑浊
检验混合气体的成分时,一定要设计合理的顺序,排除不同气体之间的相互干扰,如检验CO2和SO2混合气体时,要先用品红溶液检验SO2,再用酸性高锰酸钾溶液除去SO2,最后用澄清石灰水检验CO2。
4.(2018·
浙江6月学考)下列金属元素的单质或化合物在火焰上灼烧时,焰色为紫色的是( )
A.钠B.钾C.镁D.铁
答案 B
5.(2018·
浙江4月学考)某绿色溶液A含有H+、Na+、Mg2+、Fe2+、Cu2+、SO、Cl-、CO和HCO离子中的若干种,取该溶液进行如下实验(已知Ag2SO4微溶于水,可溶于酸):
①向溶液中滴加Ba(OH)2溶液,过滤,得到不溶于酸的白色沉淀和绿色滤液B;
②取滤液B,先用HNO3酸化,再滴加0.001mol·
L-1AgNO3溶液,有白色沉淀生成。
下列说法不正确的是( )
A.溶液A中一定存在H+、SO和Cl-
B.溶液A中不存在Mg2+、CO和HCO,不能确定Na+的存在
C.第②步生成的白色沉淀中只有AgCl,没有Ag2CO3
D.溶液A中存在Fe2+与Cu2+中的一种或两种,且可以用NaOH溶液判断
答案 B解析 根据①不溶于酸的白色沉淀,可知原溶液中必然含有SO,根据绿色滤液仍然存在,可知原溶液必然含有H+,必然不能存在CO以及HCO;
根据②不溶于硝酸的白色沉淀,可知原溶液中必然含有Cl-,沉淀必然为AgCl;
但是根据以上信息不能确定溶液绿色是Fe2+还是Cu2+引起的,所以两者都有可能存在;
根据以上信息不能确定Na+与Mg2+是否存在,所以B不正确。
6.(2017·
浙江11月学考)下列方法(必要时可加热)不合理的是( )
A.用澄清石灰水鉴别CO和CO2
B.用水鉴别苯和四氯化碳
C.用氢氧化钡溶液鉴别NH4Cl、(NH4)2SO4和K2SO4
D.用淀粉碘化钾试纸鉴别碘水和溴水
答案 D解析 A项,CO不能使澄清石灰水变浑浊,CO2可以使澄清石灰水变浑浊;
B项,苯的密度比水小,在上层,四氯化碳的密度比水大,在下层;
C项,氢氧化钡与NH4Cl混合加热产生有刺激性气味的气体,与(NH4)2SO4混合加热产生白色沉淀硫酸钡,同时产生有刺激性气味的气体,与K2SO4反应只产生白色沉淀,故可鉴别;
D项,碘水中有碘单质,溴水可以氧化淀粉碘化钾试纸中的碘离子,生成碘单质,都可以使淀粉碘化钾试纸变蓝,故无法鉴别,选D。
7.(2017·
浙江11月学考)取某固体样品,进行如下实验:
①取一定量的样品,加足量水充分溶解,过滤得到滤液和滤渣;
②取少量滤液,加入BaCl2溶液,有白色沉淀产生;
③取少量滤渣,加入稀盐酸,滤渣全部溶解,同时有气体产生。
根据上述实验现象,该固体样品的成分可能是( )
A.K2SO4、Ba(OH)2、Na2CO3
B.Na2CO3、AgNO3、KNO3
C.K2CO3、NaCl、Ba(NO3)2
D.KNO3、MgCl2、NaOH
答案 C解析 K2SO4、Ba(OH)2、Na2CO3混合物溶于水,滤渣中含有不溶于盐酸的BaSO4,不符合③的结果,故A错误;
Na2CO3、AgNO3、KNO3混合物溶于水,碳酸银为滤渣,其和盐酸反应生成二氧化碳气体和氯化银沉淀,不符合③的结果,故B错误;
K2CO3、NaCl、Ba(NO3)2混合物溶于水,碳酸钡为滤渣,可以完全溶于盐酸,生成二氧化碳气体,符合③的结果,滤液中可能是碳酸根离子剩余,也可能是钡离子剩余,若碳酸根离子有剩余,加入氯化钡会有白色沉淀,符合②的结果,故C正确;
KNO3、MgCl2、NaOH混合物溶于水,氢氧化镁为滤渣,其溶于盐酸无气体产生,不符合③的结果,故D错误。
三、一定物质的量浓度溶液的配制
1.物质的量浓度的概念
(1)物质的量浓度:
单位体积溶液中所含溶质B的物质的量。
符号cB,单位:
mol·
L-1。
(2)物质的量浓度与物质的量的关系公式:
cB=。
2.配制一定物质的量浓度的溶液
(1)容量瓶及其使用要求
①规格及特点:
常规的容量瓶有50mL、100mL、250mL、500mL、1000mL等数种。
②容量瓶上标有温度、容积、刻度线。
③在使用容量瓶之前,要先检查容量瓶容积与所要求的是否一致、瓶塞是否漏水。
(2)原理:
根据欲配制溶液的体积和溶质的物质的量浓度,用有关物质的量浓度计算的方法,求出所需溶质的质量或体积,在容器内将溶质用溶剂稀释为规定的体积,冷却后转移到容量瓶中,就得欲配制的溶液。
(3)仪器:
天平(称固体质量)或量筒(量取液体体积),药匙、烧杯、玻璃棒、容量瓶、胶头滴管。
(4)步骤:
①计算:
所需固体的质量或溶液的体积;
②称量:
天平称量固体或滴定管量取液体(准确量取);
③溶解:
在烧杯中用玻璃棒搅拌;
④转移:
冷却到室温时,用玻璃棒引流将烧杯中的溶液转移至选定容积的容量瓶中;
⑤洗涤:
将烧杯、玻璃棒洗涤2~3次,将洗涤液全部转移至容量瓶中;
⑥定容:
加水至液面接近容量瓶刻度线1~2cm处时,改用胶头滴管滴加蒸馏水至溶液的凹液面正好与刻度线相切;
⑦摇匀:
反复上下颠倒,摇匀;
⑧装瓶、贴签。
8.(2018·
杭州学军中学高一4月模拟)对1mol·
L-1的Na2SO4溶液的叙述中正确的是( )
A.溶液中含有1molNa2SO4B.1L溶液中含有142gNa2SO4
C.1molNa2SO4溶于1L水D.溶液中含有2molNa+
答案 B解析 溶液的体积未明确,A、D项错误;
B项,142gNa2SO4的物质的量为1mol,正确;
C项,溶液的体积不是1L,错误。
9.(2018·
“七彩阳光”期中联考)用固体NaOH配制250mL0.2mol·
L-1的NaOH,下列操作会导致溶液浓度偏高的是( )
A.定容时,仰视容量瓶的刻度线
B.在托盘天平的两托盘中分别放等质量的纸,称取2.0gNaOH固体
C.将NaOH固体在烧杯中溶解后迅速转移至250mL容量瓶中
D.定容时不小心加水超过了刻度线,此时迅速用胶头滴管吸出一些
答案 C解析 定容时,仰视容量瓶的刻度线,体积偏大,浓度偏低;
称取2.0gNaOH固体,实际称量NaOH质量偏小,n偏小,则导致溶液浓度偏低,应在小烧杯中称量;
将NaOH固体在烧杯中溶解后迅速小心转移至250mL容量瓶中,V偏小,则导致溶液浓度偏高,应冷却后转移;
定容时不小心加水超过了刻度线,此时迅速用胶头滴管吸出一些,n偏小,则导致溶液浓度偏低。
10.(2016·
浙江10月学考)用无水Na2CO3固体配制250mL0.1000mol·
L-1的溶液。
请回答下列问题:
(1)在配制过程中不必要的玻璃仪器是________。
A.烧杯 B.量筒 C.玻璃棒 D.胶头滴管 E.容量瓶
(2)定容时的操作:
当液面接近容量瓶刻度线时,_____________________________________,再将容量瓶塞盖好,反复上下颠倒,摇匀。
(3)下列操作