浓差电池练习题Word下载.docx
《浓差电池练习题Word下载.docx》由会员分享,可在线阅读,更多相关《浓差电池练习题Word下载.docx(12页珍藏版)》请在冰豆网上搜索。
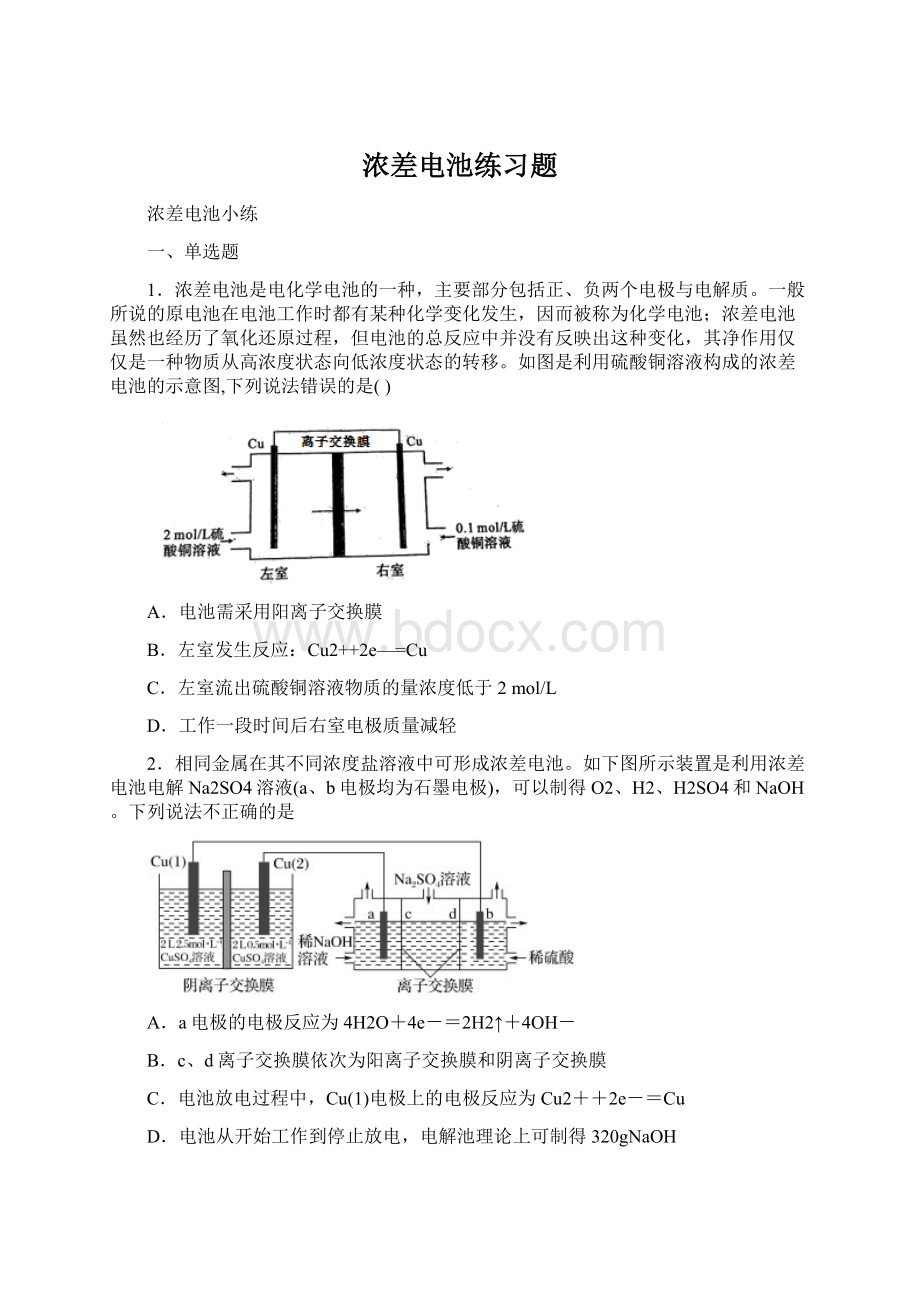
A.a电极的电极反应为4H2O+4e-=2H2↑+4OH-
B.c、d离子交换膜依次为阳离子交换膜和阴离子交换膜
C.电池放电过程中,Cu
(1)电极上的电极反应为Cu2++2e-=Cu
D.电池从开始工作到停止放电,电解池理论上可制得320gNaOH
3.利用电解质溶液的浓度对电极电势的影响,可设计浓差电池。
某热再生浓差电池工作原理如图所示,通入NH3时电池开始工作,左侧电极质量减少,右侧电极质量增加,中间A为阴离子交换膜,放电后可利用废热进行充电再生。
已知:
Cu2++4NH3,下列说法不正确的是
A.放电时,左侧电极发生氧化反应:
Cu+4NH3-2e−=
B.放电时,电池的总反应为Cu2++4NH3,ΔH>0
C.放电时,经离子交换膜由右侧向左侧迁移
D.上述原电池的形成说明,相同条件下,的氧化性比Cu2+的氧化性弱
4.由相同金属电极及其不同浓度的盐溶液组成的电池称为浓差电池,电子由溶液浓度较小的一极流向浓度较大的一极。
如图所示装置中,X电极与Y电极初始质量相等。
进行实验时,先闭合K2,断开K1,一段时间后,再断开K2,闭合K1,即可形成浓差电池,电流计指针偏转。
下列不正确的是
A.充电前,该电池两电极不存在电势差
B.放电时,右池中的NO3-通过离了交换膜移向左池
C.充电时,当外电路通过0.1mol电子时,两电极的质量差为10.8g
D.放电时,电极Y为电池的正极
5.因存在浓度差而产生电动势的电池称为浓差电池。
利用如图所示装置进行实验,开始先闭合K2,断开Kl,电解一段时间后,再断开K2,闭合Kl,形成浓差电池,电流计指针偏转(Ag+浓度越大,氧化性越强)。
A.闭合K2,断开Kl,NO3-从左池向右池移动
B.断开K2,闭合K1,X为正极
C.闭合K2,断开Kl一段时间后,右池c(AgNO3)增大
D.装置安装后若直接闭合Kl,电流计指针不发生偏转,但往左池加入适当的氨水后,指针偏转
6.2019年度诺贝尔化学奖授予在锂离子电池发展做出贡献的三位科学家。
某浓差电池的原理示意如图所示,可用该电池从浓缩海水中提取LiCl溶液。
下列有关该电池的说法不正确的是()
A.该装置可在提取LiCl溶液的同时得电能
B.电子由Y极通过外电路移向X极
C.正极发生的反应为:
2H++2e—===H2↑
D.Y极每生成22.4LCl2,有2molLi+从b区移至a区
7.下图是常温钠离子全固态浓差电池工作示意图。
正极材料为层状含钠过渡金属氧化物,负极为钠锡合金(Na15Sn4)。
下列说法合理的是(
)。
A.该电池工作时不发生氧化还原反应B.放电时,负极的反应为:
Na15Sn4-15e-=15Na++4Sn
C.充电时,Na+会被吸附进入过渡金属氧化层D.充电时,a极接电源的负极,b极接电源的正极
8.某种浓差电池的装置如图所示,碱液室中加入电石渣浆液[主要成分为],酸液室通入(以NaCl为支持电解质),产生电能的同时可生产纯碱等物质。
下列叙述正确的是()
A.电子由N极经外电路流向M极
B.N电极区的电极反应式为↑
C.在碱液室可以生成
D.放电一段时间后,酸液室溶液pH减小
二、多选题
9.一种浓差电池如图所示,阴、阳离子交换膜交替放置,中间的间隔交替充以河水和海水,选择性透过Cl−和Na+,在两电极板形成电势差,进而在外部产生电流。
下列关于该电池的说法正确的是()
A.a电极为电池的正极,电极反应为2H++2e−═H2↑
B.C为阴离子交换膜,A为阳离子交换膜
C.负极隔室的电中性溶液通过阳极表面的还原作用维持
D.该电池的缺点是离子交换膜价格昂贵,优点是电极产物有经济价值
10.某热再生电池工作原理如图所示。
通入时电池开始工作,左边电极棒不断溶解,右边电极棒不断增厚,中间a为离子交换膜,放电后可通过废热进行充电。
已知电池总反应:
,该反应的。
下列说法不正确的是()
A.此电池为二次电池
B.放电时,左边电极发生氧化反应
C.a为阳离子交换膜
D.放电时,转移0.2mol电子,两电极质量变化差为6.4g
三、原理综合题
11.锂离子电池应用很广。
某种锂离子二次电池的电极材料主要是钴酸锂(LiCoO2)和石墨。
钴是一种稀有的贵重金属,废旧锂离子电池电极材料的回收再生意义重大。
(1)锂离子电池(又称锂离子浓差电池)的充电过程:
Li+从含LiCoO2的电极中脱出,正三价Co被氧化,此时该极处于贫锂态(Li1-xCoO2)。
①放电时,电流从___(填“a”或“b”)极流出。
②充电时,a极的电极反应式为___。
(2)钴酸锂回收再生流程如下:
①用H2SO4酸浸时,通常添加30%的H2O2以提高浸出效率,其中H2O2的作用是___。
②用盐酸代替H2SO4和H2O2,浸出效率也很高,但工业上不使用盐酸,主要原因之一是:
会产生有毒、有污染的气体。
写出相应反应的化学方程式___。
③其他条件不变时,相同反应时间,随着温度升高,含钴酸锂的固体滤渣在H2SO4和30%H2O2混合液中的浸出率曲线如图,请解释温度高于80℃,钴的浸出率变化的原因:
___。
④高温下,在O2存在时纯净的CoC2O4与Li2CO3再生为LiCoO2的化学方程式为___。
参考答案
1.A
【解析】
【分析】
左室发生的反应为,右室发生的反应为,离子从左室移动到右室。
【详解】
A.根据分析,电池需采用阴离子交换膜,A错误;
B.左室发生的反应为,B正确;
C.左室Cu2+发生还原反应,其物质的量减少,故左室流出硫酸铜溶液物质的量浓度低于2mol/L,C正确;
D.右室Cu棒发生氧化反应,铜不断溶解,质量减轻,D正确;
故答案选A。
2.D
浓差电池放电时,两个电极区的浓度差会逐渐减小,当两个电极区硫酸铜溶液的浓度完全相等时,放电停止,电池放电过程中,Cu
(1)电极上发生使Cu2+浓度降低的还原反应,作正极,Cu
(2)电极上发生使Cu2+浓度升高的氧化反应,作负极,则在右池的电解池中,a为电解池的阴极,H2O中的H+得到电子发生还原反应生成H2,b为电解池的阳极,H2O中的OH-失去电子发生氧化反应生成O2,据此分析解答问题。
A.根据上述分析可知,a为电解池的阴极,H2O中的H+得到电子发生还原反应生成H2,电极反应为4H2O+4e-=2H2↑+4OH-,A选项正确;
B.电解过程中,两个离子交换膜之间的硫酸钠溶液中,Na+通过阳离子交换膜c进入阴极区,SO42-通过阴离子交换膜d进入阳极区,B选项正确;
C.电池放电过程中,Cu
(1)电极上发生使Cu2+浓度降低的还原反应,作正极,电极反应为Cu2++2e-=Cu,C选项正确;
D.电池从开始工作到停止放电,正极区硫酸铜溶液的浓度同时由2.5mol·
L-1降低到1.5mol·
L-1,负极区硫酸铜溶液同时由0.5mol·
L-1升到1.5mol·
L-1,正极反应可还原Cu2+的物质的量为2L×
(2.5-1.5)mol·
L-1=2mol,电路中转移4mol电子,电解池的阴极生成4molOH-,即阴极区可得4mol氢氧化钠,其质量为160g,D选项错误;
答案选D。
3.B
A.根据题中给出的电池开始工作时,左侧电极质量减少,右侧电极质量增加,可知,左侧电极为负极,发生氧化反应,电极反应方程式为:
Cu+4NH3-2e−=,A项正确;
B.通入NH3时电池开始工作,左侧电极质量减少,左侧电极反应方程式为:
Cu+4NH3-2e−=;
右侧电极质量增加,则右侧电极作正极,其电极方程式为:
Cu2++2e-=Cu,则电池的总反应为:
Cu2++4NH3,结合题给信息可知,ΔH<0,B项错误;
C.放电时,阴离子向负极移动,阳离子向正极移动,结合题给信息,A为阴离子交换膜,则放电时,经离子交换膜由右侧向左侧迁移,C项正确;
D.由原电池的总反应为氧化还原反应可知,氧化性:
Cu2+>,D项正确;
答案选B。
4.C
由题意可知,本题考查电化学原理的应用,运用电解池和原电池原理分析。
A.充电前,左右两池浓度相等,则两极不存在电势差,A项正确;
B.由以上分析可知形成原电池时X为负极,Y为正极,阴离子向负极移动,则右池中的NO3-通过离了交换膜移向左池,B项正确;
C.当外电路通过0.1mol电子时,阳极有0.1molAg被氧化,而阴极析出0.1molAg,质量都为10.8g,则两电极的质量差为21.6g,C项错误;
D.放电时,右池硝酸银浓度较大,则电极Y为电池的正极,D项正确;
答案选C。
【点睛】
在原电池中,阴离子向负极移动,阳离子移向正极。
5.B
闭合K2,断开K1,为电解装置,Y为阳极,阳极金属银被氧化,X为阴极,阴极析出银,NO3-向阳极移动,左池浓度增大,右池浓度减小;
断开K2,闭合K1后,形成浓差电池,电流计指针偏转(Ag+浓度越大氧化性越强),可知Y为正极,发生还原反应,X为负极,发生氧化反应,NO3-向负极移动。
A.闭合K2,断开Kl,右边(Y极)为阳极,NO3-从左池向右池移动,正确;
B.断开K2,闭合K1,X为负极,不正确;
C.闭合K2,断开Kl一段时间后,右池c(AgNO3)增大,正确;
D.装置安装后若直接闭合Kl,电流计指针不发生偏转,但往左池加入适当的氨水后,左池银离子浓度降低,产生浓度差,形成原电池,指针偏转,正确。
本题考查原电池与电解池原理,结合原电池和电解池原理分析,闭合K2,断开K1,为电解装置,阳极金属银被氧化,阴极析出银,NO3-向阳极移动,右池浓度增大,左池浓度减小;
断开K1,闭合K1后,形成浓差电池,电流计指针偏转(Ag+浓度越大氧化性越强),可知Y为正极,发生还原反应,X为负极,发生氧化反应,NO3-向负极移动。
6.D
该模型为原电池模型,原电池中发生氧化反应的一极为负极,发生还原反应的一极为正极,由图分析可知,生成氢气的一极(X极)为正极,生成氯气的一极(Y极)为负极,据此可判断下列选项;
A.该电池为原电池模型,可将化学能转化为电能,故在提取LiCl溶液的同时得电能,A选项正确;
B.电子由负极通过外电路移向正极,B选项正确;
C.H+在正极得到电子,故正极发生的反应为:
2H++2e—===H2↑,C选项正确;
D.未指明在标准状况下,不能直接用Vm=22.4进行计算,D选项错误;
7.B
A.该电池放电时,是原电池工作原理,充电时,是电解池的工作原理,无论是放电还是充电均发生了氧化还原反应,故A错误;
B.该电池放电时,是原电池工作原理,负极上为钠锡合金(Na15Sn4