版导与练一轮复习化学习题第五章 物质结构 元素周期律 第17讲 元素周期表 元素周期律含答案解析Word格式.docx
《版导与练一轮复习化学习题第五章 物质结构 元素周期律 第17讲 元素周期表 元素周期律含答案解析Word格式.docx》由会员分享,可在线阅读,更多相关《版导与练一轮复习化学习题第五章 物质结构 元素周期律 第17讲 元素周期表 元素周期律含答案解析Word格式.docx(9页珍藏版)》请在冰豆网上搜索。
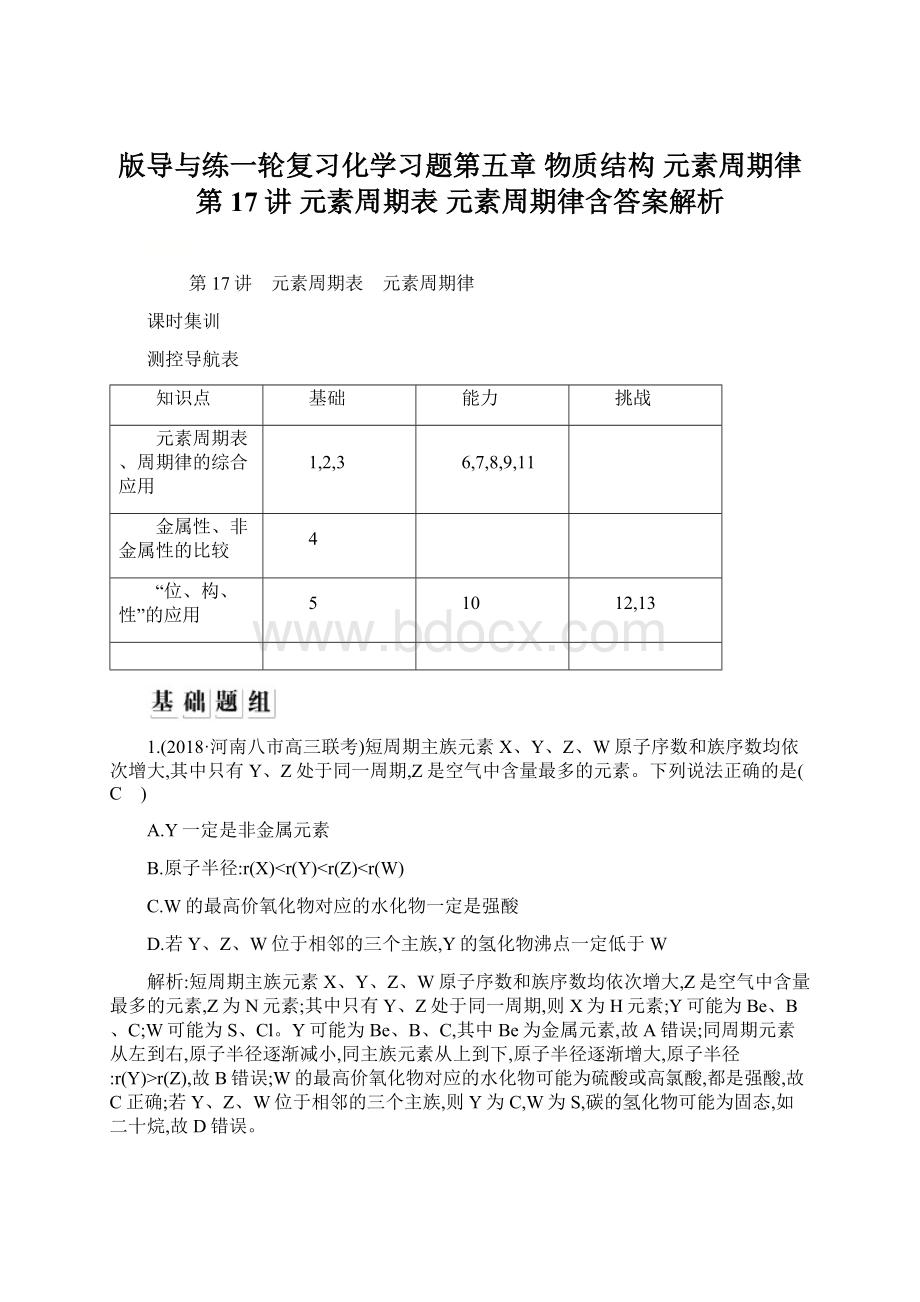
r(Z)<
r(W)
C.W的最高价氧化物对应的水化物一定是强酸
D.若Y、Z、W位于相邻的三个主族,Y的氢化物沸点一定低于W
解析:
短周期主族元素X、Y、Z、W原子序数和族序数均依次增大,Z是空气中含量最多的元素,Z为N元素;
其中只有Y、Z处于同一周期,则X为H元素;
Y可能为Be、B、C;
W可能为S、Cl。
Y可能为Be、B、C,其中Be为金属元素,故A错误;
同周期元素从左到右,原子半径逐渐减小,同主族元素从上到下,原子半径逐渐增大,原子半径:
r(Y)>
r(Z),故B错误;
W的最高价氧化物对应的水化物可能为硫酸或高氯酸,都是强酸,故C正确;
若Y、Z、W位于相邻的三个主族,则Y为C,W为S,碳的氢化物可能为固态,如二十烷,故D错误。
2.(2018·
湖北武汉重点中学高三调研)已知W、X、Y、Z为短周期元素,原子序数依次增大。
W、Z同主族,X、Y、Z同周期,其中只有X为金属元素。
下列说法一定正确的是( A )
A.原子半径:
X>
Y>
Z>
W
B.W的含氧酸的酸性比Z的含氧酸的酸性强
C.W的气态氢化物的稳定性小于Y的气态氢化物的稳定性
D.若W与X原子序数差为5,则形成化合物的化学式为X3W2
由于是短周期,原子序数按W、X、Y、Z依次增大,W与Z是同一主族的元素,而X、Y、Z是同一周期的元素,且只有X是金属元素,则这四种元素在周期表中的相对位置关系如下:
X
Y
Z
则W可能是N、O、F,Z可能是P、S、Cl,X可能是Na、Mg、Al,Y可能是Si、P、S,举例验证可得只有A正确。
3.(2018·
山东潍坊高三期中)依据元素周期表及元素周期律,下列推断正确的是( B )
A.H2BO3酸性比H2CO3酸性强
B.Mg(OH)2碱性比Be(OH)2碱性强
C.HCl、HBr、HI的热稳定性依次增强
D.若M+和R2-的核外电子排布相同,则原子序数:
R>
M
同周期元素非金属性越强,最高价氧化物对应的水化物的酸性越强,同周期从左向右非金属性增强,则H3BO3的酸性比H2CO3弱,A错误;
金属性越强,其最高价氧化物对应水化物的碱性越强,同主族从上到下,金属性增强,则Mg(OH)2的碱性比Be(OH)2的强,B正确;
氢化物的热稳定性与其非金属性强弱有关,非金属性越强,其氢化物越稳定,氯、溴、碘从上到下非金属性减弱,则HCl、HBr、HI的热稳定性依次减弱,C错误;
M+和R2-的核外电子排布相同,则M在R的下一周期,则原子序数:
M>
R,D错误。
4.(2018·
江西师大附中高三模拟)下列叙述能说明X的非金属性比Y强的是( C )
A.Y的单质能将X从NaX的溶液中置换出来
B.Y在暗处可与H2反应,X在加热条件下才能与H2反应
C.X的气态氢化物比Y的气态氢化物稳定
D.X原子的电子层数比Y原子的电子层数多
Y的单质能将X从NaX的溶液中氧化出来,说明Y的非金属性比X强;
Y在暗处可与H2反应,X在加热条件下才能与H2反应,说明Y的非金属性比X强;
X的气态氢化物比Y的气态氢化物稳定,说明X的非金属性比Y强;
X原子的电子层数比Y原子的电子层数多,不能说明X的非金属性比Y强。
5.(2018·
河北衡水高三期中)有五种短周期主族元素,它们在周期表中的位置如图所示,已知R元素的最高正化合价与最低负化合价的代数和为0。
完成下列问题:
(1)Z元素在周期表中的位置是 ,同周期原子半径最大的元素是 (填元素符号)。
(2)X的简单氢化物与M的单质,在一定条件下可以发生置换反应,化学方程式为 ,还原产物中含有的化学键类型有 。
(3)我国发射“神舟”系列飞船的长征火箭,常以X、Y的液态氢化物作燃料。
已知X、Y的两种氢化物电子数相等,并且反应时生成两种无毒、无污染的物质。
①写出两种氢化物反应的化学方程式:
,反应中氧化剂和还原剂的物质的量之比为 。
②X的液态氢化物的电子式:
。
(4)下列说法能证明R、Y非金属性强弱的是 。
A.R和Y的单质在一定条件下能生成RY2
B.Y单质常温下是气体,R单质是固体
C.Y的氢化物稳定性大于R的氢化物
D.自然界中存在Y单质不存在R单质
答案:
(1)第三周期第ⅢA族 Na
(2)8NH3+3Cl2N2+6NH4Cl 离子键、共价键
(3)①N2H4+2H2O2N2+4H2O 2∶1
②
(4)C
6.(2019·
江淮十校高三联考)几种短周期元素的原子半径及主要化合价如下表:
元素代号
R
Q
原子半径
(×
10-10m)
1.86
0.99
1.43
1.60
0.75
0.74
主要
化合价
最高正价
+1
+7
+3
+2
+5
-
最低负价
-1
-3
-2
下列说法错误的是( A )
A.Q2-比R3-更容易失去电子
B.X、Z、R的最高价氧化物的水化物之间可两两相互反应
C.元素X和Q形成的化合物中可能既含离子键,也含共价键
D.元素形成的气态氢化物稳定性:
Q>
一般地,主族元素的最高正价=主族序数。
Y的最高正价为+7,所以Y是氯而不是氟。
Q只有最低负价-2、没有一般意义上的最高正价,所以Q是氧。
R最高正价是+5,而且R的原子半径小于氯,所以R是氮而不是磷。
X、M、Z的最高正价分别是+1、+2、+3,原子半径:
氯,所以X、M、Z分别是钠、镁、铝。
非金属性:
R,所以还原性:
Q2-<
R3-,故A错误;
X、Z、R的最高价氧化物的水化物分别是氢氧化钠、氢氧化铝和硝酸,它们之间可两两相互反应,故B正确;
元素X和Q形成的化合物如过氧化钠,既含离子键,也含共价键,故C正确;
Y,所以元素形成的气态氢化物的稳定性:
Y,故D正确。
7.(2018·
山西实验中学高三月考)X、Y、Z、W、R均为短周期主族元素,原子序数依次增加,X与W、Y与R分别同主族。
Z在短周期元素中金属性最强,W元素原子的次外层电子数为最外层电子数的2倍,R的原子序数是Y的2倍。
下列叙述错误的是( B )
W>
B.最高价含氧酸酸性:
C.简单离子半径:
D.气态氢化物稳定性:
在短周期中金属性最强的是Na,所以Z是Na,W元素原子的次外层电子数为最外层电子数的2倍,可以是Li或Si,但W的原子序数大于Z,故W是Si,X与W同主族,所以X是C,Y与R同主族,且R的原子序数是Y的2倍,故Y是O,R是S。
根据元素周期律,Si的原子半径大于C,C的原子半径大于O,所以Si的原子半径大于O,即W>
Y,故A正确;
因S的非金属性大于Si,故最高价含氧酸的酸性H2SO4>
H2SiO3,即R>
W,故B错误;
钠离子和氧离子的核外电子排布相同,根据“序大径小”的原则,O2->
Na+,即Y>
Z,故C正确;
因O的非金属性大于S的非金属性,所以气态氢化物的稳定性H2O>
H2S,即Y>
R,故D正确。
8.(2018·
河南商丘九校高三联考)有电子层数相同的短周期元素X、Y、Z、W,其中X的最外层电子数比K层少1个,Y的最外层电子数比K层多1个,Z的单质常用于制造太阳能电池,W的原子半径是同周期主族元素中最小的。
下列推断中正确的是( D )
A.Z的简单氢化物的热稳定性强于W的简单氢化物
B.Z的氧化物与水反应可制得相应的含氧酸
C.X、Y、W的原子半径依次减小,对应的简单离子半径依次增大
D.X、Y、W的最高价氧化物对应的水化物之间互相都能发生反应
电子层数相同的短周期元素X、Y、Z、W,Z的单质常用于制造太阳能电池,Z为Si;
X的最外层电子数比K层少1,则X为Na;
Y的最外层电子数比K层多1,则Y为Al;
W的原子半径是同周期中最小的,则W为Cl。
非金属性Cl>
Si,则W的简单氢化物的热稳定性强于Z的简单氢化物,故A错误;
二氧化硅不与水反应,故B错误;
Na、Al、Cl在同周期,原子半径依次减小,氯离子的半径最大,铝离子半径最小,故C错误;
X、Y、W的最高价氧化物对应水化物分别为NaOH、Al(OH)3、HClO4,Al(OH)3具有两性,则水化物之间互相都能发生反应,故D正确。
9.(2018·
吉林长春高三一模)已知A、B、C均为短周期元素,A、B同周期,A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构,下列说法中正确的是( A )
A.离子半径:
A2->
C->
B2+
B.C元素的最高正价为+7价
C.对应气态氢化物的稳定性:
H2A>
HC
D.还原性:
A2-
由A、C的最低价离子分别为A2-和C-,则A为ⅥA族元素,C为ⅦA族元素,B2+和C-具有相同的电子层结构,则B在C的下一周期,则B为Mg元素,C为F元素,A、B同周期,则A为S元素。
离子的电子层数越多,半径越大,具有相同核外电子排布的离子,核电荷数越大,半径越小,所以离子半径A2->
B2+,A正确;
C为F元素,无正价,B错误;
C为F元素,A为S元素,F的非金属性大于S元素,所以HF的稳定性大于H2S,即对应气态氢化物的稳定性H2A<
HC,C错误;
元素的非金属性越强,对应阴离子的还原性越弱,则有还原性A2->
C-,D错误。
10.(2018·
河南商丘九校联考)下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
族
周期
ⅠA
1
①
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
2
③
④
3
⑤
⑥
⑦
⑧
⑨
(1)画出元素⑦的原子结构示意图:
。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
(填化学式)。
(3)①、④、⑤、⑨中的某些元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的化学式:
。
(4)写出元素③的气态氢化物与其最高价含氧酸反应的化学方程式:
;
写出元素②的单质与元素⑧最高价含氧酸浓溶液反应的化学方程式:
。
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
X溶液与Y溶液反应的离子方程式为
(1)
(2)HNO3>
H2CO3>
H2SiO3 (3)NaOH(或NaClO或NaClO2或NaClO3或NaClO4等) (4)HNO3+NH3NH4NO3 C+2H2SO4(浓)CO2↑+2SO2↑+2H2O (5)Al3++3NH3·
H2OAl(OH)3↓+3N
11.(2018·
山东临沂高三调研)下表为部分短周期元素在元素周期表中的位置,回答下列问题:
Ⅶ