高考化学大二轮练习讲解第一章第3讲物质的量气体摩尔体文档格式.docx
《高考化学大二轮练习讲解第一章第3讲物质的量气体摩尔体文档格式.docx》由会员分享,可在线阅读,更多相关《高考化学大二轮练习讲解第一章第3讲物质的量气体摩尔体文档格式.docx(25页珍藏版)》请在冰豆网上搜索。
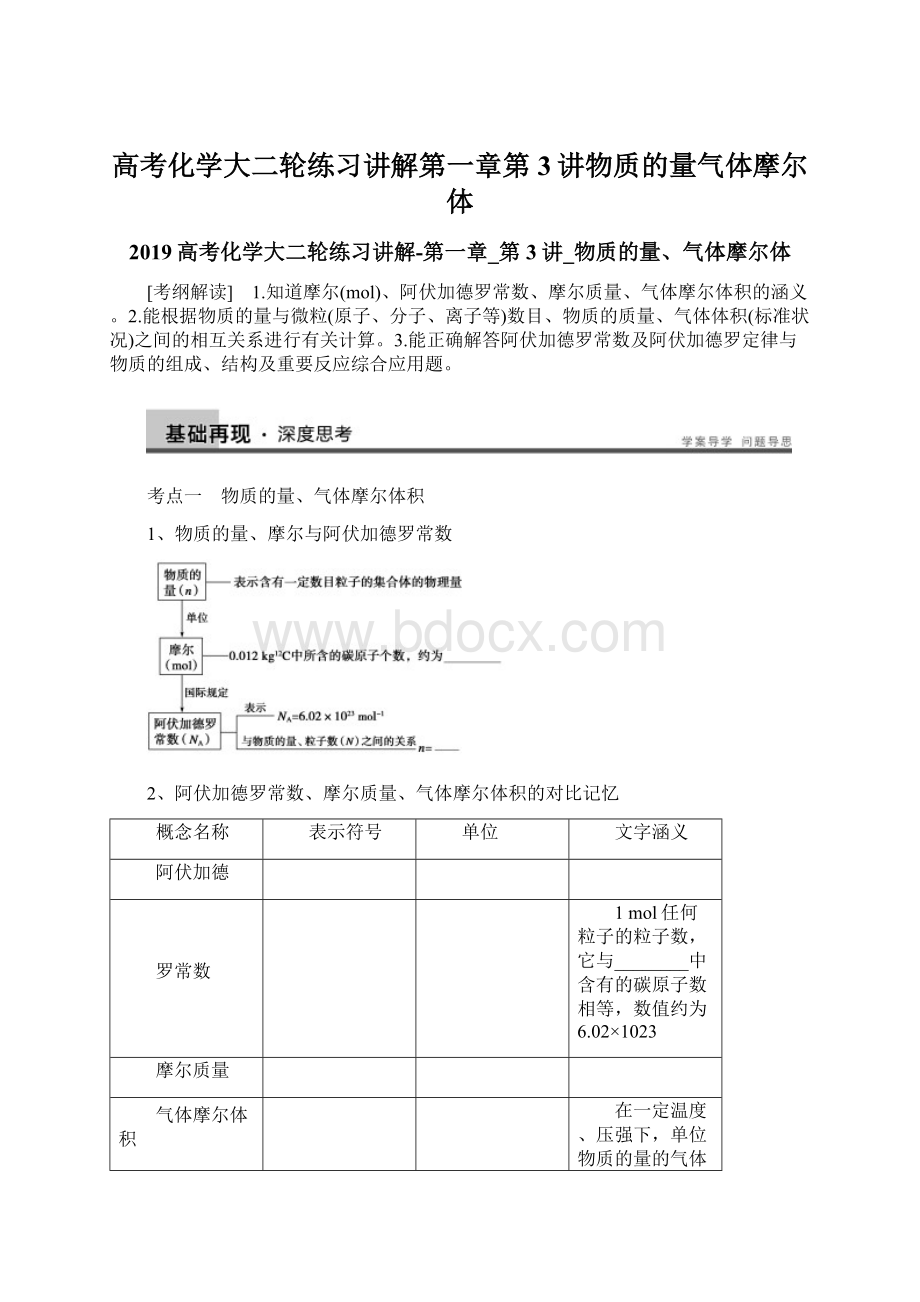
g·
mol-1),在数值上与相对原子质量(Ar)或相对分子质量(Mr)相等。
(3)使用气体摩尔体积时应注意:
①物质是否是气体;
②是否指出温度和压强。
(4)标准状况是指:
0℃、1.01×
105Pa。
1、根据你对物质的量、摩尔质量、气体摩尔体积的理解回答以下问题:
(1)1molNaCl和1molHCl所含的粒子数相同吗?
(2)阿伏加德罗常数(NA)与6.02×
1023完全相同吗?
(3)摩尔质量、相对分子质量、1mol物质的质量三者的区别和联系。
(4)标准状况下,1mol气体的体积是22.4L,如果当1mol气体的体积是22.4L时,一定是标准状况吗?
2、有关物质的量的计算
(1)2molCO(NH2)2中含________molC,________molN,________molH,所含氧原子跟________molH2O所含氧原子个数相等。
(2)①标准状况下,22.4LCH4;
②1.5molNH3;
③1.806×
1024个H2O;
④标准状况下,73gHCl所含H原子个数由多到少的顺序是______________________。
(3)2.3gNa中含________mole-,在跟足量水反应中产生标准状况下的H2______L。
(4)含0.4molAl2(SO4)3的溶液中,含________molSO,Al3+物质的量________0.8mol(填“>
”、“<
”或“=”)。
3、设NA为阿伏加德罗常数,如果ag某气态双原子分子的分子数为p,那么bg该气体在标准状况下的体积V(L)是( )
A.B.C.D.
物质的量通过摩尔质量、气体摩尔体积、阿伏加德罗常数将宏观物理量物质的质量、气体的体积与微观物理量微粒个数、微粒的质量联系起来。
考点二 阿伏加德罗定律及推论的应用
1、阿伏加德罗定律:
同温同压下,相同________的任何气体,含有________数目的分子(或气体的物质的量相同)。
2、阿伏加德罗定律的推论(可通过pV=nRT及n=、ρ=导出)
相同条件
结论
公式
语言表达
T、p
相同
T、V
=
同温、同压下,气体的密度与其摩尔质量(或相对分子质量)成正比
特别提醒
(1)阿伏加德罗定律的适用范围是气体,其适用条件是三个“同”,即在同温、同压、同体积的条件下,才有分
子数相等这一结论,但所含原子数不一定相等。
(2)阿伏加德罗定律既适合于单一气体,也适合于混合气体。
4、常温常压下,两个容积相同的烧瓶中分别盛满X和Y两种气体,打开开关a,使两烧瓶内的气体相通,最后容器内的压强由大到小的顺序排列正确的选项是( )
编号
①
②
③
④
气体X
HI
NH3
H2
NO
气体Y
Cl2
HCl
O2
A、②>
③>
①>
④B、③>
①=④>
C、③>
④>
②D、④>
②>
5、某校化学小组学生进行“气体相对分子质量的测定”的实验,操作如下:
用质量和容积都相等的烧瓶收集气体,称量收集满气体的烧瓶质量。
数据见下表(已换算成标准状况下的数值)。
气体烧瓶和气体的总质量(g)气体烧瓶和气体的总质量(g)
A48.4082D48.3822
B48.4082E48.4342
C48.4082F48.8762
标准状况下,烧瓶的容积为0.293L,烧瓶和空气的总质量为48.4212g,空气的平均相对分子质量为29。
A、B、C、D、E、F是中学常见的气体。
(1)上述六种气体中,能够使品红溶液褪色的是(写化学式)____________________。
(2)E的相对分子质量是_____________________________________________________。
(3)实验室制取少量D的化学方程式是_________________________________________。
(4)A、B、C可能的化学式是_________________________________________________。
求气体的摩尔质量M的常用方法
(1)根据标准状况下气体的密度ρ:
M=ρ×
22.4(g·
mol-1);
(2)根据气体的相对密度(D=ρ1/ρ2):
M1/M2=D;
(3)根据物质的质量(m)和物质的量(n):
M=m/n;
(4)根据一定质量(m)的物质中微粒数目(N)和阿伏加德罗常数(NA):
M=NA·
m/N;
(5)对于混合气体,求其平均摩尔质量,上述计算式仍然成立;
还可以用下式计算:
=×
a%+×
b%+×
c%……,a%、b%、c%指混合物中各成分的物质的量分数(或体积分数)。
跨越阿伏加德罗常数判断的“六个陷阱”
【例1】 关于阿伏加德罗常数的20个问题汇总。
下表中各种说法是否正确?
简要解释原因。
表达
解释
①2.24LCO2中含有、
的原子数为0.3NA
②0.1L3.0mol·
L-1的
NH4NO3溶液中含有的
NH数目为0.3NA
③5.6g铁粉与硝酸反应
失去的电子数一定为0.3NA
④4.5gSiO2晶体中含有
的硅氧键数目为0.3NA
⑤常温下11.2L甲烷气体
含有甲烷分子数为0.5NA个
⑥5.6g铁与足量的稀硫
酸反应失去电子数为0.3NA个
⑦2mol钠与过量稀盐酸
反应生成NA个H2分子
⑧30g甲醛中含共用电子
对总数为4NA
⑨标准状况下,22.4L氦
气与22.4L氟气所含原子
数均为2NA
⑩相同条件下,N2和O3的
混合气体与等体积的N2所
含原子数相等
⑪1.0L1.0mol·
L-1CH3COOH
溶液中,CH3COOH分子数为NA
⑫Na2O2与CO2反应生成
11.2LO2(标准状况),反
应中转移的电子数为2NA
⑬46gNO2和N2O4的混合
物含有的原子数为3NA
⑭10g46%的乙醇水溶液
中所含H原子个数为0.6NA
⑮2molSO2和1molO2在
一定条件下充分反应后,
混合物的分子数为2NA
⑯常温常压下,3.2gO3
所含的原子数为0.2NA
⑰18gD2O所含的电子
数为10NA
⑱1L1mol·
L-1饱和FeCl3
溶液滴入沸水中完全水解
生成Fe(OH)3胶粒NA个
⑲1molNa2O2固体中含
离子总数为4NA
⑳标准状况下,22.4L己
烷中含共价键数目为19NA
归纳总结 阿伏加德罗常数(NA)为背景选择题的六种设陷方式:
陷阱一 气体摩尔体积适用条件
22、4L·
mol-1指在标准状况下(0℃101kPa)的气体摩尔体积。
假设题中出现物质的体积,需考虑所给物质的状态是否为气体,条件是否为标准状况。
陷阱二 物质聚集状态
气体摩尔体积适用的对象是气体(包括混合气体)。
一些在标准状况下是液体或固体的物
陷阱三物质的微观结构
此类题型要求同学们对物质的微观构成要非常熟悉,弄清楚微粒中相关粒子数(质子数、中子数、电子数)及离子数、电荷数、化学键之间的关系。
常涉及稀有气体He、Ne等单原子分子,Cl2、N2、O2、H2等双原子分子,及O3、P4、18O2、D2O、Na2O2、CH4、CO2等特殊物质。
陷阱四电解质溶液
此类题型要注重对弱电解质的电离和盐类水解等知识点的理解,关键是要弄清电离和水解的实质。
如NH4Cl(aq)中c(Cl-)>c(NH)。
陷阱五氧化还原反应的电子转移数目
较复杂的氧化还原反应中,求算电子转移的数目。
如Na2O2与H2O,Cl2与NaOH溶液反应等。
陷阱六忽视可逆反应不能进行到底。
如2NO2N2O4,Cl2+H2OHClO+HCl,合成氨等。
物质的量在化学方程式计算中的
应用
化学计算的实质是借助化学知识寻找量与未知量之间的数量关系,然后运算求解。
在有关化学方程式计算的解题过程中,假设根据条件找出反应物与生成物之间的物质的量关系,可使复杂的问题简单化、技巧化。
1、化学方程式计算的原理
(1)参与反应的各物质的物理量之间列比例
aA(g)+bB(g)===cC(g)+dD(g)
质量比aMA∶bMB∶cMC∶dMD
物质的量比a∶b∶c∶d
体积比a∶b∶c∶d
由条件和未知量列比例,求解。
(2)据化学方程式推导出来的差量(Δn、Δm、ΔV)等可以和参与反应的各物质的物理量列比例。
例如:
2CO+O22CO2Δn
2mol32g2×
22.4L1mol
n(CO)m(O2)V(CO2)Δn
===
2、计算的一般步骤
(1)正确写出有关化学方程式(或关系式)。
(2)找出相关物质的计量数。
(3)将相关物质(和未知物质)的量写在对应计量数下面。
(4)列出关系式进行计算。
【例2】ag铁粉与含有H2SO4的CuSO4溶液完全反应后,得到ag铜,那么参与反应的CuSO4与H2SO4的物质的量之比为()
A、1∶7B、7∶1C、7∶8D、8∶7
【例3】请仔细阅读硫酸铜晶体(CuSO4·
5H2O)加热过程中依次发生的反应:
CuSO4·
5H2OCuSO4+5H2O
CuSO4CuO+SO3↑
4CuO2Cu2O+O2↑
2SO32SO2+O2
现称取25.0g硫酸铜晶体加热,使之均匀、缓慢地升温至1000℃并恒温1小时左右。
请回答以下问题(不考虑实验操作所带来的误差):
(1)最终固体的质量为__________g;
假设维持最终的反应条件,推测反应结束除去水后的气态产物的物质的量范围在________mol至________mol之间。
(2)如果甲同学做此实验时称得最后所得的固体质量为7.6g,试判断该固体的组分是__________(写化学式),其物质的量之比是________。
(3)如果乙同学做此实验时,所产生的气体为3.36L(已换算到标准状况下),那么SO3的转化率为________。
反思感悟
(1)在进行化学计算时,将条件中的质量、体积等转化为物质的量思考问题往往比较简捷。
(