特殊医学用途配方食品生产许可审查细则征求意见稿文档格式.docx
《特殊医学用途配方食品生产许可审查细则征求意见稿文档格式.docx》由会员分享,可在线阅读,更多相关《特殊医学用途配方食品生产许可审查细则征求意见稿文档格式.docx(56页珍藏版)》请在冰豆网上搜索。
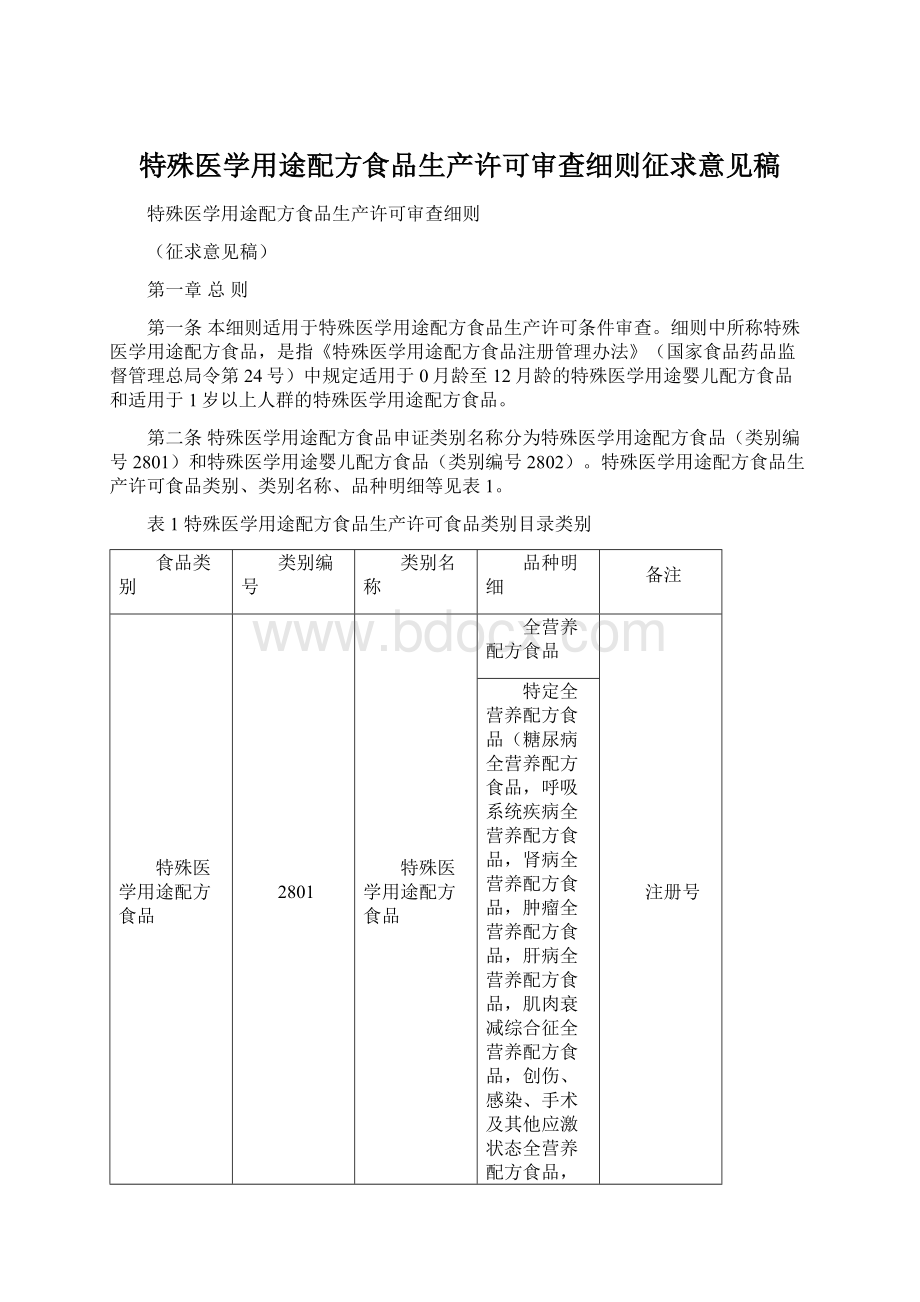
2801
全营养配方食品
注册号
特定全营养配方食品(糖尿病全营养配方食品,呼吸系统疾病全营养配方食品,肾病全营养配方食品,肿瘤全营养配方食品,肝病全营养配方食品,肌肉衰减综合征全营养配方食品,创伤、感染、手术及其他应激状态全营养配方食品,炎性肠病全营养配方食品,食物蛋白过敏全营养配方食品,难治性癫痫全营养配方食品,胃肠道吸收障碍、胰腺炎全营养配方食品,脂肪酸代谢异常全营养配方食品,肥胖、减脂手术全营养配方食品)。
非全营养配方食品(营养素组件、电解质配方、增稠组件、流质配方、氨基酸代谢障碍配方)
2802
特殊医学用途婴儿配方食品
无乳糖配方或低乳糖配方
乳蛋白部分水解配方
乳蛋白深度水解配方或氨基酸配方
早产/低出生体重婴儿配方
母乳营养补充剂
氨基酸代谢障碍配方
第三条不得以分装方式生产特殊医学用途配方食品。
生产企业应当具备完整的生产工艺。
不得以大包粉添加少量营养素通过干混方式生产特殊医学用途配方食品。
第四条《食品审查许可管理办法》与《食品生产审查通则》规定的申请特殊医学用途配方食品生产许可应当提交与所生产食品相关的注册文件,包括产品注册申请时提交的产品配方、生产工艺、产品标准要求等技术材料,产品研发、生产和检验能力证明材料,以及特殊医学用途配方食品注册证书复印件。
第五条申请特殊医学用途配方食品生产许可,在产品注册时已经现场核查的项目和内容,可以不再进行现场核查;
在产品注册时未进行现场核查的项目和内容,应当进行现场核查。
第六条现场核查按照《特殊医学用途配方食品生产许可现场核查评分记录表》(见附件)的项目得分进行判定。
判定方法按照《食品生产许可通则》第四十一条的规定执行。
第七条本细则中引用的文件、标准通过引用成为本细则的内容。
凡是引用文件、标准,其最新版本(包括所有的修改单)适用于本细则。
第二章食品安全管理基本要求
第八条生产企业应当建立与所生产特殊医学用途配方食品相适应的组织机构,以文件形式明确各组织机构及相关岗位职责。
所有人员明确并理解职责,熟悉与本岗位职责相关的要求并保证执行。
第九条生产企业应当配备足够的、符合生产要求的人员、厂房、设施和设备。
第十条生产企业应当建立独立的食品安全管理部门,参与所有与食品安全有关的活动与事务,履行食品安全保证和食品安全控制职责,并保证独自履行职责。
第十一条生产企业应当按照相关法律、法规、规范和特殊医学用途配方食品良好生产规范要求,建立相应的管理规程和管理制度,对从食品原料、食品添加剂和包装材料采购使用到产品生产、包装、检验、放行和销售等所有环节进行规定,并确保:
(一)管理职责明确;
(二)产品设计与研发体现本细则要求;
(三)生产管理和食品安全控制活动符合本细则要求;
(四)采购和使用的食品原料、食品添加剂和包装材料正确无误;
(五)严格按照规程进行生产、检验和复核;
(六)中间产品得到有效控制;
(七)不合格的食品原料、食品添加剂、半成品和成品得到完整的调查,按规定处理,并有相应的记录;
(八)每批产品经食品安全管理负责人批准后方可放行;
(九)在贮存、发运和随后的各种操作过程中有保证产品安全的适当措施;
(十)确认、验证得到实施;
(十一)按照内审操作规程,定期检查评估管理规程和管理制度的有效性和适用性;
(十二)确保所有与产品质量有关的投诉已经过调查,并得到及时、正确的处理;
(十三)确保能够召回任何一批已发运销售的产品;
(十四)导致产品投诉和质量缺陷的原因得到调查,并采取措施,防止类似质量缺陷再次发生;
(十五)其他与食品安全管理有关的要求。
第十二条生产企业应当建立相应的食品安全控制机构,配备适当的设施、设备、仪器和经过培训的人员,明确各岗位职责要求,建立检验规程文件,按照检验规程文件要求对食品原料、食品添加剂、包装材料、中间产品、待包装产品和成品取样、检验,对产品的稳定性进行考察,对环境进行监测,以确保符合本细则要求。
取样、检验应当有记录。
第十三条生产企业应当根据科学知识及经验,运用风险管理的原则,对关键的要素进行评估、控制,以保证产品符合要求。
第三章人员
第十四条生产企业应配备与所生产特殊医学用途配方食品相适应的食品安全管理人员、食品生产管理人员、食品安全技术人员(包括研发人员、检验人员等)、生产操作人员和其他人员。
第十五条食品安全管理人员必须为全职人员,履行食品安全控制和食品安全保证相应的职责。
食品安全管理负责人应当是生产企业法定代表人(负责人)或经授权的负责人,具有食品、药学、医学、营养学或相关专业背景,有从事药品或者食品生产的工作经历和食品安全管理经验。
应独立行使职权,承担特殊医学用途配方食品安全管理和出厂放行责任,其职责不得委托他人,特殊情况需进行授权。
第十六条食品生产管理人员必须为全职人员,具有食品、药学、医学、营养学或相关专业背景,有从事药品或者食品生产的工作经历和生产管理经验。
食品安全管理和食品生产管理必须专人负责,不得一人同时兼任食品安全管理负责人和食品生产管理负责人。
第十七条研发机构中应当有食品相关专业高级职称或者相应专业能力的研发人员;
检验人员应具有食品、化学或相关专业背景和相应的专业能力;
生产操作人员的数量应与产品生产相适应,掌握生产操作规程,熟练操作生产设备。
第十八条生产企业应当制定新员工上岗培训计划、员工定期培训计划、培训方案及考核方法。
食品安全管理人员、食品生产管理人员、生产操作人员和检验人员等应经培训考核合格后上岗。
第十九条培训管理工作由指定部门或专人负责,培训计划、培训方案应当经法定代表人(负责人)或食品安全管理负责人审核批准,培训记录应当予以保存,培训效果应当定期考核评估。
第二十条生产企业应当建立并执行从业人员健康管理制度。
直接接触原料及产品的生产加工人员必须例行检查,持年度有效的健康证明。
患有法律法规规定的有碍食品安全的疾病时,应立即调离工作岗位。
第二十一条生产企业应当建立并执行人员卫生操作规程,以最大限度地降低人员对产品造成污染的风险。
第四章厂房和车间
第二十二条生产企业选址及厂区环境、厂房和车间的设计和布局等应符合相关食品安全国家标准和有关规定,并与申请人提交的注册申请材料一致。
第二十三条生产企业应当有与产品特性、生产工艺和生产能力相适应的厂房和生产车间,根据产品特性、生产工艺和清洁度级别要求等进行合理布局,能有效防止污染和交叉污染。
生产企业应当在进行充分食品安全风险评估,查清潜在风险,制定控制措施,进行有效验证,确保不产生交叉污染等食品安全问题的情况下,制定不同特殊医学用途配方食品共线生产方案。
存在引起食物蛋白过敏等食品安全风险的特殊医学用途配方食品,不得与非特殊医学用途配方食品共线生产;
其他特殊医学用途配方食品在查清潜在风险,制定控制措施,进行有效验证,确保不产生交叉污染等食品安全问题的情况下,可与婴幼儿配方乳粉共线生产。
第二十四条生产车间应当区分清洁作业区、准清洁作业区和一般作业区。
各生产工序应在相应区域内进行,生产环境应当符合要求。
第二十五条清洁作业区、准清洁作业区的墙壁、地面、顶棚等应当符合相关食品安全国家标准和有关规定。
第二十六条清洁作业区应当安装空气净化系统,进入清洁作业区的空气必须经过净化。
空气净化系统运行情况应按规定进行检查维护,并有运行记录。
第二十七条产尘操作间(如干燥物料或产品的取样、称量、混合、包装等)应当保持相对负压或采取专门的措施,防止粉尘扩散、避免交叉污染并便于清洁。
第二十八条生产企业应当定期对清洁作业区进行空气质量监测。
清洁作业区新建成或改造时应当由有资质的第三方检验机构对空气质量进行检测,出具合格的空气洁净度检测报告。
厂房确认阶段、工艺设备安装完毕或因其他原因重新建立清洁作业区时,在静态和动态两种状态下均应检测清洁作业区空气洁净度。
日常运行中,清洁作业区、准清洁作业区静态的空气洁净度应符合《食品安全国家标准特殊医学用途配方食品良好生产规范》(GB29923)要求,动态的空气洁净度检测和监测按照表2进行。
表2特殊医学用途配方食品清洁作业区空气洁净度动态标准控制表
项目
内容
检测方法
控制要求
监控频次
微生物最大允许数
浮游菌
GB/T16293
≤200cfu/m3
1次/周
沉降菌
GB/T16294
≤100cfu/4h(φ90mm)
表面微生物
参照GB15982采样,按GB4789.2计数
≤50cfu/皿(φ55mm)
压差
清洁作业区与非清洁作业区之间
通过压差计测量
≥10Pa
连续监测
换气次数
通过测定风速验证换气次数
通过风速仪测定
≥12次/h
更换高效过滤器时或1次/年
温度
-
通过温度表测定
16-25°
C
2次/班
相对湿度
通过湿度表测定
≤65%
说明:
换气次数通过风速进行转换后测定。
计算公式为:
N=3600SV/A,其中,N=换气次数,次/h;
S=风口通风面积,m2;
V=测得风口平均风速,m/s;
A=车间容积,m3。
第二十九条生产企业的质量控制部门至少每周按照《食品安全国家标准特殊医学用途配方食品良好生产规范》(GB29923—2013)中附录B的要求实施环境监控,确保生产粉状产品的清洁作业区沙门氏菌、阪崎肠杆菌和其他肠杆菌得到有效控制;
按照《食品安全国家标准特殊医学用途配方食品良好生产规范》(GB29923—2013)中附录C的要求进行商业无菌操作,确保液态产品免受微生物污染。
第三十条清洁作业区、准清洁作业区的对外出入口应装设能自动关闭的门。
清洁作业区、准清洁作业区应设置缓冲间,对进入该区域的食品原料、食品添加剂、包装材料、人员和设备等进行净化。
清洁作业区入口前应当设置洗手消毒设施,入口应设置二次更衣室。
出入清洁作业区的人员、物料、设备等,应有合理的限制和控制措施,以避免或减少污染。
第三十一条空气洁净度级别不同的区域应当有压差控制。
干燥设备的进风应当有空气过滤器,排风应当有防止空气倒流装置,过滤器应定期检查和维护。
第三十二条湿区域和干燥区域应分隔。
应设置适当的设施或采用适当措施保持厂房和车间干燥。
在干燥区域应防止不当的湿式清洁流程致使微生物滋生与传播。
在干燥区域内进行的无后续灭菌的操作,则该区域应为清洁作业区。
第三十三条清洁作业区需保持干燥,应当尽量减少供水设施和系统,如无法避免,则应有防护措施,以防止污染。
第三十四条供水设施、排水设施、通风设施和照明设施应符合相关食品安全国家标准和有关规定。
第三十五条生产区域内的卫生间应有洗手、消毒设施,易保持清洁且不得与生产、包装或贮存等区域直接连通。
第三十六条更衣室应设在车间入口处,并与洗手消毒室相邻。
洗手消毒室内应设置足够数量的洗手设施、消毒设施和干手设施。
第三十七条仓储区