高考专题训练工业流程三年真题文档格式.doc
《高考专题训练工业流程三年真题文档格式.doc》由会员分享,可在线阅读,更多相关《高考专题训练工业流程三年真题文档格式.doc(19页珍藏版)》请在冰豆网上搜索。
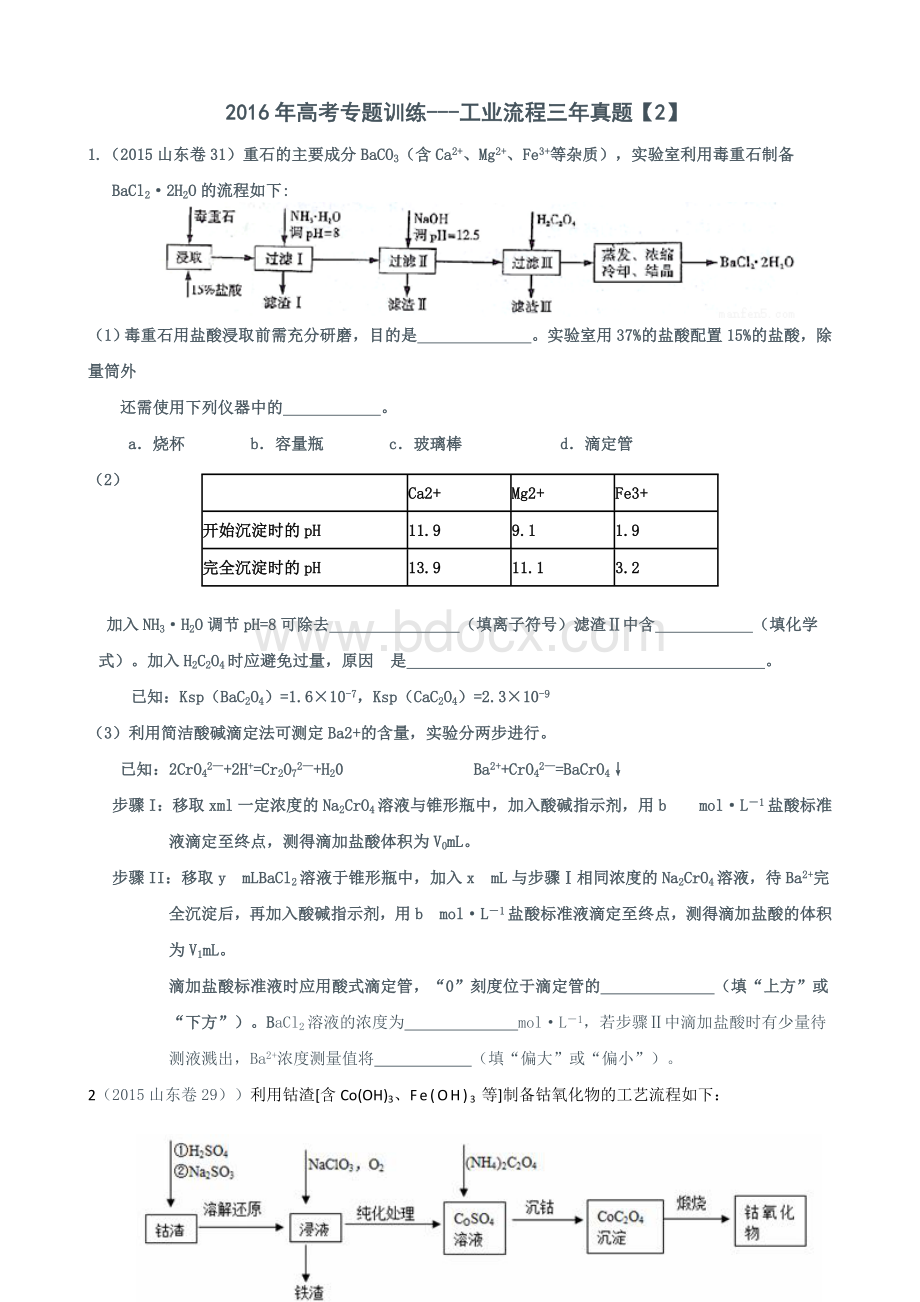
11.9
9.1
1.9
完全沉淀时的pH
13.9
11.1
3.2
(2)
加入NH3·
H2O调节pH=8可除去
(填离子符号)滤渣Ⅱ中含
(填化学式)。
加入H2C2O4时应避免过量,原因是
已知:
Ksp(BaC2O4)=1.6×
10-7,Ksp(CaC2O4)=2.3×
10-9
(3)利用简洁酸碱滴定法可测定Ba2+的含量,实验分两步进行。
2CrO42—+2H+=Cr2O72—+H20
Ba2++CrO42—=BaCrO4↓
步骤I:
移取xml一定浓度的Na2CrO4溶液与锥形瓶中,加入酸碱指示剂,用b
mol·
L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL。
步骤II:
移取y
mLBaCl2溶液于锥形瓶中,加入x
mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b
L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。
滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的
(填“上方”或“下方”)。
BaCl2溶液的浓度为
L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将
(填“偏大”或“偏小”)。
2(2015山东卷29))利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:
Co(OH)3溶解还原反应的离子方程式为____________________________________,铁渣中铁元素的化合价为___________,在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为__________。
3.(2015年天津)废旧印刷电路板是一种电子废弃物,其中铜的含量达到矿石中的几十倍。
湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品。
某化学小组模拟该方法回收铜和制取胆矾,流程简图如下:
回答下列问题:
(1)反应Ⅰ是将Cu转化为Cu(NH3)42+,反应中H2O2的作用是。
写出操作①的名称:
。
(2)反应Ⅱ是铜氨溶液中的Cu(NH3)42+与有机物RH反应,写出该反应的离子方程式:
。
操作②用到的主要仪器名称为,其目的是(填序号)。
a.富集铜元素b.使铜元素与水溶液中的物质分离c.增加Cu2+在水中的溶解度
(3)反应Ⅲ是有机溶液中的CuR2与稀硫酸反应生成CuSO4和。
若操作③使用右图装置,图中存在的错误是。
(4)操作④以石墨作电极电解CuSO4溶液。
阴极析出铜,阳极产物是。
操作⑤由硫酸铜溶液制胆矾的主要步骤是。
(5)流程中有三次实现了试剂的循环使用,已用虚线标出两处,第三处的试剂是。
循环使用的NH4Cl在反应Ⅰ中的主要作用是。
4.(2015年高考四川卷)为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以Fe2O3存在)转变成重要的工业原料FeSO4(反应条件略)
活化硫铁矿还原Fe2+的主要反应为:
FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应,请回答下列问题:
(1)第1步H2SO4与Fe2O3反应的离子方程式是。
(2)检验第II步中Fe2+是否完全还原,应选择(填字母编号)。
A.KMnO4溶液B.K2[Fe(CN)4]溶液C.KSCN溶液
(3)第III步加FeCO3调溶液pH到5.8左右,然后再第VI步通入空气使溶液pH降到5.2,此时Fe2+不沉
淀,滤液中铝、硅杂质除尽。
通入空气引起溶液pH降低的原因是。
(4)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
(5)已知25℃,101kPa时:
4Fe(s)+3O2(g)=2Fe2O3(s)=-1648kJ/mol
C(s)+O2(g)=CO2(g)=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s)=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是。
(6)加入烧渣中的铁全部视为Fe2O3,其含量为50%。
将akg质量分数为b%的硫酸加入到ckg烧渣中浸取,铁的浸取率为96%,其他杂质浸出消耗掉饿硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。
按上述流程,第III步应加入FeCO3kg。
5(2015年高考广东卷)七铝十二钙(12CaO·
7Al2O3)是新型的超导材料和发光材料,用白云石(主要含CaCO3和MgCO3)和废铝片制备七铝十二钙的工艺如下:
(1)煅粉主要含MgO和,用适量的NH4NO3溶液浸取煅粉后,镁化合物几乎不溶,若溶液I中c(Mg2+)小于5×
10-6mol·
L-1,则溶液PH大于(Mg(OH)2的Ksp=5×
10-12);
该工艺中不能用(NH4)2SO4代替NH4NO3,原因是,
(2)滤液I中的阴离子有(忽略杂质成分的影响);
若滤液I中仅通入CO2会生成,从而导致CaCO3产率降低。
(3)用NaOH溶液可除去废Al片表面的氧化膜,反应的离子方程式为。
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式为。
(5)一种可超快充电的新型铝电池,充放电时AlCl4-和Al2Cl7-两种离子在Al电极上相互转化,其它离子不参与电极反应,放电时负极Al的电极反应式为。
6.(2015年高考福建卷)无水氯化铝在生产、生活中应用广泛。
(1)氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为。
(2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:
物质
SiCl4
AlCl3
FeCl3
FeCl2
沸点/℃
57.6
180(升华)
300(升华)
1023
①步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是(只要求写出一种)。
②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是。
③已知:
Al2O3(s)+3C(s)=2Al(s)+3CO(g)ΔH1=+1344.1kJ·
mol-1
2AlCl3(g)=2Al(s)+3Cl2(g)ΔH2=+1169.2kJ·
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为。
④步骤Ⅲ的经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为
⑤结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是。
7.(2015年高考真题安徽卷)硼氢化钠(NaBH4)在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠NaBO2为主要原料制备NaBH4,其流程如下:
NaBO2(s)
SiO2(s)Na(s)
H2(g)
NaBH4(s)
Na2SiO3(s)
溶液
异丙酸(l)
循环使用
①
③
NaBH4常温下能与水反应,可溶于异丙酸(沸点:
13℃)。
(1)在第①不反应加料之前,需要将反应器加热至100℃以上并通入氩气,该操作的目的是_____,原料中的金属钠通常保存在____中,实验室取用少量金属钠需要用到的实验用品有_____,_____,玻璃片和小刀等。
(2)请配平第①步反应的化学方程式:
□NaBO2+□SiO2+□Na+□H2-------□NaBH4+□Na2SiO3
(3)第②步分离采用的方法是______;
第③不分离(NaBH4)并回收溶剂,采用的方法是______。
(4)NaBH4(s)与水(l)反应生成NaBO2(s)和氢气(g),在25℃,101KPa下,已知每消耗3.8
克NaBH4(s)放热21.6KJ,该反应的热化学方程式是_______。
②
8.(2015年江苏高考)(12分)以磷石膏(只要成分CaSO4,杂质SiO2、Al2O3等)为原料可制备轻质CaCO3。
(1)匀速向浆料中通入CO2,浆料清液的pH和c(SO42-)随时间变化见由图。
清液pH>
11时CaSO4转化的离子方程式_____________(填序号)
A.搅拌浆料B.加热浆料至100℃C.增大氨水浓度D.减小CO2通入速率
(2)当清液pH接近6.5时,过滤并洗涤固体。
滤液中物质的量浓度最大的两种阴离子为______和________(填化学式);
检验洗涤是否完全的方法是_________。
(3)在敞口容器智能光,用NH4Cl溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中c(Ca2+)增大的原因___________。
9.(2015年海南)单质Z是一种常见的半导体材料,可由X通过如下图所示的路线制备,其中X为Z的氧化物,Y为氢化物,分子结构与甲烷相似,回答下列问题:
(1)能与X发生化学反应的酸是;
由X制备Mg2Z的化学方程式为。
(2)由Mg2Z生成Y的化学反应方程式为,Y分子的电子式为。
(3)Z.X中共价键的类型分别是。
10.(2015年高考新课标Ⅰ卷)硼及其化合物在工业上有许多用途。
以铁硼矿(主要成分为Mg2B2O5·
H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:
(1)写出Mg2B2O5·
H2O与硫酸反应的化学方程式_____________。
为提高浸出速率,除适当增加硫酸浓度浓度外,还可采取的措施有_________(写出两条)。
(2)利用_______的磁性,可将其从“浸渣”中分离。
“浸渣”中还剩余的物质是______(化学式)。
(3)“净化除杂”需先加H2O2溶液,作用是_______。
然后在调节溶液的pH约为5,目的是_________。
(4)“粗硼酸”中的主要杂质是________(填名称)。
(5)以硼酸为原料可制得硼氢