高中有机化学方程式总结Word格式文档下载.doc
《高中有机化学方程式总结Word格式文档下载.doc》由会员分享,可在线阅读,更多相关《高中有机化学方程式总结Word格式文档下载.doc(10页珍藏版)》请在冰豆网上搜索。
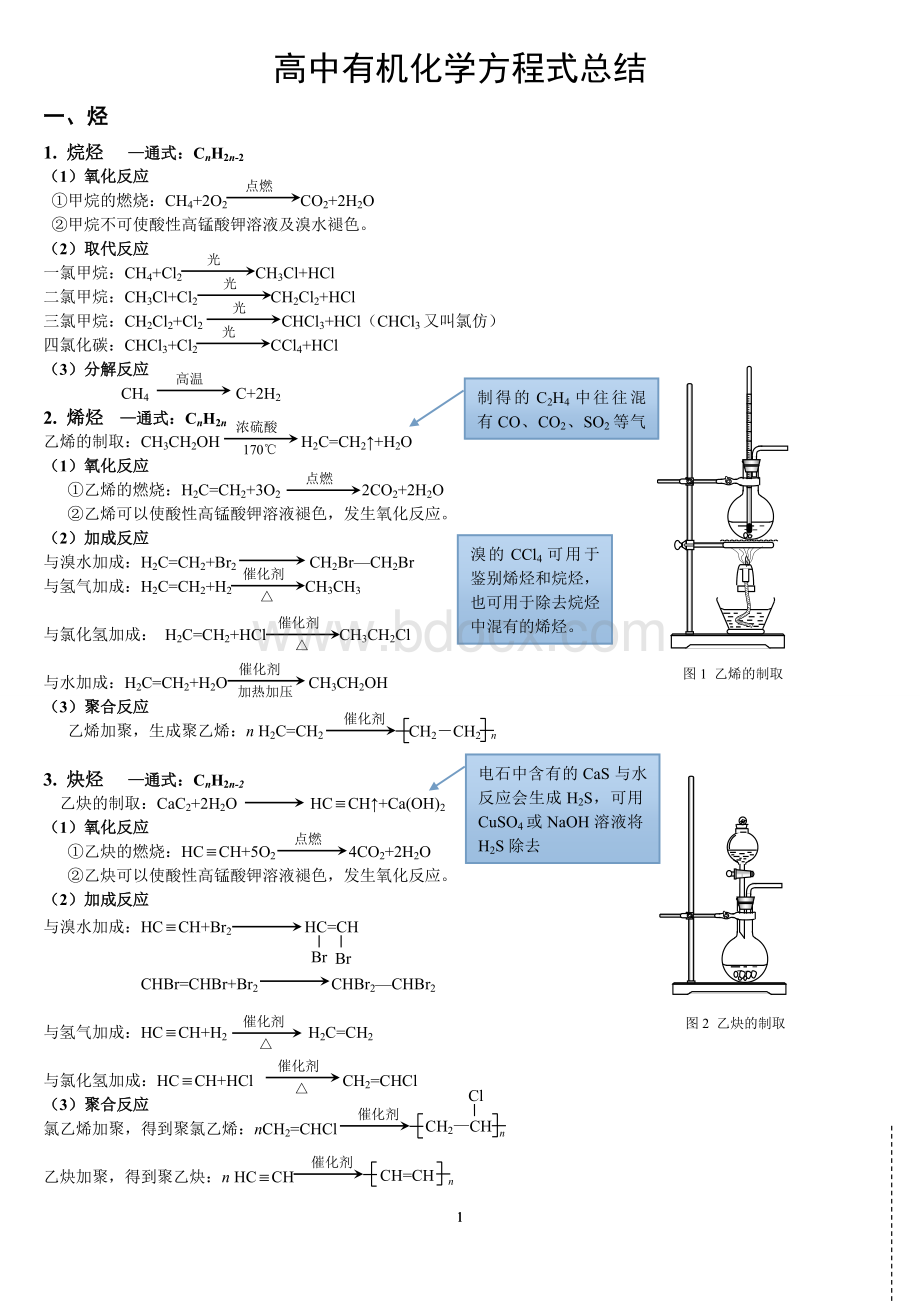
乙烯的制取:
CH3CH2OHH2C=CH2↑+H2O
①乙烯的燃烧:
H2C=CH2+3O22CO2+2H2O
②乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
溴的CCl4可用于鉴别烯烃和烷烃,也可用于除去烷烃中混有的烯烃。
(2)加成反应
催化剂
△
与溴水加成:
H2C=CH2+Br2CH2Br—CH2Br
与氢气加成:
H2C=CH2+H2CH3CH3
与氯化氢加成:
H2C=CH2+HClCH3CH2Cl
加热加压
与水加成:
H2C=CH2+H2OCH3CH2OH
CH2-CH2
(3)聚合反应
乙烯加聚,生成聚乙烯:
nH2C=CH2n
电石中含有的CaS与水反应会生成H2S,可用CuSO4或NaOH溶液将H2S除去
图2乙炔的制取
3.炔烃—通式:
乙炔的制取:
CaC2+2H2OHCCH↑+Ca(OH)2
(1)氧化反应
①乙炔的燃烧:
HCCH+5O24CO2+2H2O
②乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
Br
HCCH+Br2HC=CH
Br
CHBr=CHBr+Br2CHBr2—CHBr2
HCCH+H2H2C=CH2
CH2—CH
Cl
HCCH+HClCH2=CHCl
(3)聚合反应
氯乙烯加聚,得到聚氯乙烯:
nCH2=CHCln
CH=CH
乙炔加聚,得到聚乙炔:
nHCCHn
4.苯C6H6
①苯的燃烧:
2C6H6+15O212CO2+6H2O
②苯不能使溴水和酸性高锰酸钾溶液褪色。
FeBr3
—Br
①苯与溴反应
+Br2+HBr
(溴苯)浓H2SO4作催化剂和吸水剂
②硝化反应
—NO2
浓H2SO4
+HO—NO2+H2O
(硝基苯)
+3H2
Ni
(3)加成反应
(环己烷)
5.甲苯苯的同系物通式:
CnH2n-6
①甲苯的燃烧:
C7H8+9O27CO2+4H2O
②甲苯不能使溴水褪色,但可以使酸性高锰酸钾溶液褪色。
(2)取代反应CH3
|
+3HNO3
O2N—
CH3
NO2
+3H2O
三硝基甲苯(TNT),是一种淡黄色晶体,不溶于水。
它是一种烈性炸药
+Cl2
CH2Cl
+HCl
甲苯和氯气在光照和铁的催化条件下发生的取代反应不一样
Fe
—Cl
+3H2
二、烃的衍生物
烃的衍生物的重要类别和主要化学性质:
类别
通式
代表性物质
分子结构特点
主要化学性质
卤代烃
R—X
溴乙烷
C2H5Br
C—X键有极性,
易断裂
1.取代反应:
与NaOH溶液发生取代反应,生成醇;
2.消去反应:
与强碱的醇溶液共热,生成烯烃。
醇
R—OH
乙醇
C2H5OH
有C—O键和O—H
键,有极性;
—OH
与链烃基直接相连
1.与钠反应:
生成醇钠并放出氢气;
2.氧化反应:
燃烧;
氧化剂:
生成乙醛;
3.取代反应
4.消去反应:
140℃:
乙醚;
170℃:
乙烯;
5.酯化反应
酚
苯酚
—OH直接与苯环相连
1.弱酸性:
与NaOH溶液中和;
2.取代反应:
与浓溴水反应,生成三溴苯酚白色沉淀;
3.显色反应:
与铁盐(FeCl3)反应,生成紫色物质
4.氧化反应
醛
O
||
R—C—H
乙醛
CH3—C—H
C=O双键有极性,
具有不饱和性
1.加成反应:
用Ni作催化剂,与氢加成,生成乙醇;
能被弱氧化剂氧化成羧酸(如银镜反应、
还原氢氧化铜)
羧酸
R—C—OH
乙酸
CH3—C—OH
受C=O影响,O—H
能够电离,产生H+
1.具有酸的通性;
2.酯化反应:
与醇反应生成酯。
酯
RC—OR’
乙酸乙酯
CH3COOC2H5
分子中RCO—和OR
之间容易断裂
水解反应:
生成相应的羧酸和醇
6.卤代烃
H2O
(1)取代反应
溴乙烷的水解:
C2H5—Br+NaOHC2H5—OH+NaBr
(2)消去反应
溴乙烷与NaOH溶液反应:
CH3CH2Br+NaOHCH2=CH2↑+NaBr+H2O
7.醇
(1)与钠反应
乙醇与钠反应:
2CH3CH2OH+2Na2CH3CH2ONa+H2↑(乙醇钠)
(2)氧化反应
Cu或Ag
①乙醇的燃烧;
②2CH3CH2OH+O22CH3CHO+2H2O(乙醛)
(3)取代反应
乙醇与浓氢溴酸反应:
CH3CH2OH+HBrCH3CH2Br+H2O
(4)消去反应浓硫酸
140℃
注意:
该反应加热到140℃时,乙醇进行另一种脱水方式,生成乙醚。
2C2H5OHC2H5—O—C2H5+H2O(乙醚)
(5)酯化反应
CH3CH2—OH+C2H5—OHCH3—C—OC2H5+H2O(乙酸乙酯)
8.苯酚
苯酚是无色晶体,露置在空气中会因氧化显粉红色。
苯酚具有特殊的气味,熔点43℃,
水中溶解度不大,易溶于有机溶剂。
苯酚有毒,是一种重要的化工原料。
+NaOH+H2O
—ONa
(1)苯酚的酸性
(苯酚钠)
苯酚钠与CO2反应:
+CO2+H2O+NaHCO3
Br—
OH
+3Br2↓+3HBr
(三溴苯酚)
(3)显色反应
苯酚能和FeCl3溶液反应,使溶液呈紫色
(4)缩聚反应
酚醛树脂的制取
9.醛
乙醛是无色无味,具有刺激性气味的液体,沸点20.8℃,密度比水小,易挥发。
(1)加成反应
乙醛与氢气反应:
CH3—C—H+H2CH3CH2OH
乙醛与氧气反应:
2CH3—C—H+O22CH3COOH(乙酸)
乙醛的银镜反应:
CH3CHO+2Ag(NH3)2OHCH3COONH4+2Ag↓+3NH3+H2O
硝酸银与氨水配制而成的银氨溶液中含有Ag(NH3)2OH(氢氧化二氨合银),
这是一种弱氧化剂,可以氧化乙醛,生成Ag。
有关制备的方程式:
Ag++NH3·
H2O===AgOH↓+
AgOH+2NH3·
H2O===[Ag(NH3)2]++OH-+2H2O
乙醛还原氢氧化铜:
CH3CHO+2Cu(OH)2CH3COOH+Cu2O↓+2H2O
10.羧酸
(1)乙酸的酸性
乙酸的电离:
CH3COOHCH3COO-+H+
(2)酯化反应
酸和醇起作用,生成酯和水的反应叫做酯化反应。
11.酯
乙酸乙酯是一种带有香味的无色油状液体。
无机酸
(1)水解反应
CH3COOC2H5+H2OCH3COOH+C2H5OH
(2)中和反应
CH3COO-
CH3COOC2H5+NaOHCH3COONa+C2H5OH
-ONa
酚酯类碱水解如:
的水解
+2NaOH→CH3COONa++H2O
其他
(1)葡萄糖的银镜反应
CH2OH(CHOH)4CHO+2Ag(NH3)2OHCH2OH(CHOH)4COONH4+2Ag+3NH3+H2O
(2)156蔗糖的水解
C12H22O11+H2OC6H12O6+C6H12O6
(蔗糖)(葡萄糖)(果糖)
(3)麦芽糖的水解
C12H22O11+H2O2C6H12O6
(麦芽糖)(葡萄糖)
(4)