氮氧化物溶于水的计算Word格式文档下载.doc
《氮氧化物溶于水的计算Word格式文档下载.doc》由会员分享,可在线阅读,更多相关《氮氧化物溶于水的计算Word格式文档下载.doc(6页珍藏版)》请在冰豆网上搜索。
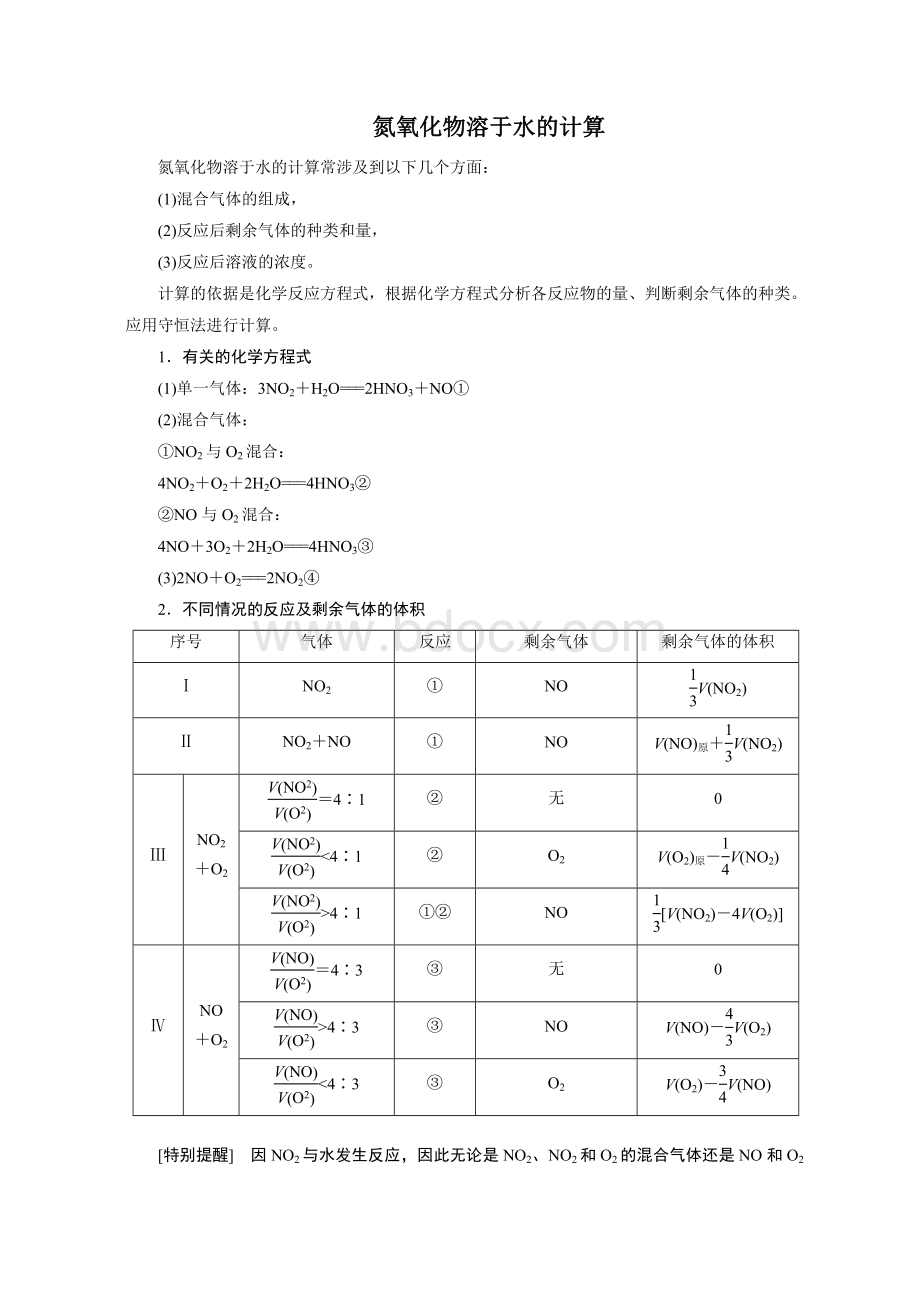
气体
反应
剩余气体
剩余气体的体积
Ⅰ
NO2
①
NO
V(NO2)
Ⅱ
NO2+NO
V(NO)原+V(NO2)
Ⅲ
NO2+O2
=4∶1
②
无
<
4∶1
O2
V(O2)原-V(NO2)
>
①②
[V(NO2)-4V(O2)]
Ⅳ
NO+O2
=4∶3
③
4∶3
V(NO)-V(O2)
V(O2)-V(NO)
[特别提醒] 因NO2与水发生反应,因此无论是NO2、NO2和O2的混合气体还是NO和O2的混合气体通入水中,最终剩余气体都不能是NO2。
[例] 用排水法收集12mLNO于试管中,然后向倒立于水槽中的该试管内间歇地通入O2共12mL,下面的说法中,正确的是( )
A.剩余NO
B.剩余NO2
C.试管中气体为红棕色
D.试管内气体先变为红棕色,后红棕色消失,反复几次,最后剩余无色气体
[解析] 向NO中间歇通入O2发生的反应为
2NO+O2===2NO2 ①
3NO2+H2O===2HNO3+NO ②
由①×
3+②×
2得:
4NO+3O2+2H2O===4HNO3
等体积的NO和O2反应最终剩余O2。
[答案] D
NONO2NO
(无色)(红棕色)(无色)
1.在NO2被水吸收的反应中,发生还原反应的物质和发生氧化反应的物质的质量比为( )
A.3∶1 B.1∶3
C.1∶2 D.2∶3
解析:
3O2+H2O===2HO3+O,3molNO2中,有2mol氮的价态升高,1mol氮的价态降低,所以发生还原反应的NO2与发生氧化反应的NO2的质量比为1∶2。
答案:
C
2.标准状况下,将NO2和O2按体积比4∶3混合后充入干燥烧瓶中,然后将烧瓶倒立于水中使其充分反应,则烧瓶内溶液中溶质的物质的量浓度为( )
A.mol·
L-1 B.mol·
L-1
C.mol·
L-1 D.mol·
此类题目可用赋值法来解。
设烧瓶体积为1L,因V(NO2)∶V(O2)=4∶3,故在1L混合气体中V(NO2)=L,V(O2)=L。
设生成HNO3的物质的量为x,根据反应4NO2+O2+2H2O===4HNO3,则有(4×
22.4L)∶L=4mol∶x,解得x=mol。
烧瓶中残留O2的体积:
L-L=L,故溶液充满烧瓶体积的。
所以c(HNO3)=(×
)mol÷
L=mol·
L-1。
3.[双选题]在一大试管中装入10mLNO倒立于水槽中,然后向其中缓慢通入6mLO2(气体体积均在相同条件下测定),下面有关实验最终状态的描述,正确的是( )
A.试管内气体呈红棕色
B.试管内气体呈无色,是2mLNO
C.试管内气体呈无色,是2mLO2
D.试管内液面上升
根据4NO+3O2+2H2O===4HNO3可知,V(NO)∶V(O2)>4∶3时,NO有剩余。
由题意,V(NO)∶V(O2)=5∶3可知,NO剩余2mL,则试管内液面上升。
BD
4.盛有NO和NO2混合气体的量筒倒立在盛有水的水槽中,过一段时间后,量筒内的气体体积减小为原来的一半。
则原混合气体中NO和NO2的体积比是( )
A.3∶1 B.1∶3
C.2∶1 D.1∶2
设VNO===xL VNO2===yL
3NO2+H2O===2HNO3+NO ΔV
3L 1L 2L
yL L yL
则:
由反应后气体体积减小为原来的一半可得:
y=(x+y),解得=。
B
5.用大试管收集一试管NO2气体,倒扣在盛水的水槽里,试管内产生的现象为____________________;
再往试管里通入适量氧气,试管内又产生的现象为________________________。
产生上述现象的原因是______________________________
________________________________________________________________________
________________________________________________________________________。
NO2与水发生反应3NO2+H2O===2HNO3+NO,所以水会上升到试管容积的处;
反应生成的NO又与O2反应生成红棕色的NO2气体,而NO2又与水反应,水面又上升。
试管内红棕色气体逐渐消失,水面上升至试管容积的处 试管内又出现红棕色,接着红棕色消失,液面又上升 由于NO2易溶于水,发生反应3NO2+H2O===2HNO3+NO,故颜色消失,液面上升至容积的处。
当再充入O2时,发生反应2NO+O2===2NO2,故又出现了红棕色,NO2继续溶于水并与水反应,气体颜色又消失,液面又上升
(1)空气中主要含有N2和O2,其体积比大约是4∶1。
(2)可通过自然固氮和人工固氮将自然界游离态氮转化为化合态。
(3)氮元素有多种氧化物,并且都有毒。
其中NO和NO2是两种重要的氧化物。
NO易与O2反应,化学方程式为2NO+O2=2NO2,NO2与H2O反应,化学方程式为3NO2+H2O===2HNO3+NO。
(4)“雷雨发庄稼”原理:
N2NONO2HNO3硝酸盐
一、选择题(本题包括5小题,每题4分,共20分)
1.下列关于氮气的说法中,错误的是( )
A.通常情况下,氮气性质比较稳定
B.可在氧气中燃烧,生成一氧化氮
C.通常情况下,氮气在水中的溶解度很小
D.跟氢气在一定条件下发生反应时,氮气是氧化剂
N2不能在O2中燃烧,与O2在闪电时反应生成NO。
2.我国城市中的大气污染物主要是( )
A.CO2、Cl2、N2、酸雨 B.SO2、NO2、CO、烟尘
C.NH3、CO2、CO、雾 D.HCl、SO2、N2、粉尘
3.把少量NO2气体通入过量小苏打溶液中,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,最后收集到的气体是( )
A.氧气 B.二氧化氮
C.二氧化氮和氧气 D.二氧化氮和一氧化氮
少量NO2气体通入过量小苏打溶液中,逸出的气体为NO、CO2,二者物质的量比为1∶2,同时还有少量水蒸气逸出,再使逸出的气体通过装有足量的过氧化钠颗粒的干燥管,CO2与过氧化钠反应生成的O2与NO反应生成NO2,O2有剩余,同时逸出的少量水蒸气与过氧化钠反应生成O2,所以最后收集到的气体是NO2和O2。
4.[双选题]在氮的氧化物中,氮元素和氧元素的质量比为7∶16,则此氧化物的化学式可能为( )
A.NO2 B.NO
C.N2O3 D.N2O4
氧化物中两原子个数之比为:
N(N)∶N(O)=∶=1∶2。
AD
5.无色的混合气体甲,可能含NO、CO2、NO2、N2中的几种,将一定量的甲气体经过下图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为( )
A.NO2、N2 B.NO、CO2
C.NO2、CO2 D.NO、CO2、N2
混合气体无色,气体中不含NO2,气体通过Na2O2后显红棕色,说明原混合气体中含有NO,且有与Na2O2反应生成O2的气体CO2,通入水中,溶液呈酸性,且几乎无气体剩余,说明原气体中不含N2。
二、非选择题(本题包括3个小题,共30分)
6.(8分)氮氧化物进入大气后,不仅会形成硝酸型酸雨,还可能形成光化学烟雾,因此必须对含有氮氧化物的废气进行处理。
(1)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
2NO2+2NO+4NaOH===4NaNO2+2H2O ①,
2NO2+2NaOH===NaNO2+NaNO3+H2O ②,在反应①中,氧化剂是________,还原剂是________。
在反应②中,氧化剂和还原剂的物质的量之比为________。
(2)汽车尾气中含有CO和NO,消除这两种物质对大气的污染的方法是安装催化转化器,使它们发生反应生成对大气无污染的气体,该反应的化学方程式为______________________
(1)在反应①中NO2中的氮元素化合价降低做氧化剂,NO中氮元素化合价升高做还原剂;
在反应②中氧化剂和还原剂都是NO2,它们的物质的量之比为1∶1。
(2)根据质量守恒定律结合题目信息可知,一氧化氮与一氧化碳反应后生成的对大气无污染的物质应为氮气和二氧化碳。
(1)NO2 NO 1∶1
(2)2NO+2CON2+2CO2
7.(9分)二氧化氮是造成光化学烟雾的罪魁祸首。
目前有一种治理方法是,在400℃左右、有催化剂存在的情况下,用氨把二氧化氮还原为氮气和水。
请写出该反应的化学方程式:
________________________________,该反应中,氧化剂是________,氧化产物是________,生成1.4mol还原产物时,转移电子的物质的量为________。
根据氧化还原反应的规律分析,用NH3将NO2还原成无毒气体,该气体只能是N2。
NO2中+4价的N被NH3中-3价的N还原为0价,剩下的氢、氧元素结合成水,因而氧化剂是NO2,氧化产物、还原产物均为N2;
生成7molN2时,其中3mol为还原产物,转移电子24mol,则生成1.4mol还原产物时,转移电子11.2mol。
6NO2+8NH37N2+12H2O NO2 N2 11.2mol
8.(13分)NO分子因污染空气而臭名昭著。
近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究热点,NO亦被称为“明星分子”。
请回答下列问题。
(1)NO对环境的危害在于________(填以下项目的编号)。
A.破坏臭氧层
B.高温下能使一些金属被氧化
C.造成酸雨
D.与人体血红蛋白结合
(2)在含Cu+离子的酶的活化中心中,亚硝酸根离子(NO)可转化为NO,写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式:
___________________________________
(3)在常温下,把NO气体压缩到100个大气压,在一个体积固定的容器里加热到50℃,发现气体的压力迅速下降,压力降至大约为原压力的就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式:
___________________