氧族元素知识点总结文档格式.docx
《氧族元素知识点总结文档格式.docx》由会员分享,可在线阅读,更多相关《氧族元素知识点总结文档格式.docx(22页珍藏版)》请在冰豆网上搜索。
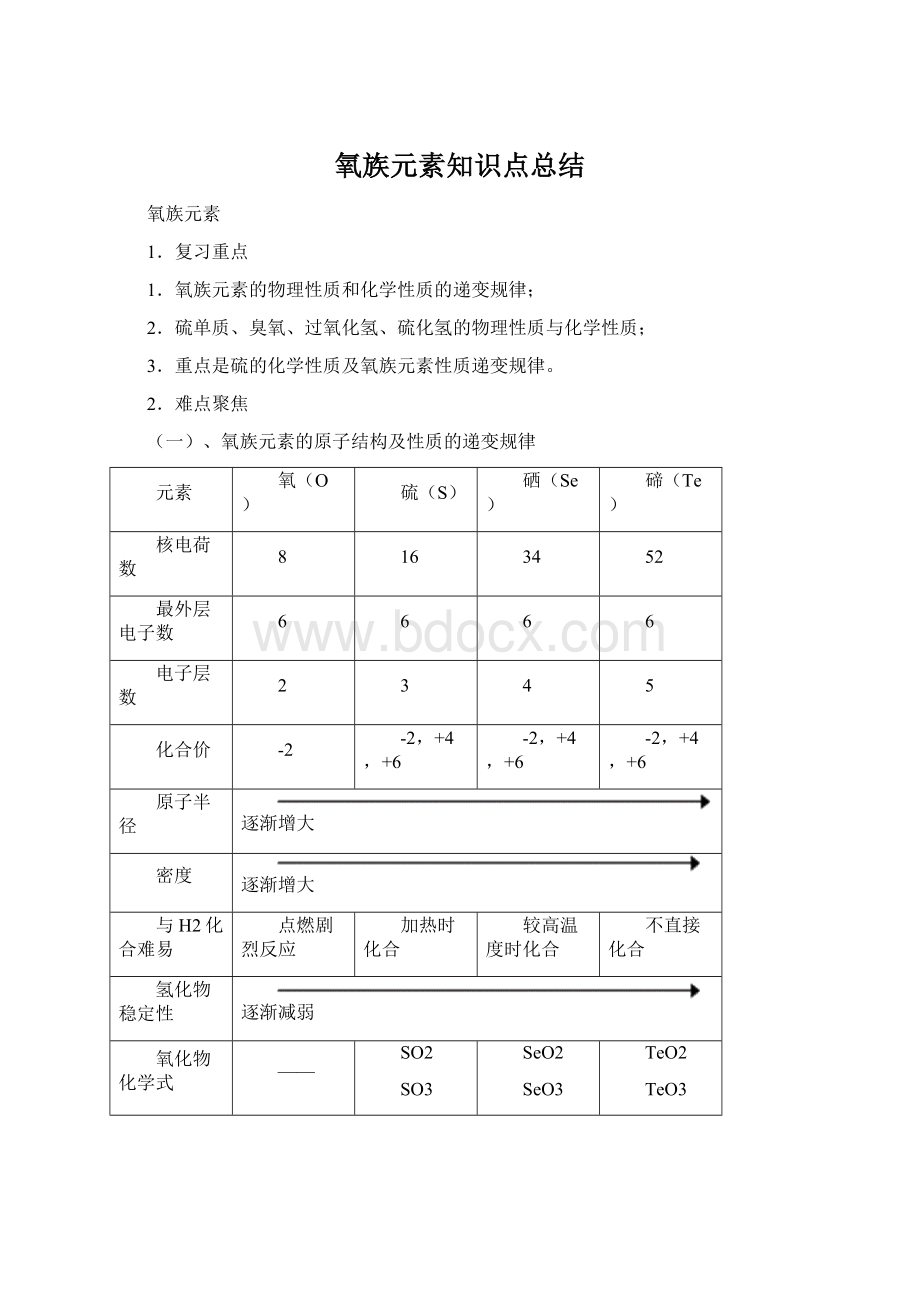
点燃剧烈反应
加热时化合
较高温度时化合
不直接化合
氢化物稳定性
逐渐减弱
氧化物化学式
——
SO2
SO3
SeO2
SeO3
TeO2
TeO3
氧化物对应水化物化学式
H2SO3
H2SO4
H2SeO3
H2SeO4
H2TeO3
H2TeO4
最高价氧化物水化物酸性
元素非金属性
2.1臭氧和过氧化氢
臭氧和氧气是氧的同素异形体,大气中臭氧层是人类的保护伞
过氧化氢不稳定分解,可作氧化剂、漂白剂。
归纳知识体系。
2.1.1.与氧气有关的反应
(1)有氧气参加的反应方程式
①与绝大多数金属单质作用
4Na+O2=2Na2O
②与绝大多数非金属单质作用
③与非还原性化合物作用
2NO+O2=2NO2
4FeS2+11O22Fe2O2+8SO2
④与有机物作用
⑤在空气中易被氧化而变质的物质
a.氢硫酸或可溶性硫化物:
2H2S+O2=2S↓+2H2O
b.亚硫酸及其可溶性盐2H2SO3+O2=2H2SO4,2Na2SO3+O2=2Na2SO4
c.亚铁盐、氢氧化亚铁4Fe(OH)2+O2+2H2O=4Fe(OH)3
d.苯酚
e.氢碘酸及其可溶性碘化物4HI+O2=2H2O+2I2
⑥吸氧腐蚀(如:
铁生锈)
负极:
2Fe—4e—=2Fe2+正极:
O2+4e—+2H2O=4OH—Fe2++2OH—=Fe(OH)2
4Fe(OH)2+O2+2H2O=4Fe(OH)32Fe(OH)3=Fe2O3+3H2O
(2)生成氧气的反应方程式
2.2氧气和臭氧的比较
物质名称
臭氧
氧 气
物理性质
通常状态
气 态
气 味
有刺激性臭味
无 味
熔点/℃
约—251
约—218
沸点/℃
约—112
约—183
颜 色
气态呈浅蓝色,液态呈深蓝色,固态呈紫黑色
气态无色,液态呈浅蓝色,固态仍呈浅蓝色
标况密度g/L
2.143
1.429
溶解度mL/L
494
30.8
主要化学性质
氧化性极强,可氧化Ag、Hg等
氧化性强,但难氧化Ag、Hg等
主要用途
漂白、消毒;
地球上生物的天然保护伞;
刺激中枢神经,加速血液循环
供给呼吸,支持燃烧
自然存在
90%存在于距地面15km—50km的大气平流层中
主要存在于空气中,空气中O2占的体积分数约为20%
相互转化
2.3.硫及其化合物转化关系图
2.4硫元素的化学反应
(1)硫单质的反应
④S+Hg=HgS
⑥S+2Ag=Ag2S
⑦3S+6KOH=2K2S+K2SO3+3H2O
⑩S+6HNO3(浓)=H2SO4+6NO2↑+2H2O
(2)H2S的反应
①H2SH2+S↓
②
③H2S+X2=2HX+S↓(X2是指卤素单质,即Cl2,Br2,I2)
④H2S+Pb(Ac)2=PbS↓+2HAc
⑤H2S+CuSO4=CuS↓+H2SO4
⑦FeS+2HCl=FeCl2+H2S↑(H2S的实验室制法)
一、硫及其化合物的性质
(一)硫及其重要化合物间的相互转化关系(见上图)
注意:
1、氧化性酸与酸的氧化性的区别
酸根部分易得电子——有氧化性——氧化性酸
酸的氧化性应包括H+的氧化性(酸所共有的)与酸根的氧化性(氧化性酸的特点)两种类型
2、根据氯气、硫等非金属单质性质的学习,掌握非金属单质性质的一般方法应从下列几个方面分析:
反应;
与金属的反应;
与氧气的反应;
与非金属的反应;
与水的反应;
与氧化物的反应;
与碱的反应;
与酸的反应;
与盐的反应;
(与有机物反应)等。
3、掌握化合物性质的一般方法应从下列几个方面分析:
稳定性;
可燃性;
酸碱性;
氧化性和还原性;
特殊性等。
2.5二氧化硫的物理性质
无色、有刺激性气味的有毒气体;
密度比空气大;
易溶于水(1∶40);
(可用于进行喷泉实验,如SO2、HCl、NH3);
易液化(-10℃)
4、SO2的化学性质
1)、酸性氧化物
能和碱反应生成盐和水:
SO2+2NaOH===Na2SO3+H2O
与水反应生成相应的酸:
SO2+H2O===H2SO3(二氧化硫的水溶液使紫色石蕊试液变红)
二氧化硫溶于水形成的亚硫酸只能存在于溶液中,它很不稳定,容易分解成水和二氧化硫,故二氧化硫溶于水的反应是可逆反应。
SO2+H2OH2SO3
2)、氧化性:
SO2气体通过氢硫酸,溶液变浑浊,有淡黄色不溶物出现。
SO2+2H2S===3S↓+2H2O
3)、还原性:
SO2使溴水和高锰酸钾溶液褪色
SO2+Br2+2H2O===H2SO4+2HBr
5SO2+2KMnO4+2H2O===K2SO4+2MnSO4+2H2SO4
2SO2+O22SO3
(SO3+H2O===H2SO4,SO3是一种无色固体,熔点是16.80C,沸点也只有44.8℃,易溶于水,溶于水时放出大量的热。
)
4)、漂白性:
SO2使品红溶液褪色:
由于二氧化硫可跟某些有色物质化合成无色物质,而化合成的无色物质却是不稳定的,易分解而恢复原来有色物质的颜色。
漂白性的比较
具有漂白性的物质
物质
HClO、O3、H2O2、Na2O2
木炭
原理
将有色物质氧化分解
与有色物质结合生成无色物质
将有色物质的分子吸附在其表面
实质
氧化还原反应
非氧化还原反应
物理吸附
效果
永久性
暂时性
范围
可漂白大多数有色物质,能使紫色石蕊褪色
可漂白某些有色物质,不能使石蕊试液褪色
可吸附某些有色物质的分子
把Cl2和SO2混合用于漂白,能否增强漂白效果?
为什么?
〖答案〗不能,SO2+Cl2+2H2O===H2SO4+2HCl
SO2与CO2的相互鉴别
鉴别SO2气体的常用方法是用品红溶液,看能否使其褪色,有时还需再加热看能否再复原。
鉴别CO2气体的常用方法是用澄清石灰水,看能否使其变浑浊,足量时再变澄清。
当混有CO2时,不会影响SO2的鉴别;
当混有SO2时会干扰CO2的鉴别,应先除去SO2后再用澄清石灰水鉴别CO2气体。
除去CO2中的SO2,常用方法是使混合气体先通过足量溴水或酸性KMnO4溶液或饱和NaHCO3溶液(吸收SO2),再通过品红溶液(检验SO2是否被除尽)。
2.5.1制法
1).工业制法
a,硫磺燃烧法S+O2SO2
b,煅烧硫铁矿法4FeS2+11O22Fe2O3+8SO2
2).实验室制法
Na2SO3(s)+H2SO4(浓)===Na2SO4+SO2↑+H2O
实验中常使用溶质的质量分数为60%左右的硫酸,也可用浓硫酸。
不能用很稀的硫酸,因为SO2在水中的溶解度较大,常温常压下1体积水能溶解40体积的SO2。
6、二氧化硫的污染:
pH小于5.6的雨水,称之为酸雨。
7.利用硫酸的强酸性制备多种物质:
(1)制气体:
制氢气Zn+H2SO4ZnSO4+H2↑;
制H2S:
FeS+H2SO4H2S↑+FeSO4
(2)制较弱的酸:
制H3PO4;
Ca3(PO4)2+3H2SO4(浓)2H3PO4+2CaSO4
制CH3COOH:
2CH3COONa+H2SO42CH3COOH+Na2SO4
(3)制化肥:
Ca3(PO4)2+2H2SO4(浓)Ca(H2PO4)2+2CaSO42NH3+H2SO4=(NH4)2SO4
(4)制硫酸盐:
制胆矾:
CuO+H2SO4+4H2OCaSO4·
5H2O(晶体)
制绿矾:
Fe+H2SO4FeSO4+H2↑
8.利用H2SO4高沸点性制取易挥发性酸。
(1)制HF:
CaF2+H2SO4(浓)2HF↑+CaSO4(铅皿中)
(2)制HCl:
NaCl(固)+H2SO4(浓)NaHSO4+HCl↑
NaHSO4+NaClNa2SO4+HCl↑
(3)制HNO3:
NaNO3+H2SO4(浓)HNO3↑+NaHSO4
9.利用硫酸的稳定性制不稳定性酸。
Na2SO3+H2SO4Na2SO4+H2O+SO2↑
10.利用浓H2SO4的强氧化性制取SO2
Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
11.利用浓H2SO4的脱水性:
(1)制C2H4:
CH3CH2OHCH2CH2↑+H2O
(2)制CO:
HCOOHCO↑+H2O
12.利用浓H2SO4的吸水性做干燥剂。
干燥:
O2、H2、Cl2、N2、CO、CO2、SO2
不干燥:
碱性:
NH3还原性:
H2S、HI、HBr
13.用H2SO4作催化剂:
(1)乙烯水化:
CH2—CH2+H2OCH3CH2OH
13.浓硫酸
(1)物理性质:
无色油状液体,常见的浓硫酸质量分数为98.3%,沸点为338℃,高沸点难挥发性。
(2)化学性质:
①吸水性(干燥剂)
三种形式:
<
1>
与水任意比例混溶,溶于水剧烈放热。
2>
吸收气体中水蒸气(作为干燥剂,不能干燥硫化氢、溴化氢、碘化氢、氨气)
3>
与结晶水合物反应。
实验:
浓硫酸与胆矾反应,由胆矾蓝色变为白色说明浓硫酸有吸水性。
②脱水性(炭化)
脱水性是浓硫酸的性质,而非稀硫酸的性质,即浓硫酸有脱水性。
脱水性是浓硫酸的化学特性,物质被浓硫酸脱水的过程是化学变化的过程。
反应时,浓硫酸按水分子中氢、氧原子数的比为2:
1夺取有机物中的氢原子和氧原子。
可被浓硫酸脱水的物质一般为含氢、氧元素的有机物,其中蔗糖、木屑、纸屑和棉花等物质被子脱水后生成了黑色的炭(炭化)。
③强氧化性
实验6—5:
浓硫酸与铜反应,请同学注意反应现象,分析反应产物存在的依据。
(浓)
强调:
硫酸所起的作用(氧化剂与酸的作用)。
叙述:
浓硫酸也与木炭反应,
分析上述反应中元素化合价的变化情况,指出氧化剂和还原剂。
思考:
请设计实验证明浓硫酸与炭反应的三种产物,画出实验装置图。
介绍:
钝化现象及有关应用(分别举Al、Fe,说明原因)。
(二)检验
①现象(产生白色沉淀)现象(沉淀不消失)
结论:
可能含有、、。
②现象(产生白色沉淀)现象(沉淀不消失)
可能含、。
③现象(产生白色沉淀)现象(沉淀不消失)
④现象(产生白色沉淀)现象(沉淀不消失)
可能含、、、。
小结:
在中学化学里常常先用盐酸把溶液酸化,以排除、、等可能造成的干扰,再加入溶液,根据是否有白色沉淀出现来阐明原溶液中是否有存在。
(三)硫酸盐
1.酸式盐、的水溶液显酸性,因为:
,所以,有强酸作用。
2.正盐
硫酸盐
结晶水合物的俗名
生石膏
熟石膏
制粉笔、模型、塑像等
芒硝
制玻璃、造纸工业
皓矾
收敛剂、防腐剂、颜料