弱电解质电离经典习题Word文档下载推荐.doc
《弱电解质电离经典习题Word文档下载推荐.doc》由会员分享,可在线阅读,更多相关《弱电解质电离经典习题Word文档下载推荐.doc(9页珍藏版)》请在冰豆网上搜索。
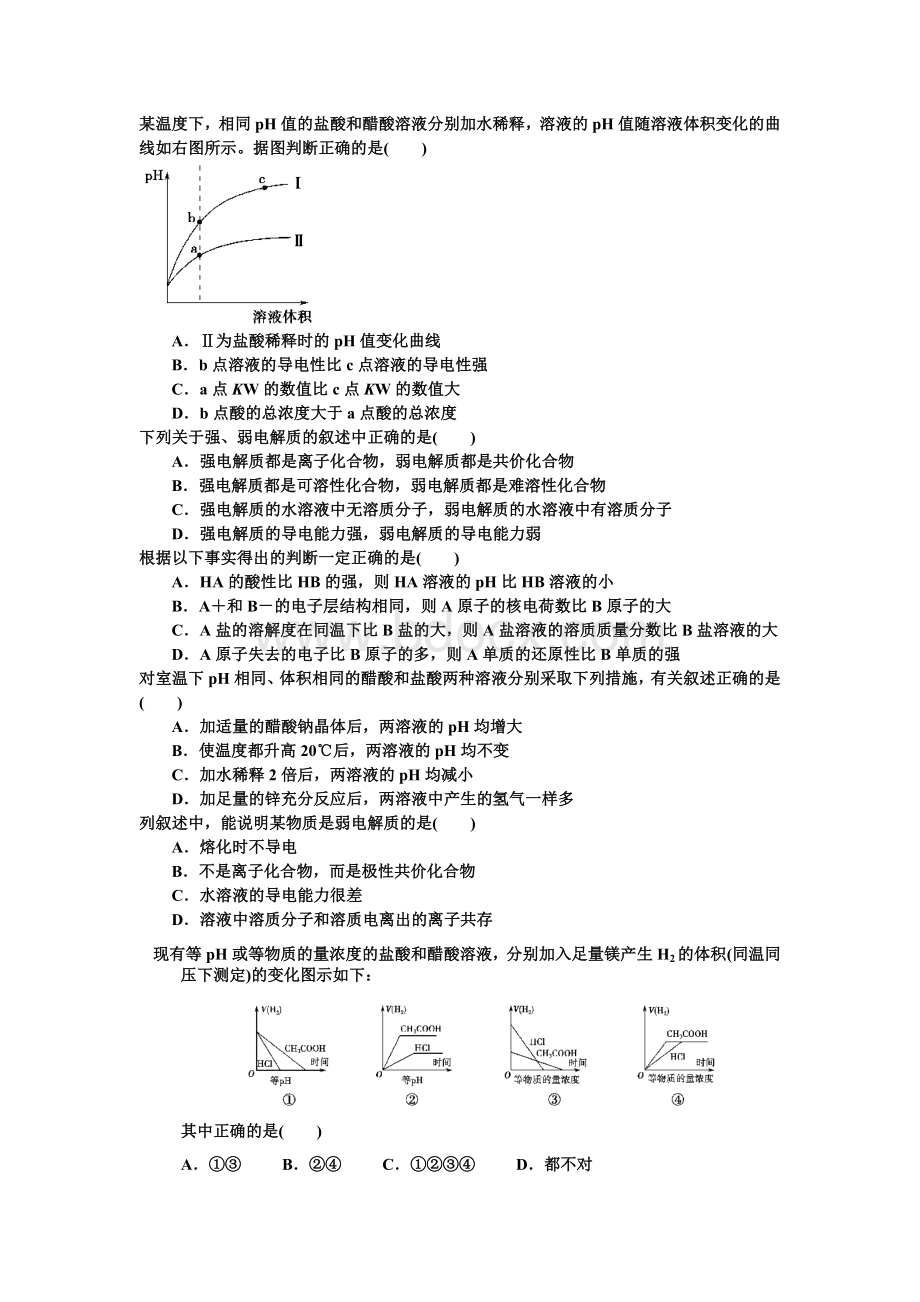
列叙述中,能说明某物质是弱电解质的是( )
A.熔化时不导电
B.不是离子化合物,而是极性共价化合物
C.水溶液的导电能力很差
D.溶液中溶质分子和溶质电离出的离子共存
现有等pH或等物质的量浓度的盐酸和醋酸溶液,分别加入足量镁产生H2的体积(同温同压下测定)的变化图示如下:
其中正确的是( )
A.①③B.②④C.①②③④D.都不对
下列关于盐酸与醋酸两种稀溶液的说法正确的是( )
A.相同浓度的两溶液中c(H+)相同
B.100mL0.1mol·
L-1的两溶液能中和等物质的量的氢氧化钠
C.pH=3的两溶液稀释100倍,pH都为5
D.两溶液中分别加入少量对应的钠盐,c(H+)均明显减小
已知室温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
A.该溶液的pH=4
B.升高温度,溶液的pH增大
C.此酸的电离平衡常数约为1×
10-7
D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
常温下,向等物质的量浓度的两种一元酸的盐溶液中,分别通入少量的CO2,发生如下反应:
NaA+CO2+H2O===HA+NaHCO3
2NaB+CO2+H2O===2HB+Na2CO3,
则等物质的量浓度的HA和HB在水中电离出H+的能力大小关系是( )
A.HA较强B.HB较强
C.两者一样D.无法比较
下列说法正确的是( )
A.强电解质溶液一定比弱电解质溶液的导电性强
B.强电解质的稀溶液中不存在溶质分子
C.强电解质都是离子化合物,而弱电解质都是共价化合物
D.不同的弱电解质只要物质的量的浓度相同,电离程度也相同
把0.05molNaOH固体分别加入到下列100mL溶液中,导电能力变化较大的是( )
A.0.5mol/LMgSO4溶液 B.0.5mol/L盐酸
C.0.5mol/L的CH3COOH溶液 D.0.5mol/LNH4Cl溶液
醋酸是一种常见的弱酸,为了证明醋酸是弱电解质,某同学开展了题为“醋酸是弱电解质的实验探究”的探究活动。
该同学设计了如下方案,其中错误的是( )
A.先配制一定量的0.10mol/LCH3COOH溶液,然后测溶液的pH,若pH大于1,
则可证明醋酸为弱电解质
B.先配制一定量0.01mol/L和0.10mol/L的CH3COOH溶液,分别用pH计测它们
的pH,若两者的pH相差小于1个单位,则可证明醋酸是弱电解质
C.先测0.10mol/LCH3COOH溶液的pH,然后将其加热至100℃,再测pH,如果
pH变小,则可证明醋酸是弱电解质
D.配制一定量的CH3COONa溶液,测其pH,若常温下pH大于7,则可证明醋酸
是弱电解质
冰醋酸加水稀释时,溶液中的氢离子浓度随加入的水量变化的下列各曲线图中,正确的是( )
向1LpH=2的盐酸和醋酸溶液中,分别投入0.65g锌粒,则下图中比较符合客观事实的是( )
相同温度下,两种氨水A、B,浓度分别是0.2mol/L和0.1mol/L,则A和B的OH-浓度之比( )
A.大于2B.小于2C.等于2D.不能确定
电离度是描述弱电解质电离程度的物理量,电离度=(已电离的物质的量/原来的总物质的量)×
100%。
现取20mLpH=3的CH3COOH溶液,加入0.2mol·
L-1的氨水,测得溶液导电性变化如右图,则加入氨水前CH3COOH的电离度为( )
A.0.5%B.1.5%C.0.1%D.1%
解析:
从所给的公式可以看出,欲求电离度,须求出已电离的醋酸和醋酸总量。
已电离的醋酸浓度应与电离出来的氢离子浓度相等,即等于1×
10-3mol/L;
从图中可看出,在加入10mL氨水时,溶液导电能力最强,此时醋酸与氨水恰好完全反应生成醋酸铵,故醋酸总浓度为0.2mol·
L-1×
0.010L÷
0.020L=0.1mol·
L-1,电离度=(已电离的物质的量/原来的总物质的量)×
100%=(1×
10-3mol/L÷
0.1mol/L)×
100%=1%。
答案:
D
电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。
右图是用KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。
下列示意图中,能正确表示用NH3·
H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是( )
加入NH3·
H2O溶液,先和较强的HCl反应,离子的物质的量并未增加,但离子物质的量浓度减小,电导率下降;
随后NH3·
H2O和较弱的CH3COOH反应,离子物质的量浓度增加,电导率上升;
最后,加入的NH3·
H2O不再反应,对原溶液稀释,电导率略有下降。
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是( )
A.a、b、c三点溶液的pH:
c<
a<
b
B.a、b、c三点醋酸的电离程度:
C.用湿润的pH试纸测量a处溶液的pH,测量结果偏小
D.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:
已知25℃时有关弱酸的电离平衡常数:
弱酸化学式
CH3COOH
HCN
H2CO3
电离平衡常数(25℃)
1.8×
10-5
4.9×
10-10
K1=4.3×
10-7K2=5.6×
10-11
则下列有关说法正确的是( )
A.等物质的量浓度的各溶液pH关系为pH(NaCN)>
pH(Na2CO3)>
pH(CH3COONa)
B.将amol·
L-1HCN溶液与amol·
L-1NaOH溶液等体积混合,混合液中:
c(OH-)>
c(H+),c(Na+)>
c(CN-)
C.冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小
D.NaHCO3和Na2CO3混合液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO)+c(CO)
(3)在25℃下,将amol·
L-1的氨水与0.01mol·
L-1的盐酸等体积混合,反应平衡时溶液中c(NH)=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性;
用含a的代数式表示NH3·
H2O的电离常数Kb=________。
(4)NO2可用氨水吸收生成NH4NO3。
25℃时,将amolNH4NO3溶于水,溶液显酸性,原因是________________________________________________________________________
________(用离子方程式表示)。
向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将________(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为________mol·
L-1。
(NH3·
H2O的电离平衡常数取Kb=2×
10-5mol·
L-1)
在体积为1L,pH均为2的盐酸和醋酸溶液中,分别投入0.23gNa,下列示意图中正确的是( )
将一定体积的NaOH溶液分成两等份,一份用pH=2的一元酸HA溶液中和,消耗酸溶液的体积为V1;
另一份用pH=2的一元酸HB溶液中和,消耗酸溶液的体积为V2;
则下列叙述正确的是( )
A.若V1>
V2,则说明HA的酸性比HB的酸性强
B.若V1>
V2,则说明HA的酸性比HB的酸性弱
C.因为两种酸溶液的pH相等,故V1一定等于V2
D.HA、HB分别和NaOH中和后,所得的溶液都一定呈中性
常温下,有关下列4种溶液的说法正确的是( )
A.由水电离出的c(H+):
③>
①
B.①稀释到原来的100倍,pH与②相同
C.①与③混合,若溶液pH=7,则溶液中c(NH)>
c(Cl-)
D.②与④等体积混合,混合液pH>
7
相同温度下,根据三种酸的电离常数,下列判断正确的是( )
酸
HX
HY
HZ
电离常数K
9×
10-6
10-2
A.三种酸的强弱关系:
HX>
HY>
B.反应HZ+Y-===HY+Z-能够发生
C.相同温度下,0.1mol·
L-1的NaX、NaY、NaZ溶液,NaZ溶液pH最大
D.相同温度下,1mol·
L-1HX溶液的电离常数大于0.1mol·
L-1HX
已知25℃时部分弱电解质的电离平衡常数数据见下表:
化学式
HClO
电离平衡常数
Ka=1.8×
Ka1=4.3×
Ka2=5.6×
Ka=3.0×
10-8
回答下列问题:
(1)物质的量浓度均为0.1mol·
L-1的四种溶液:
a.CH3COONa b.Na2CO3
c.NaClO d.NaHCO3
pH由小到大排列顺序是________(用编号填空)。
(2)常温下,0.1mol·
L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是________。
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)·
c(OH-) D.c(OH-)/c(H+)
E.c(H+)·
c(CH3COO-)/c(CH3COOH)
(3)体积均为100mLpH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数________(填“大于”“小于”或“等于”)CH3COOH的电离平衡常数,理由是
________________________________________________________________________
________________________________________________________________________。
25℃下,向20mL0.2mol·
L-1的氢氟酸中滴加0.2mol·
L-1的NaOH溶液时,溶液的pH变化如图所示,请回答下列问题:
(1)在氢氟酸的稀溶液中,通过改变以下条件能使氢氟酸的电离度α(HF)增大的是_______