化学高考化学实验专题综合试题含答案Word格式.docx
《化学高考化学实验专题综合试题含答案Word格式.docx》由会员分享,可在线阅读,更多相关《化学高考化学实验专题综合试题含答案Word格式.docx(20页珍藏版)》请在冰豆网上搜索。
148℃
200℃分解
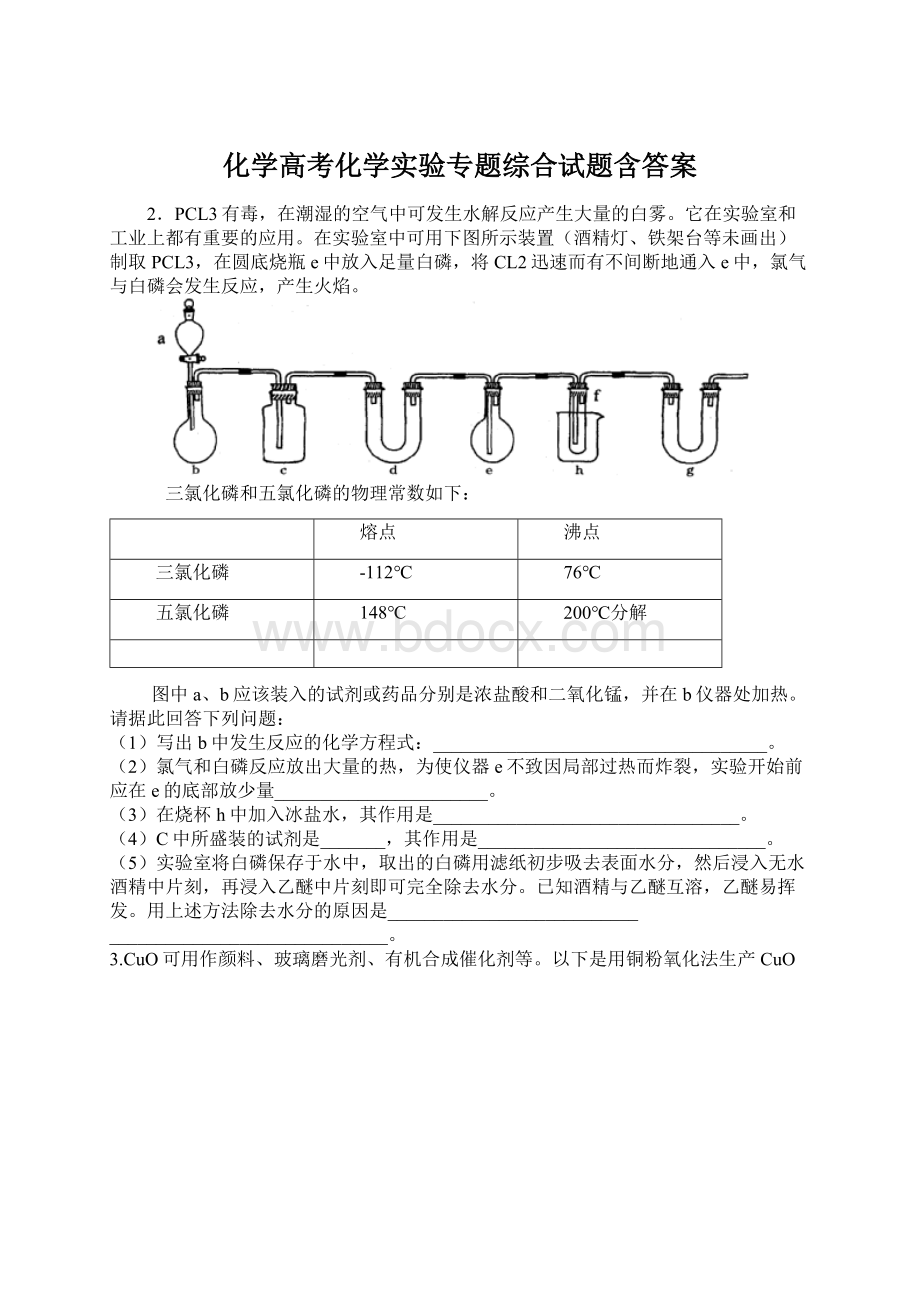
图中a、b应该装入的试剂或药品分别是浓盐酸和二氧化锰,并在b仪器处加热。
请据此回答下列问题:
(1)写出b中发生反应的化学方程式:
____________________________________。
(2)氯气和白磷反应放出大量的热,为使仪器e不致因局部过热而炸裂,实验开始前应在e的底部放少量_______________________。
(3)在烧杯h中加入冰盐水,其作用是_________________________________。
(4)C中所盛装的试剂是_______,其作用是_______________________________。
(5)实验室将白磷保存于水中,取出的白磷用滤纸初步吸去表面水分,然后浸入无水酒精中片刻,再浸入乙醚中片刻即可完全除去水分。
已知酒精与乙醚互溶,乙醚易挥发。
用上述方法除去水分的原因是___________________________
______________________________。
3.CuO可用作颜料、玻璃磨光剂、有机合成催化剂等。
以下是用铜粉氧化法生产CuO的流程图:
回答下列问题:
(1)写出溶解过程中的离子方程式_____________________________________。
(2)1∶1的H2SO4是用1体积98%H2SO4与1体积水混合而成。
配制该硫酸溶液所需的玻璃仪器除玻璃棒外,还需要______________、________________。
(3)该工艺会产生一定量的酸性气体,该气体是______________(写分子式),应加以回收处理。
(4)已知氧化亚铜(Cu2O)与稀H2SO4反应有CuSO4和Cu生成。
假设焙烧后固体只含铜的氧化物,为检验该固体的成分,下列实验设计合理的是___________________(选填序号)。
(a)加入稀H2SO4,若溶液呈现蓝色,说明固体中一定有CuO
(b)加入稀H2SO4,若有红色沉淀物,说明固体中一定有Cu2O
(c)加入稀HNO3,若有无色气体(随即变成红棕色)产生,说明固体中有Cu2O
(d)加入稀HNO3,若全部溶解,说明固体中没有Cu2O
(5)不考虑生产中的损耗,要计算铜粉中Cu的含量,需要测定的数据是_______________和________________________(用文字表示)。
4.某化学实验探究小组拟用稀硫酸溶解已生锈的废铁屑制绿矾(PeS04·
7H20),再通过实验探究硫酸亚秩受热分解生成何种产物。
该小组的实验流程如下:
请填空和回答问题:
(1)废铁屑常附有油污,清洗的方法通常是把,5%Na2CO~溶液加入到盛有废铁屑的烧杯中,加热数分钟,倾去溶液.再用蒸馏水洗涤2-3遍。
上述操作中,加热的目的是 。
(2)第②步操作中所发生的各步反应的离子方程式是 。
(3)第③步操作中所用到的玻璃仪器有 。
(4)用上图所示装置进行实验时,观察到装置Ⅱ中产生白色沉淀,Ⅲ中红色褪去,I中绿色晶体最终变为红棕色,则硫酸亚铁受热分解的化学方程式为 ,当FeSO4分解完全后测得I中剩余固体3.2g,则Ⅱ中产生沉淀的质量应为 g。
5.某化学兴趣小组为了探究某些气体的化学性质,设计发如图所示的实验装置。
实验时,将A、C中产生的气体都通入B中。
(1)实验前如何检查A部分装置的气密性?
__________________________________________________________________。
(2)碱石灰的作用是________________________________。
A中的次氯酸钠可以用________________代替,也能达到同样的目的。
(3)如果a、b分别是_____________________,则实验过程中可能发生爆炸,必须禁止,原因是____________________________________。
(4)如果a、b分别是浓磷酸(磷酸是高沸点酸)、Nal,在B中将会看到__________。
(5)如果a、b分别是________________________,在B中将会看到白烟生成,写出生成白烟的化学议程式:
_______________________________________。
6.在一定条件下,用普通铁粉和水蒸气反应,可以得到铁的氧化物,该氧化物又可以经此反应的逆反应,生成颗粒很细的铁粉。
某校化学小组利用下图所列装置进行铁与水反应的实验,并利用产物进一步与四氧化三铁反应制取铁粉。
(装置中的铁架台、铁夹等必要的夹持仪器在图中均已略去)
(1)烧瓶A中常加入碎瓷片,其作用是 ,
小试管C的作用是 。
(2)为了安全,在E管中的反应发生前,在F出口处必须 ,
E管中的反应开始后,在F出口处应 。
(3)反应3Fe+4H2O(g)Fe3O4+4H2在一定条件下实际上为可逆反应,本实验中是如何实现Fe向Fe3O4的转变的?
试用化学平衡移动原理加以解释 。
(4)停止反应,待B管冷却后,取其中固体加入过量稀盐酸,充分反应后过滤。
简述证明滤液中
含有Fe3+的实验操作及现象 。
(5)若D管中反应按以下两步进行:
Fe3O4+H23FeO+H2O,FeO+H2Fe+H2O,
假设实验开始时D管中的Fe3O4为23.2g,反应一段时间后停止实验,冷却后取出其中固体干燥后称量,其质量变为20g。
通过计算分析其组成可能为 (填序号)
①.Fe ②.Fe和Fe3O4 ③.FeO和Fe3O4④.Fe和FeO⑤.Fe、FeO和Fe3O4
用此20g固体与铝粉在一定条件下进行铝热反应,最多可消耗铝粉 g。
(不考虑空气中的成分参与反应)
6.某校化学小组学生利用图12装置进行“氨的催化氧化及其产物验证”实验。
(图中夹持装置已略去)
(1)装置B中盛放的试剂是__________(填名称),用来吸收混合气体中的水汽。
(2)反应开始时,将装置C中铂丝加热到红热,撤去酒精灯,铂丝变暗。
此时鼓入空气,铂丝又变红热。
这是因为氨的催化氧化是_________反应。
(3)实验过程中,装置D中的导管容易生成无色晶体而堵塞。
为了解决该问题,可以在活塞a后增加______(选填序号)。
①盛有蒸馏水的洗气瓶 ②盛有浓盐酸的洗气瓶 ③盛有碱石灰的U形管
(4)反应一段时间后,装置E中的气体颜色应为______色。
此时,装置E中的含氮化合物有NH3、NO、NO2、________________(填化学式)。
(5)反应一段时间后,装置F中的紫色石蕊试液变红,其原因是(写出化学方程式)__________________________________________________。
(6)实验结束时,应__________________________,并停止鼓入空气。
(7)工业上合成氨的反应是:
N2(g)+3H2(g) 2NH3(g);
△H=-92.2kJ·
mol-1。
①下列做法能够提高工业合成氨转化率的是_________(选填字母)
a.增大压强 b.升高温度
c.使用铁触媒 d.将生成的NH3及时从混合气体中分离出去
②工业合成氨时采用500℃左右的温度,主要是因为_____________________________________________________________。
6.下图是一个实验室制取氯气并以氯气为原料进行特定反应的装置:
(1)A是氯气发生装置,写出反应的化学方程式,并标出电子转移的方向和数目:
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,连接上E装置。
Cl2通过C瓶后再进入D。
D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl。
试写出D中反应的化学方程式:
。
装置C的作是:
。
(3)在E处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是:
。
(4)若将E处烧杯中溶液改为澄清石灰水,反应过程的现象为 。
A、有白色沉淀生成;
B、无现象;
C、先生成白色沉淀而后沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的A处仍有Cl2产生,此时B中的现象是 。
装置B的作用是 。
6.过氧化钠保存不当容易变质。
(1)某过氧化钠样品已经部分变质,只限用一种溶液,请你设计一种简便的化学方法,证明过氧化钠已经变质。
(2)如何用最简单的实验来检验样品中尚有过氧化钠
(3)某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取ag样品,并设计用下图装置来测定过氧化钠的质量分数。
(A) (B) (C) (D) (E) (F)
上图中的E和F构成量气装置,用来测定O2的体积。
①写出装置A和B中发生反应的离子方程式:
装置A:
装置B:
②写出装置C中发生反应的化学方程式:
③NaOH的作用是
④他们在读出量筒内水的体积数后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为
11.为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去