高考化学考点分类汇编专题二十三 实验方案的设计与评价近3年真题+模拟Word下载.docx
《高考化学考点分类汇编专题二十三 实验方案的设计与评价近3年真题+模拟Word下载.docx》由会员分享,可在线阅读,更多相关《高考化学考点分类汇编专题二十三 实验方案的设计与评价近3年真题+模拟Word下载.docx(31页珍藏版)》请在冰豆网上搜索。
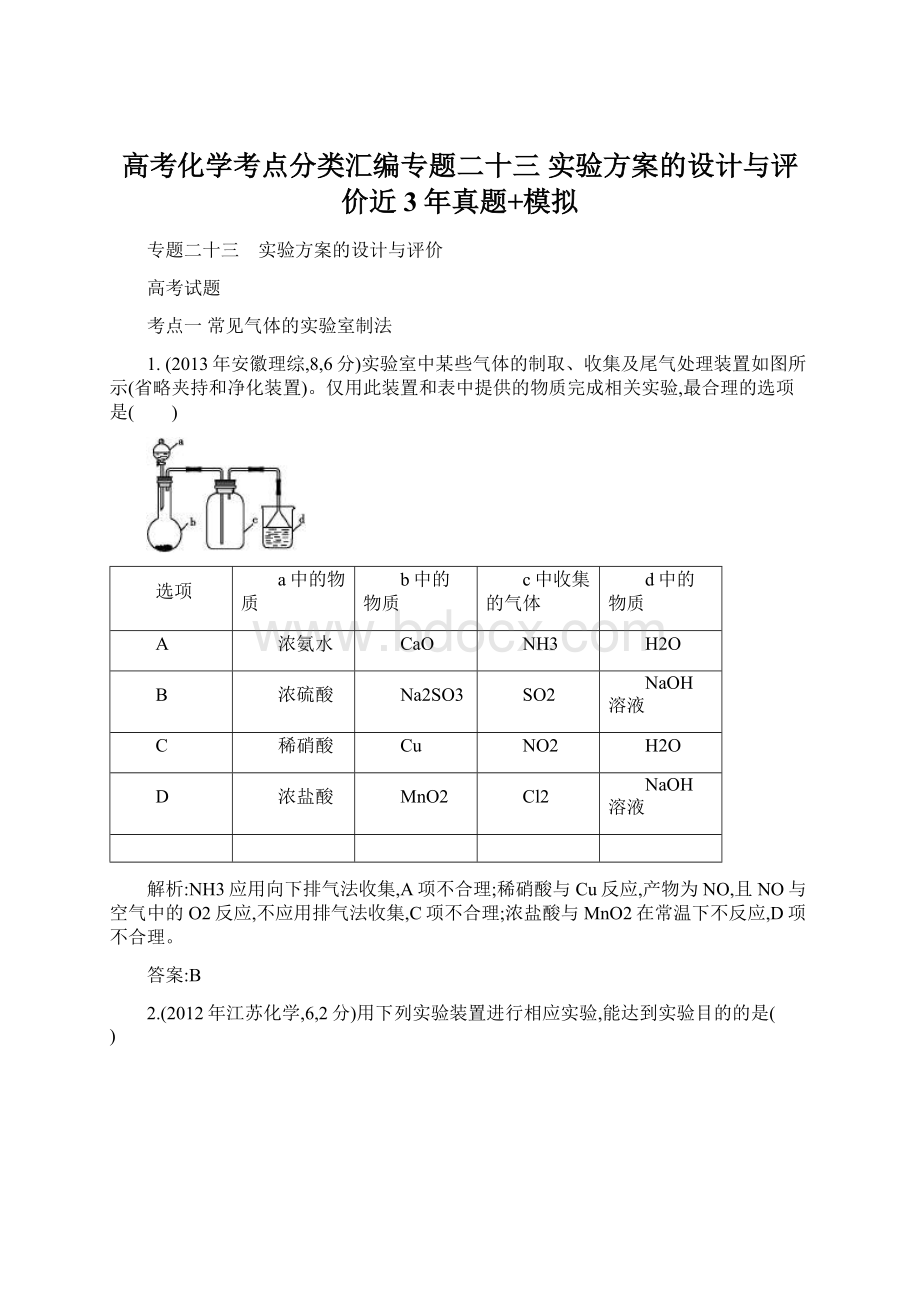
SO2
NaOH溶液
C
稀硝酸
Cu
NO2
D
浓盐酸
MnO2
Cl2
解析:
NH3应用向下排气法收集,A项不合理;
稀硝酸与Cu反应,产物为NO,且NO与空气中的O2反应,不应用排气法收集,C项不合理;
浓盐酸与MnO2在常温下不反应,D项不合理。
答案:
2.(2012年江苏化学,6,2分)用下列实验装置进行相应实验,能达到实验目的的是( )
A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图3所示装置制取少量纯净的CO2气体
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
气体的除杂要保证原气体与洗涤液不反应,由于Cl2能与NaOH溶液反应,A选项错;
由于NH4Cl受热易分解,所以不能蒸干溶液,应该加热浓缩,冷却结晶获得NH4Cl晶体,B选项错;
图3是简易启普发生器装置,要求用块状固体,纯碱是粉末状固体,使粉末漏于容器底部而无法控制反应速率,C选项错;
对于不相混溶的液体,用分液漏斗进行分离,D选项正确。
3.(2012年福建理综,25,15分)实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图所示)。
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是 (填序号)。
A.往烧瓶中加入MnO2粉末
B.加热
C.往烧瓶中加入浓盐酸
(2)制备反应会因盐酸浓度下降而停止。
为测定反应残余液中盐酸的浓度,探究小组同学提出的下列实验
方案:
甲方案:
与足量AgNO3溶液反应,称量生成的AgCl质量。
乙方案:
采用酸碱中和滴定法测定。
丙方案:
与已知量CaCO3(过量)反应,称量剩余的CaCO3质量。
丁方案:
与足量Zn反应,测量生成的H2体积。
继而进行下列判断和实验:
①判定甲方案不可行,理由是 。
②进行乙方案实验:
准确量取残余清液稀释一定倍数后作为试样。
a.量取试样20.00mL,用0.1000mol·
L-1NaOH标准溶液滴定,消耗22.00mL,该次滴定测的试样中盐酸浓度为 mol·
L-1;
b.平行滴定后获得实验结果。
③判断丙方案的实验结果 (填“偏大”、“偏小”或“准确”)。
[已知:
Ksp(CaCO3)=2.8×
10-9、Ksp(MnCO3)=2.3×
10-11]
④进行丁方案实验:
装置如图所示(夹持器具已略去)。
(i)使Y形管中的残余清液与锌粒反应的正确操作是将 转移到 中。
(ii)反应完毕,每间隔1分钟读取气体体积,气体体积逐次减小,直至不变。
气体体积逐次减小的原因是
(排除仪器和实验操作的影响因素)。
(1)加药顺序一般是先加入固体药品,再加入液体药品,最后再加热。
则依次顺序是ACB。
(2)①加入足量的硝酸银溶液只能求出氯离子的量,而不能求出剩余盐酸的浓度。
②由cHClVHCl=cNaOHVNaOH可得出盐酸的浓度为0.1100mol/L。
③由于Ksp(MnCO3)<
Ksp(CaCO3),过量的CaCO3要转化为一部分MnCO3,由于M(MnCO3)>
M(CaCO3),故最终剩余的固体质量增加,导致测得c(H+)偏小。
④使Zn粒进入残余清液中让其发生反应。
这样残余清液就可以充分反应,如果反过来,残余清液不可能全部转移到左边。
反应完毕时,相同时间内则气体体积减少,又排除了其他影响因素,只能从气体本身角度思考,联想到该反应是放热的,就可能想到气体未冷却了。
(1)ACB(按序号写出三项)
(2)①残余清液中,n(Cl-)>
n(H+)(或其他合理答案)
②0.1100 ③偏小 ④(i)Zn粒 残余清液(按序号写出两项)
(ii)装置内气体尚未冷却至室温
4.(2011年天津理综,9,18分)某研究性学习小组为合成1丁醇,查阅资料得知一条合成路线:
CH3CH=CH2+CO+H2CH3CH2CH2CHOCH3CH2CH2CH2OH;
CO的制备原理:
HCOOHCO↑+H2O,并设计出原料气的制备装置(如图)。
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2丙醇,从中选择合适的试剂制备氢气、丙烯,写出化学反应方程式:
, 。
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是 , 。
c和d中盛装的试剂分别是 , 。
若用以上装置制备H2,气体发生装置中必需的玻璃仪器名称是 ;
在虚线框内画出收集干燥H2的装置图。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是 (填序号)。
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水④无水CuSO4 ⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是 。
a.低温、高压、催化剂b.适当的温度、高压、催化剂
c.常温、常压、催化剂d.适当的温度、常压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1丁醇粗品。
为纯化1丁醇,该小组查阅文献得知:
①R—CHO+NaHSO3(饱和)RCH(OH)SO3Na↓;
②沸点:
乙醚34℃,1丁醇118℃,并设计出如下提纯路线:
粗品滤液有机层1丁醇、乙醚纯品
试剂1为 ,操作1为 ,操作2为 ,操作3为 。
(1)实验室用锌粒和稀盐酸制备氢气;
用2丙醇和浓硫酸共热,消去反应制备丙烯;
(2)在题给装置中,a的作用是保持分液漏斗和烧瓶内的气压相等,以保证分液漏斗内的液体能顺利加入烧瓶中;
b主要是起安全瓶的作用,以防止倒吸;
c为除去CO中的酸性气体,选用NaOH溶液,d为除去CO中的H2O(g),试剂选用浓硫酸;
若用题给装置制备H2,则不需要酒精灯,必须得是反应容器和滴加盐酸的仪器,氢气用向下排空气法收集,注意导气管伸入底部;
(3)检验丙烯和少量SO2、CO2及水蒸气组成的混合气体各成分时,应首先选④无水CuSO4检验水蒸气,然后用⑤品红溶液检验SO2,并用①饱和Na2SO3溶液除去SO2;
然后用③石灰水检验CO2,用②酸性KMnO4溶液检验丙烯,应该先除尽SO2,因为丙烯和SO2都能使酸性KMnO4褪色;
(4)题给合成正丁醛的反应为气体体积减小的放热反应,为增大反应速率和提高原料气的转化率,选b;
(5)由操作1后得到“滤液”和信息①可知,试剂1应为NaHSO3饱和溶液,操作为过滤;
加入乙醚时1丁醇易溶解于其中,故操作2为萃取分液;
根据两种有机物沸点的不同,操作3应为蒸馏。
(1)Zn+2HClZnCl2+H2↑
CH3CHCH2↑+H2O
(3)④⑤①②③(或④⑤①③②)
(4)b (5)饱和NaHSO3溶液 过滤 萃取 蒸馏
5.(2009年福建理综,25,17分)某研究性小组借助A~D的仪器装置完成有关实验
【实验一】收集NO气体。
(1)用装置A收集NO气体,正确的操作是 (填序号)。
a.从①口进气,用排水法集气
b.从①口进气,用排空气法集气
c.从②口进气,用排水法集气
d.从②口进气,用排空气法集气
【实验二】为了探究镀锌薄铁板上的锌的质量分数w(Zn)和镀层厚度,查询得知锌易溶于碱:
Zn+2NaOHNa2ZnO2+H2↑据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1g。
用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
方案甲:
通过测量试样与碱反应生成的氢气体积来实现探究目标。
(2)选用B和 (填仪器标号)两个装置进行实验。
(3)测得充分反应后生成氢气的体积为VL(标准状况),w(Zn)= 。
(4)计算镀层厚度,还需要的一个物理量是 。
(5)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将 (填“偏大”、“偏小”或“无影响”)。
方案乙:
通过称量试样与碱反应前后的质量实现探究目标。
选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g。
(6)w(Zn)= 。
方案丙:
通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为H2的质量)实现探究目标。
实验同样使用仪器C。
(7)从实验误差角度分析,方案丙 方案乙(填“优于”、“劣于”或“等同于”)。
(1)NO遇空气立即被氧化,故不能用排空气法收集,只能用排水法收集。
排水时应用短进长出。
(2)方案甲:
Zn和Fe中只有Zn可以与NaOH产生气体,通过排水收集气体,依据反应方程式即可算出Zn的质量分数。
所以需要的装置有测H2的体积的D装置。
(3)Zn与H2之间量为1∶1,则n(Zn)=mol,w(Zn)==
(4)有了Zn的质量,如果有密度,则可以求出Zn的体积,再由Zn的截面积,即可求出Zn的高度(厚度)。
(5)恒压式分液漏斗产生的气体有部分残留在分液漏斗上方,故收集气体少了,所以用普通分液漏斗时收集的H2多一些,则计算出的Zn的量偏大。
(6)减少的质量即为Zn的质量。
(7)丙方案H2逸出时会带出部分水蒸气造成较大误差,再者H2质量很小,用该法测出的误差较大。
(1)c
(2)D (3)(或等其他合理答案)
(4)金属锌的密度(或其他合理答案)
(5)偏大
(6)(或其他合理答案) (7)劣于
考点二实验方案的设计与评价
1.(2013年天津理综,9,18分)FeCl3在现代工业生产中应用广泛。
某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
Ⅰ.经查阅资料得知:
无水FeCl3在空气中易潮解,加热易升华。
他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为 。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端。
要使沉积的FeCl3进入收集器,第④步操作是 。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号) 。
(4)装置B中冷水浴的作用为 ;
装置C的名称为 ;
装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:
。
(5)在虚线框中画出尾气吸收装置E并注明试剂。
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;
过滤后,再以石墨为电极,在一定条件下电解滤液。
(6)FeCl3与H2S反应的离子方程式为 。
(7)电解池中H+在阴极放电产生H2,阳极的电极反应式为 。
(8)综合分析