32化学反应中的平衡文档格式.docx
《32化学反应中的平衡文档格式.docx》由会员分享,可在线阅读,更多相关《32化学反应中的平衡文档格式.docx(14页珍藏版)》请在冰豆网上搜索。
3.浓度:
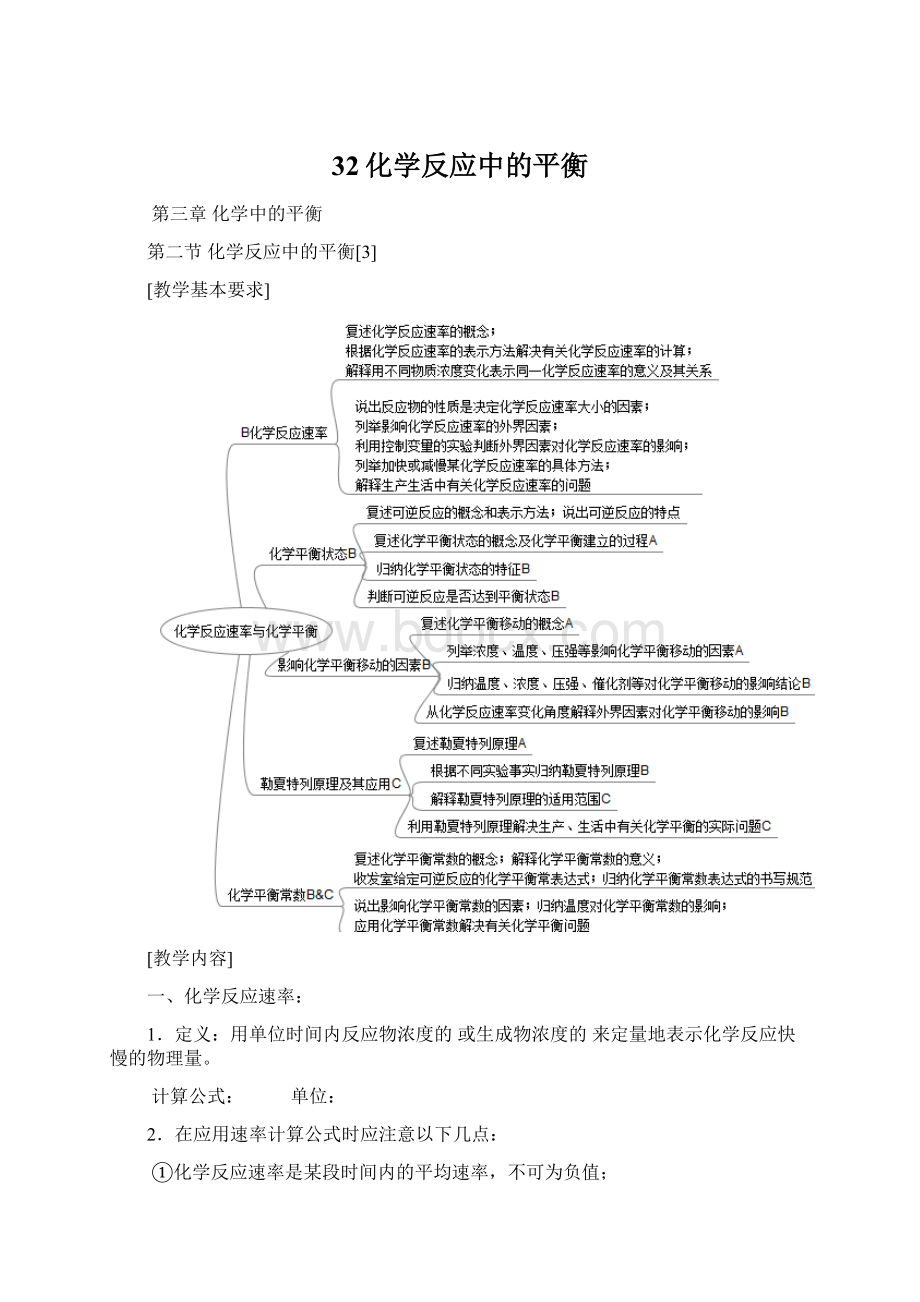
其他条件相同时,反应物浓度,反应速率。
4.压强:
有气体参加的化学反应,其他条件不变时,增大压强,相当于
,反应速率。
5.其他条件相同时,使用合适的催化剂,反应速率加快
6.其他条件相同时,粉末状固体比块状固体反应速率快——接触面积大,反应速率快
【练习】
1.在2L密闭容器中加入4molA和6molB,发生以下反应:
4A(g)+6B(g)4C(g)+5D(g)。
若
经5s后,剩下的A是2.5mol,则B的反应速率是()
A.0.45mol/(L·
s)B.0.15mol/(L·
s)C.0.225mol/(L·
s)D.0.9mol/(L·
s)
2.现有反应4NH3+5O2→4NO+6H2O,反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,其关系正确的是()
A.4v(NH3)=5v(O2)B.4v(NH3)=5v(H2O)
C.4v(O2)=5v(NO)D.4v(NH3)=5v(NO)
3.反应A(g)+3B(g)2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
A.v(D)=0.4mol/(L·
s)B.v(C)=0.5mol/(L·
s)()
C.v(B)=0.6mol/(L·
s)D.v(A)=0.15mol/(L·
s)
4.设反应C+CO22CO(正反应吸热)反应速率为v1,N2+3H22NH3(正反应放热),
反应速率为v2。
对于上述反应,当温度升高时,v1、v2的变化情况为()
A.同时增大B.同时减小C.v1增大,v2减小D.v1减小,v2增大
三、化学平衡
CO+H2O(g)CO2+H2反应中起始和平衡时各物质的浓度(800℃)如表:
起始时各物质的浓度(mol/L)
平衡时各物质的浓度(mol/L)
平衡时
c(CO)
c(H2O)
c(CO2)
c(H2)
0.010
0.0050
1.0
0.008
0.002
0.020
0.0067
0.0133
0.0033
0.98
0.0025
0.030
0.0075
0.0021
0.0296
0.0079
0.0225
1.学平衡状态的建立过程及途径:
2.化学平衡状态定义:
在一定条件下的反应里,和
的速率相等,反应混合物中各组分的和保持不变的状态。
化学平衡状态建立的标志:
5.在容积固定的密闭容器中发生如下反应:
N2(g)+3H2(g)2NH3(g)+92.3kJ。
能说明该反应达到了平衡状态的是:
A.生成氨的速率与氨分解速率相等
B.断开一个N≡N键的同时有六个N-H键生成
C.N2、H2、NH3的百分含量不再变化
D.N2、H2、NH3的分子数之比为1∶3∶2的状态
E.N2、H2、NH3的浓度相等F.N2、H2不再起反应
G.3v(N2)=v(H2)H.混合气体的密度不变I.气体总物质的量不变
J.气体总质量不变K.容器的总压强不变
6.对于在固定容器中发生的反应:
H2(g)+I2(g)2HI(g),下列说法中能说明该反应达到了平衡状态的是
A.气体总物质的量不变B.气体总压强不变
C.反应混合气体的密度不变D.反应混合气体颜色不变
E.存在c(H2):
c(I2):
c(HI)=1:
1:
2F.百分组成w(HI)=w(I2)
3.化学平衡常数:
一定温度下,当可逆反应达到平衡时,生成物浓度指数幂的乘积除以反应物浓度指数幂的乘积,得到的比值是个常数,这个常数叫做该反应的化学平衡常数(简称平衡常数),用符号K表示。
对于反应aA(g)+bB(g)cC(g)+dD(g)+Q(Q>
0),在一定温度下:
K=
①化学平衡常数K只与温度有关,与反应物的起始浓度无关
②反应物或生成物中有固体或纯液体存在时,由于其浓度或视为“1”(不变)而不代入公式。
③化学平衡常数是指某一具体反应的平衡常数。
若反应方程式中各物质的系数等倍扩大或缩小,尽管是同一反应,平衡常数也会改变。
④平衡常数是在一定温度下进行一个化学反应的特征常数,K值越大,表示反应进行的程度,反应物转化率;
反之,反应转化得就越不完全,反应物的转化率就越小。
⑤利用K值变化可判断反应的热效应
若温度升高,K值增大,则正反应为反应。
若温度升高,K值减小,则正反应为反应。
7.有可逆反应Fe(s)+CO2(g)FeO(s)+CO(g),已知在温度938K时,K=1.47,在1173K时,K=2.15。
写出该反应的平衡常数表达式_____,该反应是______(选填“吸热”、“放热”)反应。
8.在2L密闭容器内,800℃时发生如下反应:
2NO(g)+O2(g)2NO2(g)体系中,写出该反应的平衡常数表达式:
K=。
已知:
K300℃>K350℃,则该反应是热反应。
9.在一个体积为4L的密闭容器中,高温下发生下列反应:
C(s)+H2O(g)CO(g)+H2(g)—Q(Q>0)
写出上述反应的平衡常数表达式:
。
降低温度,平衡常数K(填“增大”、“不变”或“减小”),正反应速率;
(填“增大”、“减小”或“不变”,下同),逆反应速率。
10.1000℃时,硫酸钠与氢气发生下列反应:
Na2SO4(s)+4H2(g)Na2S(s)+4H2O(g)。
该反应的平衡常数表达式为____________________。
已知K1000℃<K1200℃,则
该反应是________反应(填“吸热”或“放热”)。
11.在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
t/℃
700
800
830
1000
1200
K
0.6
0.9
1.7
2.6
(1)该反应的化学平衡常数表达式为K=。
(2)该反应为反应(选填吸热、放热)。
(3)某温度下,平衡浓度符合下式:
c(CO2)·
c(H2)=c(CO)·
c(H2O),试判断此时的温度为℃。
4.平衡转化率:
某反应的平衡转化率=
平衡转化率越大,则该反应进行得越完全。
平衡转化率随着反应物起始浓度的不同而改变。
12.已知可逆反应:
M(g)+N(g)P(g)+Q(g),正反应为吸热反应。
请回答下列问题:
(1)某温度下,反应物的起始浓度分别为c(M)=1mol/L,c(N)=2.4mol/L,达到平衡后,M的转化率为60%,此时N的转化率为。
(2)若反应温度升高,M的转化率(填“增大”、“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为c(M)=c(N)=amol/L,达到平衡后,M的转化率为。
(25%、增大、41%)
四.化学平衡移动:
可逆反应中旧化学平衡的破坏、新化学平衡的建立过程叫做化学平衡的移动。
(1)化学平衡移动的方向
v正>v逆,平衡向反应方向移动;
v正=v逆,平衡不移动;
v正<v逆,平衡向反应方向移动。
(2)影响化学平衡的因素
温度:
升高温度,正、逆反应速率都,但v’放热v’吸热,平衡向着方向移动;
降低温度,正、逆反应速率都,但v’放热v’吸热,平衡向着方向移动;
浓度:
增大反应浓度(或减小生成物浓度),v’正v’逆,平衡向着方向移动;
减小反应浓度(或增大生成物浓度),v正v逆,平衡向着方向移动;
压强:
压缩容器体积,反应体系的压强将,平衡向着方向移动;
扩大容器体积,反应体系的压强将,平衡向着方向移动;
(1)向容积固定的容器中充惰性气体,容器内压强将,但反应混合物中各物质浓度,平衡不移动;
(2)在恒压条件下,向体积可变的容器中充惰性气体,相当于将反应体系扩容,反应体系中各物质浓度将,平衡向着方向移动;
催化剂:
因使用催化剂将同等程度地改变正、逆反应速率,故化学平衡不移动。
勒夏特列原理:
13.有某可逆反应aA(g)+bB(g)cC(g)+Q;
右图表示外界条件(温度、压强)的变化对上述反应的影响。
下列判断正确的是()
A.a+b<
c时,y轴表示平衡混合气中C的质量分数
B.a+b<
c时,y轴表示平衡混合气的平均相对分子质量
C.Q<0时,y轴表示达到平衡时B的转化率
D.Q<0时,y轴表示达到平衡时A的浓度
14.不能用平衡移动原理解释的事实是()
A.压缩盛有I2和H2混合气体的针筒,气体颜色变深
C.pH均为4的盐酸和NH4Cl(aq)中水的电离度后者大
B.打开汽水瓶盖,即有大量气泡逸出
D.用排饱和食盐水的方法收集氯气
15.I2在KI溶液中存在下列平衡:
I2(aq)+I-(aq)I3-(aq)。
某I2、、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。
下列说法正确的是()
A.反应I2(aq)+I-(aq)I3-(aq)为吸热反应
B.若温度为T1、T2,反应的平衡常数分别为
K1、K2,则K1>K2
C.若反应进行到状态D时,一定有v正>v逆
D.状态A与状态B相比,状态A的c(I2)大
五.化学反应速率与化学平衡原理在工业生产及生活中的应用
1.接触法制硫酸
生产
阶段
SO2的制取、净化
SO2氧化成SO3
SO3的吸收及硫酸的生成
反应
原理
S+O2SO2
4FeS2+11