届高三化学二轮复习夯基提能作业本 专题六 化学反应速率和化学平衡 Word版含答案文档格式.docx
《届高三化学二轮复习夯基提能作业本 专题六 化学反应速率和化学平衡 Word版含答案文档格式.docx》由会员分享,可在线阅读,更多相关《届高三化学二轮复习夯基提能作业本 专题六 化学反应速率和化学平衡 Word版含答案文档格式.docx(13页珍藏版)》请在冰豆网上搜索。
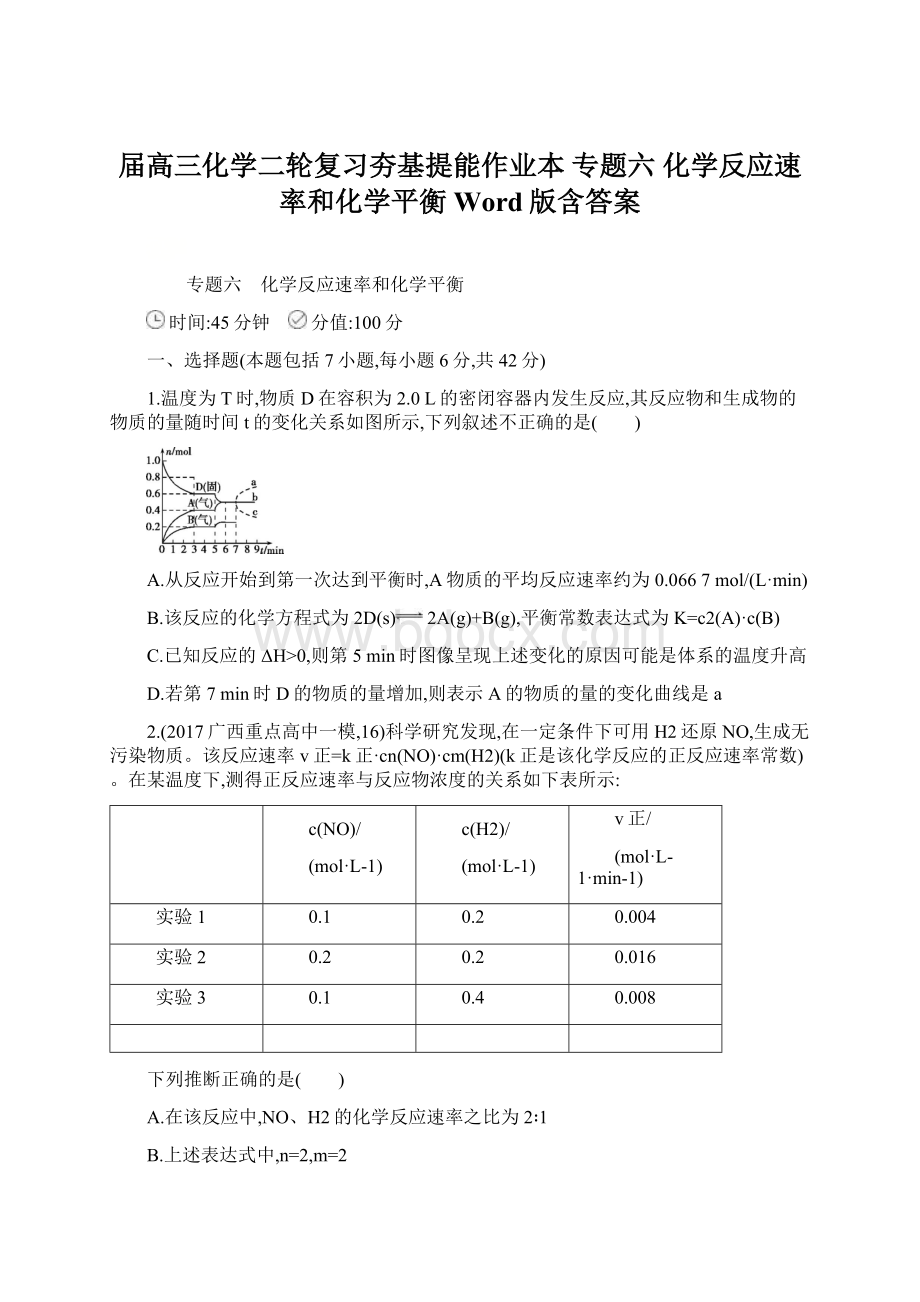
v正/
L-1·
min-1)
实验1
0.1
0.2
0.004
实验2
0.016
实验3
0.4
0.008
下列推断正确的是( )
A.在该反应中,NO、H2的化学反应速率之比为2∶1
B.上述表达式中,n=2,m=2
C.上述表达式中,k正=2.0mol-2·
L2·
min-1
D.其他条件不变,加入催化剂或改变温度,k正不变
3.(2017宁夏银川一模,14)恒温条件下,体积为1L的容器中,P、Q、W三种气体的起始浓度和平衡浓度如下:
物质
P
Q
W
起始浓度/(mol·
平衡浓度/(mol·
0.05
下列说法不正确的是( )
A.反应达到平衡时,Q的转化率为50%
B.反应可表示为P(g)+Q(g)2W(g),其平衡常数K=4
C.达到平衡后,再加入0.1molW,达到新的化学平衡时,W的体积百分含量增加
D.达到平衡后,保持其他条件不变,P、W各加入0.05mol,则化学平衡逆向移动
4.(2017湖南六校联考,14)一定温度下,在三个体积均为2.0L的恒容容器中发生反应:
2NO(g)+2CO(g)N2(g)+2CO2(g)。
各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间的变化关系如图所示。
容器
温度/℃
起始物质的量/mol
NO(g)
CO(g)
甲
T1
0.20
乙
0.30
丙
T2
A.该反应的正反应为放热反应
B.达到平衡时,乙中CO2的体积分数比甲中的大
C.T1℃时,若起始时向甲中充入0.40molNO、0.40molCO、0.40molN2和0.40molCO2,则反应起始时v正>
v逆
D.T2℃时,若起始时向丙中充入0.06molN2和0.12molCO2,则达平衡时N2的转化率小于40%
5.在容积为2L的密闭容器中发生反应xA(g)+yB(g)zC(g)。
图甲表示200℃时容器中A、B、C的物质的量随时间的变化关系,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。
则下列结论正确的是( )
A.200℃时,反应从开始到平衡的平均速率v(B)=0.04mol·
B.200℃时,该反应的平衡常数为25
C.当温度由200℃降到100℃时,原平衡一定被破坏,且正、逆反应速率均增大
D.由图乙可知,反应xA(g)+yB(g)zC(g)的ΔH<
0,且a=2
6.(2017天津理综,6)常压下羰基化法精炼镍的原理为:
Ni(s)+4CO(g)Ni(CO)4(g)。
230℃时,该反应的平衡常数K=2×
10-5。
已知:
Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:
将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:
将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是( )
A.增加c(CO),平衡向正向移动,反应的平衡常数增大
B.第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
C.第二阶段,Ni(CO)4分解率较低
D.该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
7.(2017河南豫北质量评估,16)T1℃时,在2L的密闭容器中,反应CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH<
0达到平衡,反应过程中部分数据见下表。
下列说法正确的是( )
反应时间
n(CO2)/mol
n(H2)/mol
n(CH3OH)/mol
n(H2O)/mol
反应Ⅰ恒温恒容
0min
2
6
10min
4.5
20min
1
30min
反应Ⅱ绝热恒容
A.达到平衡时,反应Ⅰ、Ⅱ对比,平衡常数:
K(Ⅰ)>
K(Ⅱ)
B.对于反应Ⅰ,前10min内的平均反应速率v(CH3OH)=0.025mol·
C.对于反应Ⅰ,若30min时只改变温度为T2℃,再次达到平衡时H2的物质的量为3.2mol,则T1>
D.对于反应Ⅰ,若30min时向容器中再充入1molCO2(g)和1molH2O(g),则平衡正向移动
二、非选择题(本题包括4小题,共58分)
8.(14分)应对雾霾污染、改善空气质量需要从多方面入手,如开发利用清洁能源。
甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景。
Ⅰ.已知:
①CH3OH(g)+H2O(l)CO2(g)+3H2(g)
ΔH=+93.0kJ·
mol-1
②CH3OH(g)+O2(g)CO2(g)+2H2(g)
ΔH=-192.9kJ·
③CH3OH(g)CH3OH(l) ΔH=-38.19kJ·
则表示CH3OH(l)燃烧热的热化学方程式为
。
Ⅱ.一定条件下用CO和H2合成CH3OH:
CO(g)+2H2(g)CH3OH(g)。
在2L恒容密闭容器中充入1molCO和2molH2,在催化剂作用下充分反应,如图表示平衡混合物中CH3OH的体积分数在不同压强下随温度变化的平衡曲线。
回答下列问题:
(1)该反应的反应热ΔH (填“>
”或“<
”)0,压强的相对大小为p1 (填“>
”)p2。
(2)压强为p2,温度为300℃时,该反应的化学平衡常数K= 。
(3)下列各项中,不能说明该反应已经达到平衡的是 。
A.容器内气体压强不再变化
B.v(CO)∶v(H2)∶v(CH3OH)=1∶2∶1
C.容器内气体的密度不再变化
D.容器内混合气体的平均相对分子质量不再变化
E.容器内各组分的质量分数不再变化
(4)某温度下,在保证H2浓度不变的情况下,增大容器的体积,平衡 (填字母)。
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
作出此判断的依据是
。
9.(11分)消除氮氧化物、二氧化硫等物质造成的污染是目前研究的重要课题。
(1)工业上常用活性炭还原一氧化氮,反应的化学方程式为:
2NO(g)+C(s)N2(g)+CO2(g)。
向容积均为1L的甲、乙、丙三个恒容恒温容器中分别加入足量的活性炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min
n(NO)/mol
T
40
80
120
160
T℃
1.45
400℃
1.5
1.1
0.8
0.65
0.53
0.45
甲容器反应温度T℃ 400℃(填“>
”“<
”或“=”);
乙容器中,0~40min内平均反应速率v(CO2)= ;
丙容器中达平衡后NO的物质的量为 mol。
(2)活性炭还原NO2的反应为2NO2(g)+2C(s)N2(g)+2CO2(g),在恒温条件下,1molNO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压强的关系如下图所示:
①A、B、C三点中NO2的转化率最高的是 点(填“A”或“B”或“C”)。
②计算C点时该反应的平衡常数Kp= (Kp是用平衡分压代替平衡浓度计算得到的,分压=总压×
物质的量分数)。
10.(2017江西九校3月联考,27)(15分)目前降低尾气的可行方法是在汽车排气管上安装催化转化器。
NO和CO气体均为汽车尾气的成分,这两种气体在催化转化器中发生反应:
2CO(g)+2NO(g)N2(g)+2CO2(g)
ΔH=-akJ·
mol-1。
(1)CO2的结构式为 。
(2)已知2NO(g)+O2(g)2NO2(g)ΔH=-bkJ·
mol-1;
CO的燃烧热ΔH=-ckJ·
写出在消除汽车尾气中NO2的污染时,NO2与CO的可逆反应的热化学方程式(已知该反应为放热反应):
。
(3)在一定温度下,将2.0molNO、2.4molCO通入容积固定为2L的密闭容器中,反应过程中部分物质的浓度变化如图所示:
①有害气体NO的转化率为 。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是 (填序号)。
a.缩小容器体积
b.在恒压条件下再充入2.0molNO、2.4molCO
c.降低温度
d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,反应将 (填“向左”或“向右”)进行,再次达到平衡时的平衡常数为 。
④若保持反应体系的温度不变,20min时再向容器中充入与平衡组分相同的气体,达到平衡后,CO的体积分数将 (填“增大”“减小”或“不变”)。
11.(2017河北保定一模,26)(18分)雾霾天气严重影响人们的生活和健康。
其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。
因此改善能源结构、机动车限号等措施能有效减少PM2.5、SO2、NOx等污染。
请回答下列问题:
(1)将一定量的某PM2.5样品用蒸馏水溶解制成待测试样(忽略OH-)。
常温下测得该试样的组成及其浓度如下表:
离子
K+
Na+
N
S
Cl-
浓度(mol/L)
4×
10-6
6×
2×
10-5
3×
根据表中数据判断该试样的pH= 。
(2)汽车尾气中NOx和CO的生成:
已知汽缸中生成NO的反应为N2(g)+O2(g)2NO(g) ΔH>
0。
恒温、恒容密闭容器中,能说明该反应达到化学平衡状态的是 。
A.混合气体的密度不再变化
B.混合气体的压强不再变化
C.N2、O2、NO的物质的量之比为