届高考模拟试题化学拆分卷一Word下载.docx
《届高考模拟试题化学拆分卷一Word下载.docx》由会员分享,可在线阅读,更多相关《届高考模拟试题化学拆分卷一Word下载.docx(8页珍藏版)》请在冰豆网上搜索。
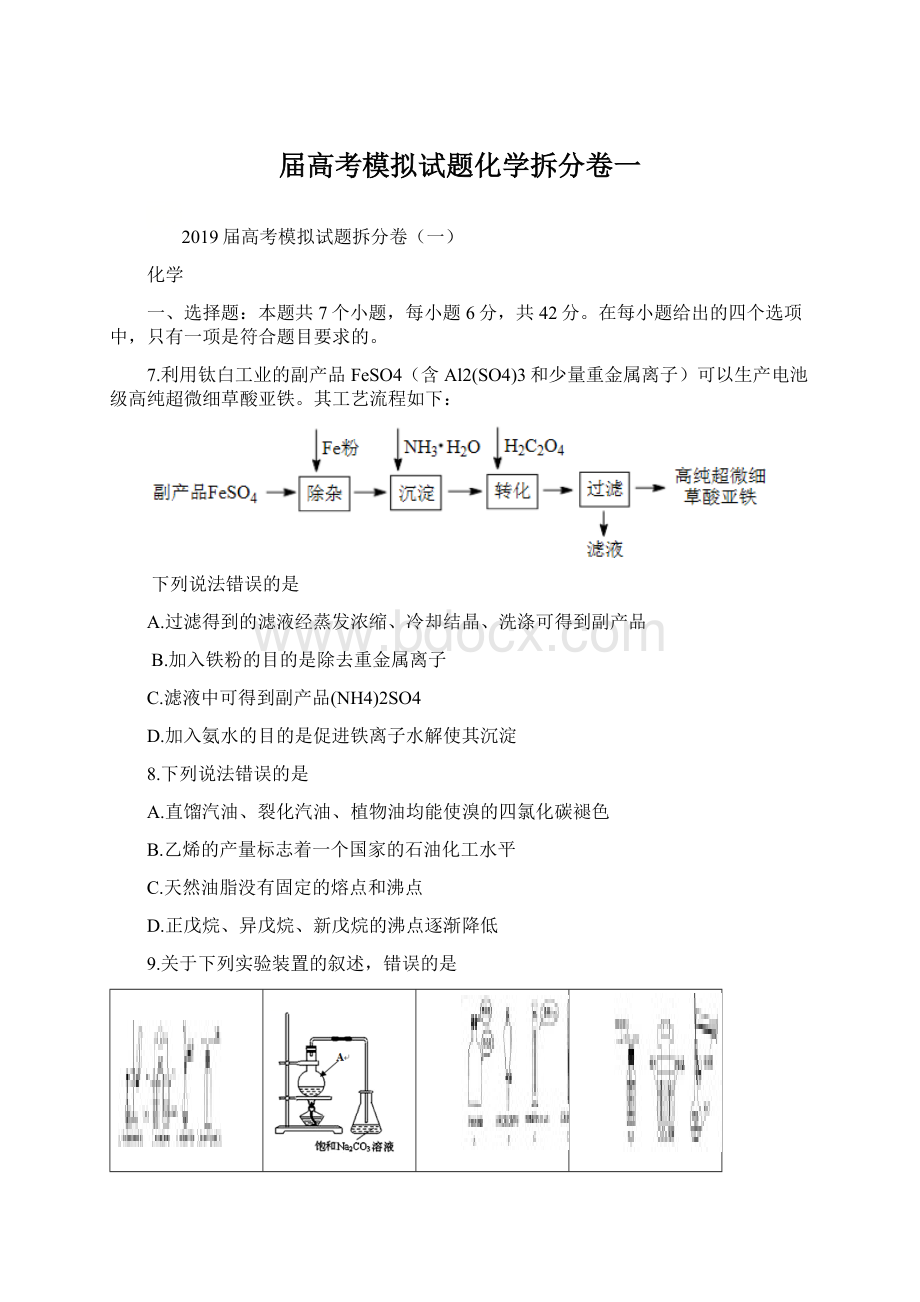
9.关于下列实验装置的叙述,错误的是
A.检验装置的气密性
B.可用此装置制备乙酸乙酯
C.分离苯和水
D.制备少量O2
10.设NA为阿伏伽德罗常数,下列说法正确的是
A.标准状况下,22.4L戊烷中碳原子数为6NA
B.16gO2和O3的混合气体中含氧原子数目为NA
C.将10ml0.1mol/L的FeCl3溶液制成Fe(OH)3胶体,胶体粒子的数目为0.001NA
D.1mol甲基含有7NA个电子
11.C9H10O2有多种同分异构体,满足含有苯环,能发生银镜反应和水解反应的同分异构
有多少种
A.12B.13C.14D.15
12.已知短周期元素W、X、Y、Z的原子序数依次增大,W的液态单质是火箭起飞的重要燃料X与Z位于同一周期,Z的氢化物和氧化物相遇就会有黄色沉淀生成,Y是地壳中金属含量最高的元素,下列说法错误的是
A.简单氢化物的沸点:
X>
Z
B.Z的氧化物可做纸张的漂白剂和食物的增白剂
C.阴离子的还原性:
W>
X
D.X的最高价氧化物对应的水化物可做阻燃剂
13.一种酸性“二甲醚(CH3OCH3)直接燃料电池”具有启动快、
能量密度高、效率好等优点,其电池原理如图所示。
下列有
关该电池的说法不正确的是
A.H+由b电极向a电极迁移
B.电极b上发生的反应为:
CH3OCH3-12e-+3H2O=2CO2+12H+
C.多孔碳a能增大气固接触面积,提高反应速率,该电极为负极
D.二甲醚直接燃料电池能量密度(
kW·
h·
kg-1)约为甲醇(CH3OH)直接燃料电池能量密度的1.4倍
二、非选择题:
共58分。
第26~29题为必考题,每个试题考生都必须作答。
第35~36题为选考题,考生根据要求作答。
(一)必考题:
43分
26.(14分)
溴化亚铜是一种白色粉末,不溶于冷水,在热水中或见光都会分解,在空气中会慢慢氧化成绿色粉末.制备CuBr的实验步骤如下:
步骤1:
在如图所示的三颈烧瓶中加入50gCuSO4•5H2O、23gNaBr、150mL煮沸过的蒸馏水,60℃时不断搅拌,以适当流速通入SO22小时。
AB
步骤2:
溶液冷却后倾去上层清液,在避光的条件下过滤。
步骤3:
依次用溶有少量SO2的水、溶有少量SO2的乙醇、纯乙醚洗涤。
步骤4:
在双层干燥器(分别装有浓硫酸和氢氧化钠)中干燥3~4h,再经氢气流干燥,最后进行真空干燥,最终得到CuBr20g。
(1)装置A的名称_____________,装置B的作用______________________。
(2)步骤1中,装置A中反应生成CuBr的离子方程式________________________。
(3)说明反应已完成的现象是__________________。
(4)步骤2过滤需避光的原因______________________。
(5)步骤3中洗涤剂需“溶有SO2”的原因是___________________,最后溶剂改用乙醚的目的是__________________。
(6)产物的产率为____________。
(保留2位小数)
27.(14分)
某化学研究性学习小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O。
已知某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。
部分阳离子以氢氧化物形式完全沉淀时的pH如下:
沉淀物
Al(OH)3
Fe(OH)3
Fe(OH)2
Ni(OH)2
pH
5.2
3.2
9.7
9.2
回答下列问题:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为。
(2)“碱浸”过程中发生的离子方程式是。
(3)“酸浸”时所加入的酸是(填化学式)。
酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是。
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是:
。
(5)“调pH为2~3”的目的是。
(6)产品晶体中有时会混有少量绿矾(FeSO4·
7H2O),其原因可能是。
28.(15分)
“温室效应”也称为“花房效应”,CO2既是温室气体,也是重要的有机合成原料。
控制适当的条件,CO2与H2反应即可合成甲醇、也可合成甲醚。
Ⅰ.制备甲醇
(1)CO2的电子式___________。
(2)工业上一般采用以下两种方式制备甲醇:
反应Ⅰ:
CO(g)+2H2(g)⇌CH3OH(g)
反应Ⅱ:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
在以上制备甲醇的两个反应中,反应Ⅰ优于反应Ⅱ的原因为______________。
(3)以甲醇为原料,电化学合成碳酸二甲酯工作原理如图所示。
写出阳极的电极反应式_______________。
Ⅱ.甲醚的应用
(4)把2molH2和1molCO通入10L的反应器中,一定条件下发生反应:
2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g)△H
其CO的平衡转化率随温度、压强变化关系如图所示。
①下列能说明该反应达到平衡状态的是_________。
a.反应体系的压强不再变化b.c(CO)/c(H2)不变
c.密度不再变化d.CH3OCH3蒸汽的体积分数不再变化
②图中压强大小为____________,△H_______0(填“>
”或“<
”),若在P3和316℃时,测得容器中n(H2)=n(CH3OCH3),则此时反应v(正)_______v(逆)(填“>
”或“=”)
(5)在P3和316℃时,反应的平衡常数________。
(二)选考题:
15分
35.[化学——选修3:
物质结构与性质](15分)
铵明矾[NH4Al(SO4)2·
12H2O]主要用于分析试剂、煤染剂、净水剂、澄清剂等。
(1)基态氮原子的核外电子排布式为__________,氮、氧元素相比,第一电离能较大的元素是________(填元素符号)。
(2)硫的氧化物有两种,SO2分子空间构型为__________,SO3分子中S原子的杂化轨道类型为_________。
(3)氮、氧的氢化物沸点一般都高于同族的其他元素,可能的原因是_____________。
(4)铝的氯化物在气态时分子结构如图所示,其分子内化学键类型为_________(填“共价键”或“离子键”),图中形成三中心四电子大π键的结构是_________(填“a”或“b”)。
(5)铝晶体晶胞结构如图所示:
晶体铝中原子的堆积方式为_________,若已知晶体的密度为ag/cm3,铝原子的半径为_________cm(设NA表示阿伏伽德罗常数,铝的摩尔质量为Mg/mol)。
36.[化学——选修5:
有机化学基础](15分)
多巴胺是一种重要的中枢神经传导物质,用来帮助细胞传送脉冲的化学物质,能影响人对事物的欢愉感受。
多巴胺可用香兰素与硝基甲烷等为原料按下列路线合成。
(1)C中的含氧官能团的名称是___________。
(2)反应①、④的反应类型分别为__________。
(3)写出由A→M的化学方程式__________________。
(4)写出同时满足下列条件的香兰素的一种同分异构体的结构简式__________。
①能与碳酸氢钠溶液反应②能与FeCl3溶液发生显色反应
③有5种不同化学环境的氢原子
(5)苯乙胺()是生物体中重要的生物碱。
写出用苯甲醇、硝基甲烷为原料制备苯乙胺的合成路线流程图(无机试剂任选)。
合成路线流程图示例如下:
参考答案
(一)
7.D8.A9.D10.B11.C12.B13.C
26.(除特殊标注外,每空2分)
(1)三颈烧瓶(1分)尾气吸收,防止SO2污染空气(1分)
(2)2Cu2++2Br-+SO2+2H2O===2CuBr↓+SO42—+4H+
(3)溶液蓝色完全褪去
(4)防止CuBr见光分解
(5)防止CuBr被氧化除去表面的乙醇,并使晶体快速干燥
(6)69.71%
27.(除特殊标注外,每空2分)
(1)漏斗、蒸发皿
(2)2Al+2OH—+2H2O=2AlO2—+3H2↑、Al2O3+2OH—=2AlO2—+3H2O
(3)H2SO4Ni2+、Fe2+
(4)3.2~~~9.2
(5)防止在浓缩结晶过程中Ni2+水解
(6)H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的
28.(除特殊标注外,每空2分)
(1):
O:
:
C:
(1分)
(2)反应Ⅰ符合“原子经济性”的原则即原子利用率为100%
(3)2CH3OH+2CO—2e-===(CH3O)2CO+2H+
(4)①acd②P1>
P2>
P3<
<
(5)2500
35.(除特殊标注外,每空2分)
(1)1s22s22p3O(1分)
(2)V型sp2
(3)存在氢键
(4)共价键b
(5)面心立方最密堆积
36.(除特殊标注外,每空2分)
(1)酚羟基(1分);
醚键(1分)
(2)加成反应;
还原反应
(3)(3分)
(4)
(5)(4分)