高考化学试题分类汇编物质结构 元素周期律Word文档下载推荐.docx
《高考化学试题分类汇编物质结构 元素周期律Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《高考化学试题分类汇编物质结构 元素周期律Word文档下载推荐.docx(21页珍藏版)》请在冰豆网上搜索。
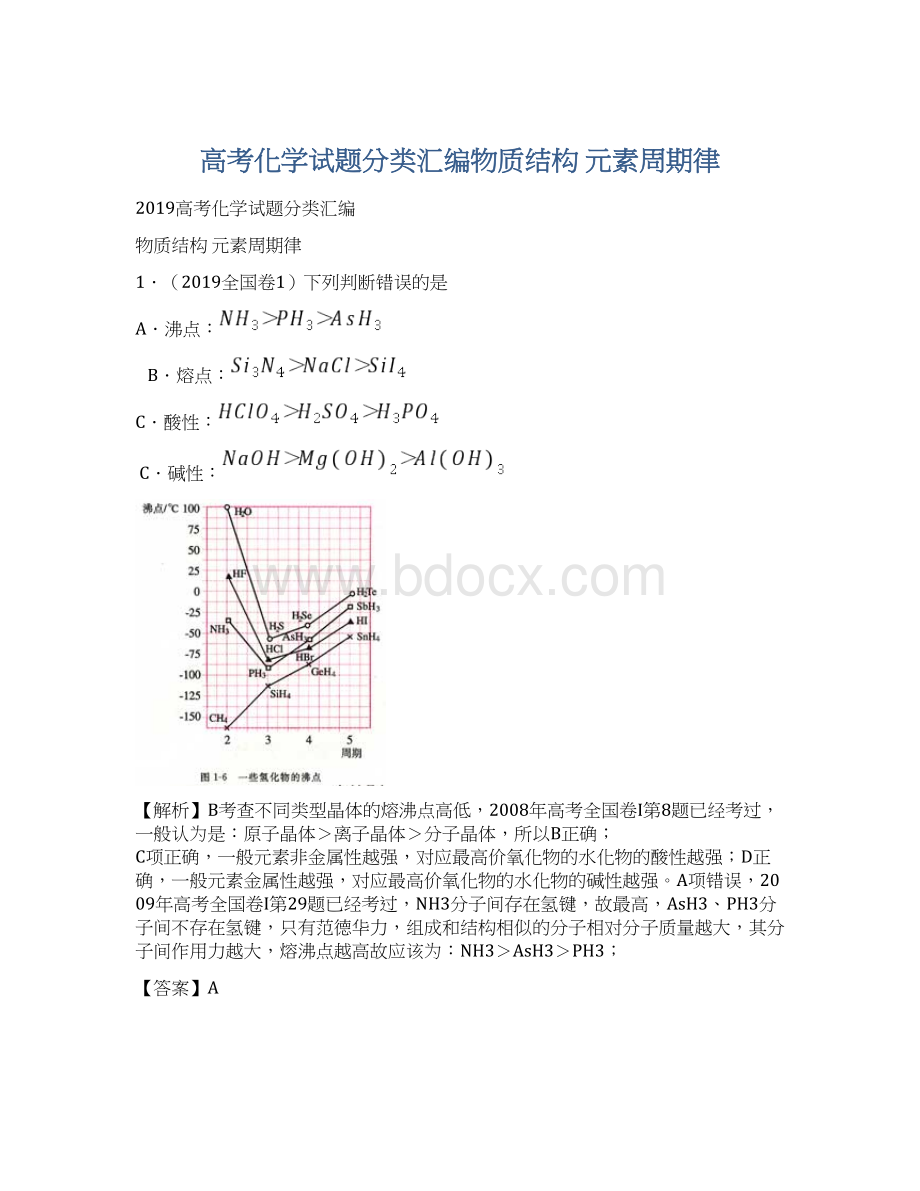
2.(2019全国卷1)13.下面关于SiO2晶体网状结构的叙述正确的是
A.存在四面体结构单元,O处于中心,Si处于4个顶角
B.最小的环上,有3个Si原子和3个O原子
C.最小的环上,Si和O原子数之比为1:
2
D.最小的环上,有6个Si原子和6个O原子
【解析】二氧化硅是原子晶体,结构为空间网状,存在硅氧四面体结构,硅处于中心,氧处于4个顶角所以A项错误;
在SiO2晶体中,每6个Si和6个O形成一个12元环(最小环),所以D对,B、C都错误!
【答案】D
【命题意图】考查学生的空间想象能力,和信息迁移能力,实际上第三册课本第一单元里面有结构图!
【点评】怎样理解SiO2的结构,可从晶体硅进行转化,晶体硅与金刚石结构相似,只需将C原子换成Si原子即可,课本上有我直接拿来用,再将Si-Si键断开,加入氧即可,见:
但是若将题目中B、B、D三个选项前面分别加上“平均每个”,则本题的答案就又变了,这时就要应用均摊法了,由于每个Si原子被12个环所共用,每个O原子被6个环所共用,每个Si-O键被6个环所共用,则均摊之后在每个环上含有0.5个Si,1个O,2个Si-O键,此时则B、D错误,C正确了,也即在1molSiO2中含有4molSi-O键(这是我们经常考的)
(2019浙江卷)8.有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;
X+与M2-具有相同的电子层结构;
离子半径:
Z2->W-;
Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。
下列说法中,正确的是
A.X、M两种元素只能形成X2M型化合物
B.由于W、Z、M元素的氢气化物相对分子质量依次减小,所以其沸点依次降低
C.元素Y、Z、W的单质晶体属于同种类型的晶体
D.元素W和M的某些单质可作为水处理中的消毒剂
试题解析:
本题为元素周期律与周期表知识题。
首先,运用周期表工具,结合周期规律,考虑位、构、性关系推断X、Y、Z、W、M分别是什么元素。
在此基础上应用知识解决题给选项的问题。
本题分析的要点或关键词是:
短周期元素、同周期、同主族、相同的电子层结构、离子半径大小、单质晶体熔点硬度、半导体材料等。
找到突破口:
Y单质晶体熔点高硬度大、半导体材料,则Y是Si。
根据X、Y、Z、W同周期,Z2-M2-知Z是S,M是O(Z、M同主族)。
X+与M2-具有相同的电子层结构则X为Na。
Z2->W-,则W为Cl。
整理一下:
X\Y\Z\W\M分别是:
Na\Si\S\Cl\O。
A、X、M两种元素能形成X2M和Na2O2两种化合物。
B、W、Z、M元素的氢气化物分别为HCl\H2S\H2O,分子量减小,但由于水中存在氢键,沸点最高。
C、Y、Z、W的单质分别为:
Si\S\O2。
分别属于原子晶体和分子晶体两种类型。
D、W和M的单质Cl2\O3可作水处理剂。
本题答案:
D
教与学提示:
本题考查元素周期表和元素周期律的知识。
涉及:
单质、化合物、晶体、氢键、物质的性质、用途、结构、原子结构等知识内容。
是单一知识内容中的多知识点综合题。
考查学生重点知识点的重点掌握情况。
要重视双基与能力的培养,重视重点化学知识的突破,重视重点化学工具的学习与应用。
元素周期表知识是统帅高中元素化合物知识的重要规律,同时要注意规律下的特例(如化学键与氢键)。
元素周期表知识也是高等化学的重要研究手段。
(2019广东理综卷)10.短周期金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是
A.原子半径:
丙<丁<戊B.金属性:
甲>丙
C.氢氧化物碱性:
丙>丁>戊D.最外层电子数:
甲>乙
解析:
同周期元素原子半径是减小的,故A错;
同主族元素金属性自上而下是增强的,故B错;
同周期的元素的金属性越来越弱,故对应碱的碱性也是减弱的,C正确;
同周期的最外层电子数越来越多,故D错。
答案:
C
(2019福建卷)8.下列有关化学研究的正确说法是
A.同时改变两个变量来研究反映速率的变化,能更快得出有关规律
B.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同
C.依据丁达尔现象可将分散系分为溶液、胶体与浊液
D.从HF、HCl、
、HI酸性递增的事
实,推出F、Cl、Br、I的非金属递增的规律
【解析】答案:
B
本题侧重考查反应速率、盖斯定律、分散系、元素周期律重要的基本概念,规律
A.同时改变两个变量来研究反应速率的变化,不容易判断影响反应速率的主导因素,因此更难得出有关规律
B.这是盖斯定律的表述
C.分散系的划分是以分散质颗粒大小来区分的
D.在以酸性强弱作为判断元素非金属性非金属性强弱依据时,是以最高价氧化物对应水化物的酸性强弱为判断依据的。
(2019上海卷)20.几种短周期元素的原子半径及主要化合价如下表:
元素代号
X
Y
Z
W
原子半径/pm
160
143
70
66
主要化合价
+2
+3
+5、+3、-3
-2
下列叙述正确的是
A.X、Y元素的金属性X<
B.一定条件下,Z单质与W的常见单质直接生成2W2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
此题考查了物质结构与元素周期律知识。
根据题给数据,X、Y的化合价不同,但原子半径相差较小,可知两者位于同一周期相邻主族,故金属性X>
Y,A错;
根据Z、W的原子半径相差不大,化合价不同,且W只有负价,则其可能是O,Z是N,两者的单质直接生成NO,B错;
据此判断可知X是Mg,Y是Al;
Y的最高价氧化物的水化物是氢氧化铝,其不溶于氨水,C错;
一定条件下,氧气可以和氨气反应生成水和氮气,D对。
知识归纳:
解答元素推断题的突破口可能是原子结构、元素在周期表中的位置、元素的性质等;
在此题中解答时,关键是抓住元素性质和元素在周期表中的位置的关系,从原子半径的变化和元素的最高正价和最低负价入手寻求突破。
(2019山东卷)11.下列说法正确的是
A.形成离子键的阴阳离子间只存在静电吸引力
B.HF、HCL、HBr、HI的热稳定性和还原性从左到右依次减弱
C.第三周期非金属元素含氧酸的酸性从左到右依次增强
D.元素周期律是元素原子核外电子排布周期性变化的结果
离子键是阴阳离子通过静电作用形成的,静电作用包括静电吸引和静电排斥,故A错;
因同驻足元素从上到下的非金属性减弱,故HF、HCL、HBr、HI的热稳定性依次减弱,但HF、HCL、HBr、HI的还原性依次增强,故B错;
根据元素的非金属性越强,其对应的最高价汉阳算得酸性越强,C错‘因为没有指明是最高价含氧酸;
元素周期律的根本原因是元素原子核外电子排布的周期性变化,D正确。
(2019江苏卷)13.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。
下列说法正确的是
A.元素A、B组成的化合物常温下一定呈气态
B.一定条件下,元素C、D的最高价氧化物对应的水化物之间能发生反应
C.工业上常用电解法制备元素C、D、E的单质
D.化合物AE与CE古有相同类型的化学键
【答案】BC
【解析】本题主要考查的原子结构与元素周期律的应用。
从题目所给条件可以看出A为N元素、B为C元素、C为Na元素、D为Al元素、E为Cl元素,A项,由C、N元素组成的化合物,在常温下,一般形成的原子晶体,呈固态;
B项,其对应的最高价氧化物对应的水化物为NaOH和Al(OH)3,能反应;
C项,对于Na、Al、Cl2的制备,在工业上都采用电解的方法;
D项,化合物AE和NCl3,为分子晶体,只有共价键,化合物CE为NaCl,是离子晶体,存在离子键。
综上分析可知,本题选C项。
(2019四川理综卷)8.下列说法正确的是
A.原子最外层电子数为2的元素一定处于周期表IIA族
B.主族元素X、Y能形成
型化合物,则X与Y的原子序数之差可能为2或5
C.氯化氢的沸点比氟化氢的沸点高
D.同主族元素形成的氧化物的晶体类型均相同
B
本题考查物质结构知识;
本题可用举例法,氦原子最外层电子数为2,为零族,A项错误;
MgCl2中原子序数之差为5,CO2中原子充数之差为2,B项正确;
由于HF中存在氢键,故HF的沸点比HCl的高,C项错误;
第IA中H2O为分子晶体,其它碱金属氧化物为离子晶体,D项错误。
(2019天津卷)7.(14分)X、Y、Z、L、M五种元素的原子序数依次增大。
X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
⑴L的元素符号为________;
M在元素周期表中的位置为________________;
五种元素的原子半径从大到小的顺序是____________________(用元素符号表示)。
⑵Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为___,B的结构式为____________。
⑶硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为_______。
该族2~5周期元素单质分别与H2反应生成lmol气态氢化物的反应热如下,表示生成1mol硒化氢反应热的是__________(填字母代号)。
a.+99.7mol·
L-1b.+29.7mol·
L-1c.-20.6mol·
L-1d.-241.8kJ·
mol-1
⑷用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q。
写出阳极生成R的电极反应式:
______________;
由R生成Q的化学方程式:
_______________________________________________。
(1)X、Y、Z、L是组成蛋白质的四种元素且原子序数依次增大,故分别为:
H、C、N、O元素;
M是地壳中含量最高的元素,为Al,其在周期表的位置为第3周第ⅢA族;
再根据五种元素在周期表的位置,可知半径由大到小的顺序是:
Al>C>N>O>H。
(2)N和H1:
3构成的分子为NH3,电子式为
;
2:
4构成的分子为N2H4,其结构式为
。
(3)Se比O多两个电子层,共4个电子层,1→4电子层上的电子数分别为:
2、8、18、6,故其原子