学业水平测试复习纲要必修1Word格式文档下载.docx
《学业水平测试复习纲要必修1Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《学业水平测试复习纲要必修1Word格式文档下载.docx(20页珍藏版)》请在冰豆网上搜索。
9.托盘天平精确到0.1g,量筒精确到0.1mL。
10.可直接加热的仪器:
试管﹑蒸发皿、坩埚。
烧杯、烧瓶、锥形瓶需垫石棉网。
量筒、容量瓶等不可加热。
11.点燃可燃气体前要验纯。
记得化学危险品常用标志。
见书P4页。
12.酒精着火应迅速用湿抹布盖灭,钠、钾着火用细沙盖灭。
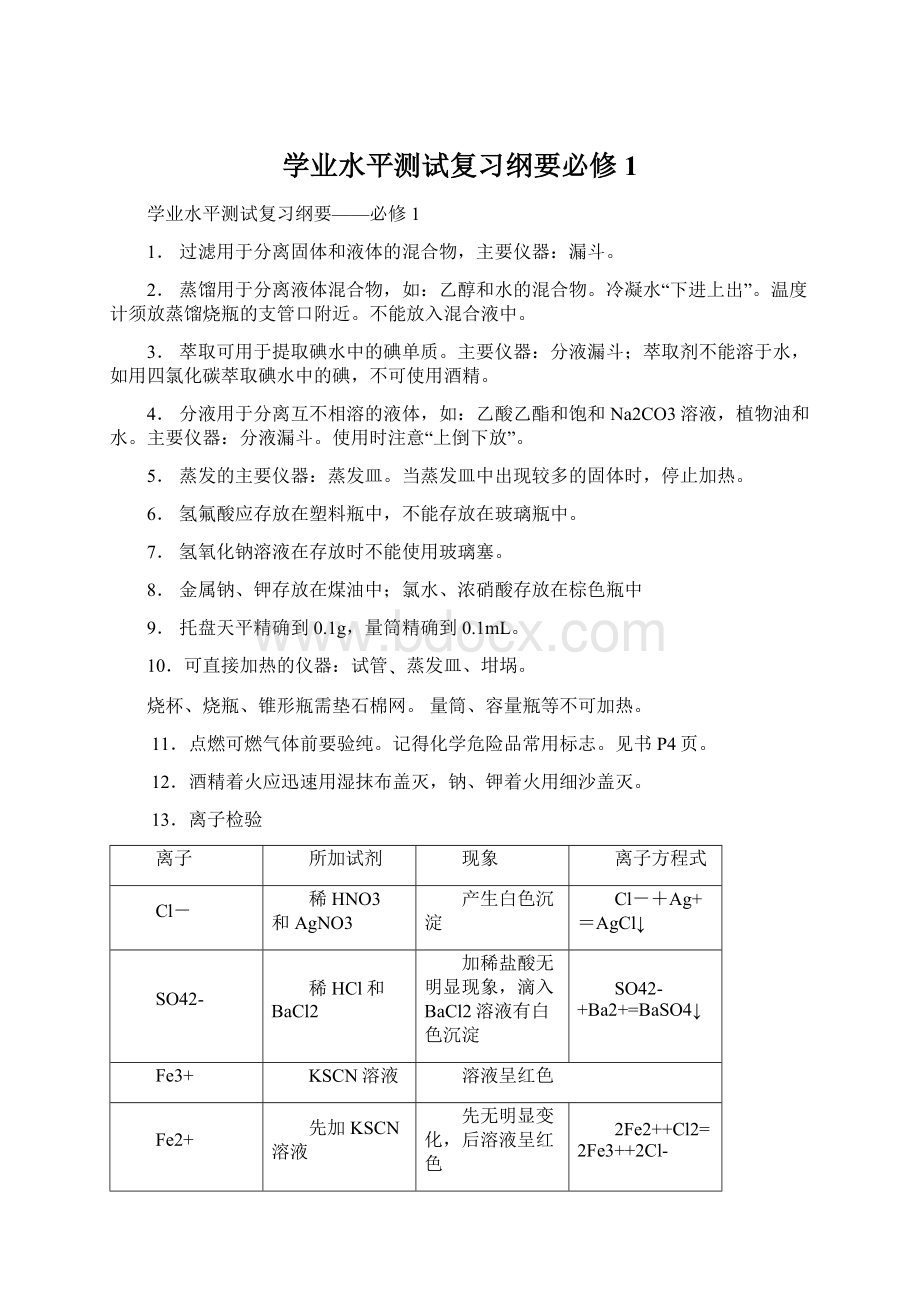
13.离子检验
离子
所加试剂
现象
离子方程式
Cl-
稀HNO3和AgNO3
产生白色沉淀
Cl-+Ag+=AgCl↓
SO42-
稀HCl和BaCl2
加稀盐酸无明显现象,滴入BaCl2溶液有白色沉淀
SO42-+Ba2+=BaSO4↓
Fe3+
KSCN溶液
溶液呈红色
Fe2+
先加KSCN溶液
再加氯水
先无明显变化,后溶液呈红色
2Fe2++Cl2=2Fe3++2Cl-
NH4+
NaOH溶液,加热
湿润红色石蕊试纸
试纸变蓝
NH4++OH-NH3↑+H2O
Na+
焰色反应
火焰呈黄色
K+
透过蓝色钴玻璃,火焰呈紫色
CO32-
稀盐酸、澄清石灰水
产生能使石灰水变浑浊的无色无味气体
CO32-+2H+=H2O+CO2↑
CO2+Ca(OH)2=CaCO3↓+H2O
14.摩尔(mol)是物质的量(n)的单位
15.摩尔质量(M)的单位g/mol或g.mol-1
摩尔质量的数值:
等于该粒子的相对原子质量或相对分子质量.
16.Vm=22.4mol/L的使用条件:
①标准状况下(0℃101KPa);
②气体。
17.阿伏加德罗定律:
在相同的温度和压强下,相同体积的任何气体含有相同数目的分子。
(即物质的量相同。
)
18.n=c为物质的量浓度,单位为mol/L
19.c(浓溶液)·
V(浓溶液)=c(稀溶液)·
V(稀溶液)
20.配制一定物质的量浓度溶液必需的仪器:
XXmL容量瓶、烧杯、玻璃棒、胶头滴管。
步骤:
①计算;
②称量;
③溶解、冷却;
④转移;
⑤洗涤;
⑥定容;
⑦摇匀;
⑧装瓶贴标签。
21.常见的有机物有:
甲烷、乙烯、苯、乙醇、乙酸、糖类、油脂、蛋白质等。
22.常见的混合物有煤,石油,漂白粉,硬铝、黄铜、钢等合金,氯水,氨水等溶液,胶体。
23.液氯、液氨、冰醋酸属于纯净物。
24.分散质粒子的直径大小在1nm~100nm之间的分散系称做“胶体”。
胶体的稳定性介于溶液和浊液之间属于介稳体系。
鉴别溶液和胶体的方法:
丁达尔效应
25.常见的电解质有:
酸、碱、盐等,其在水溶液中能发生电离。
26.常见的18种离子:
H+、Na+、K+、Ag+、Ca2+、Mg2+、Zn2+、Ba2+、Fe2+、Fe3+、Cu2+、Al3+、Cl-、NH4+、NO3-、SO42-、CO32-、OH-
27.电离方程式如H2SO4=2H++SO42-、Ba(OH)2=Ba2++2OH-、Na2CO3=2Na++CO32-
28.在离子反应中可以拆开的物质:
强酸(HCl、H2SO4、HNO3)、强碱[KOH、NaOH、Ba(OH)2、Ca(OH)2]、可溶性盐(钾盐、钠盐、铵盐、硝酸盐、除AgCl外的氯化物,除BaSO4外的硫酸盐。
29.离子方程式典型错误:
①电荷不守恒,如:
Fe+Fe3+=2Fe2+、
②拆分错误,如:
碳酸钙与稀盐酸反应不能写成:
CO32-+2H+=CO2↑+H2O,
应写成:
CaCO3+2H+=Ca2++CO2↑+H2O
3化学原理错误,如:
Fe和HCl反应不能写成2Fe+6H+=2Fe3++3H2↑,
应写成Fe+2H+=Fe2++H2↑;
H2SO4与Ba(OH)2溶液反应不能写成H++OH-+SO42-+Ba2+=BaSO4↓+H2O,
应写成2H++2OH-+SO42-+Ba2+=BaSO4↓+2H2O
30.不能与H+共存的离子有:
OH-、CO32-、HCO3—
31.不能与OH—共存的离子有:
除K+、Na+、Ba2+、Ca2+以外的所有阳离子、HCO3—
32.不能与CO32-共存的离子有:
除K+、Na+、NH4+以外的所有阳离子
33.Cl—不能与Ag+共存,SO42-不能与Ba2+共存
34.有色离子有:
Cu2+(蓝色)、Fe3+(黄色)、Fe2+(浅绿色)、MnO4—(紫色)
35.根据反应物和生成物的类别以及反应前后物质种类的多少可以分为:
①化合反应(A+B=AB)②分解反应(AB=A+B)
③置换反应(A+BC=AC+B)④复分解反应(AB+CD=AD+CB)
36.反应前后元素化合价发生变化的反应是氧化还原反应。
一般而言,反应物或生成物中有单质的一定是氧化还原反应。
氧化还原反应的本质是有电子的转移。
37.升失氧作还原剂:
化合价升高,失去电子,被氧化,反应物是还原剂,具有还原性。
38.日常生活中常见的氧化还原反应
①用Cl2、ClO2进行的消毒、杀毒;
②燃料的燃烧、提供热能等;
③食品的腐败;
④化学电源的开发及利用;
⑤电镀及防止金属的腐蚀;
金属的腐蚀。
39.钠是质软(用小刀可以切割)、密度比水小、熔点低、银白色有金属光泽
40.钠和氧气反应:
钠切割后的表面呈银白色金属光泽接触到空气后很快变暗4Na+O2==2Na2O
点燃后钠在空气中剧烈燃烧产生黄色火焰,生成淡黄色固体:
Na+O2Na2O2
钠和水的反应:
将一小块钠投入滴有酚酞的水中,产生的现象:
钠浮在水面上,
熔化成小球且逐步变小,在水面上不断游动,发生“嘶嘶”的响声,溶液变红色。
2Na+2H2O==2NaOH+H2↑(2Na+2H2O==2Na++2OH-+H2↑)
40.过氧化钠为淡黄色固体,可作供氧剂。
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2CO2=2Na2CO3+O2
41.碳酸钠与碳酸氢钠的比较
42.除杂Na2CO3(NaHCO3)方法:
加热
43.除杂NaHCO3(Na2CO3)方法:
通CO2
44.铝在空气中却能稳定存在是因为铝表面覆盖有致密氧化膜,保护内层金属不被腐蚀。
地壳中元素含量前四位为氧、硅、铝、铁。
45.既能与HCl反应又能与NaOH反应的物质有:
Al、Al2O3、Al(OH)3、NaHCO3
(1)2Al+6H+==2Al3++3H2↑2Al+2NaOH+2H2O==2NaAlO2+3H2↑
(2)Al2O3+6H+===2Al3++3H2OAl2O3+2OH-===2AlO2-+H2O
(3)Al(OH)3+3H+=Al3++3H2OAl(OH)3+OH-=AlO2-+2H2O
46.常温下,铝、铁遇浓硫酸、浓硝酸发生钝化。
47.Al(OH)3的制备:
AlCl3溶液中滴加氨水至过量
48.Al(OH)3不能溶于氨水中。
2Al(OH)3Al2O3+3H2O
49.除杂Fe2O3(Al2O3)试剂:
NaOH
50.Fe2O3红棕色固体,俗称铁红;
FeO黑色粉末;
Fe3O4黑色晶体,俗称磁性氧化铁。
Fe(OH)3红褐色沉淀;
Fe(OH)2为白色沉淀,在空气中极易被氧化成红褐色Fe(OH)3沉淀4Fe(OH)2+O2+2H2O==4Fe(OH)3
51.除杂FeCl2(FeCl3)方法:
加铁粉2FeCl3+Fe==3FeCl2(2Fe3++Fe==3Fe2+)
52.除杂FeCl3(FeCl2)方法:
通氯气或加氯水2FeCl2+Cl2==2FeCl3
离子方程式为:
(2Fe2++Cl2==2Fe3++2Cl-)
53.铁能在氧气中燃烧生成Fe3O4。
能与酸、水蒸气、硫酸铜、氯气等物质反应。
铁与稀盐酸、稀硫酸、硫酸铜等物质发生反应均生成亚铁盐。
Fe+2H+==Fe2++H2↑3Fe+4H2O(g)=Fe3O4+4H2Fe+Cu2+==Fe2++Cu
54.铜为红色固体。
铜能与氧气反应生成黑色的氧化铜。
氢氧化铜为蓝色沉淀。
无水硫酸铜固体为白色。
CuSO4.5H2O为蓝色,俗称胆矾或蓝矾。
可用无水硫酸铜检验水的存在。
55.合金:
两种或两种以上的金属(或金属与非金属)熔合在一起而形成的具有金属特性的物质。
合金的特点;
硬度一般比成分金属大而熔点比成分金属低,用途比纯金属要广泛。
56.单质硅是半导体材料,可用于制硅芯片、太阳能电池板等,光导纤维的主要成分是SiO2。
57.二氧化硅的化学性质不活泼,不与水反应。
氢氧酸(HF)是惟一可以与它发生反应的酸:
SiO2+4HF====SiF4↑+2H2O,玻璃中含有SiO2可以用HF来刻蚀玻璃。
二氧化硅是酸性氧化物,能与碱性氧化物或强碱反应生成盐:
SiO2+CaOCaSiO3SiO2+2NaOH===Na2SiO3+H2O
所以实验室盛装NaOH溶液等碱液的试剂瓶用橡皮塞,而不用玻璃塞(玻璃塞中含有SiO2)。
离子方程式为(SiO2+2OH-===SiO32-+H2O)
58.硅酸是一种溶解度很小的弱酸为白色沉淀,只能通过可溶性硅酸盐与酸反应制取:
Na2SiO3+2HCl===H2SiO3↓+2NaCl
59.硅酸钠(Na2SiO3)是最简单的硅酸盐,其水溶液叫水玻璃,是制取硅胶和木材防火剂等的原料。
传统的硅酸盐材料包括陶瓷、玻璃、水泥等。
60.氯气:
黄绿色气体,有刺激性气味,密度大于空气,有毒。
能溶于水。
61.Fe在Cl2中燃烧只能生成FeCl3,不能生成FeCl2。
62.氢气在氯气中燃烧发出苍白色的火焰。
63.氯气溶于水生成盐酸HCl和次氯酸HClO。
Cl2+H2O===HCl+HClO
64.氯气溶于水后具有强氧化性,可用于消毒、杀菌、漂白。
Cl2+H2O===H++Cl-+HClO起漂白作用的是HClO,不是氯气。
65.氯气可使品红溶液褪色,且红色不可恢复。
66.多余的氯气用NaOH溶液吸收Cl2+2NaOH=NaCl+NaClO+H2O
漂白粉的有效成分:
Ca(ClO)22Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O
67.硫(俗称硫黄)是一种黄色晶体,不溶于水,微溶于酒精,易溶二硫化碳。
68.二氧化硫:
无色、有刺激性气味的气体,易溶于水,有毒。
密度比空气大。
69.SO2可使品红溶液褪色,但加热后红色可以恢复。
因为
SO2+H2OH2SO3,所以二氧化硫能使紫色石蕊试液变红。
70.二氧化硫可被氧化成三氧化硫:
2SO2+O22SO3
71.SO3:
三氧化硫是一种酸性氧化物,表现的主要性质有:
SO3+H2O===H2SO4SO3+CaO===CaSO4SO3+Ca(OH)2===CaSO4+H2O
72.硫酸是一种强酸:
H2SO4===2H++SO42-具有酸的通性。
浓硫酸具有一些特性:
吸水性,脱水性和强氧化性。
Cu+