初三化学酸碱盐知识点(最全整理版)Word文档格式.doc
《初三化学酸碱盐知识点(最全整理版)Word文档格式.doc》由会员分享,可在线阅读,更多相关《初三化学酸碱盐知识点(最全整理版)Word文档格式.doc(10页珍藏版)》请在冰豆网上搜索。
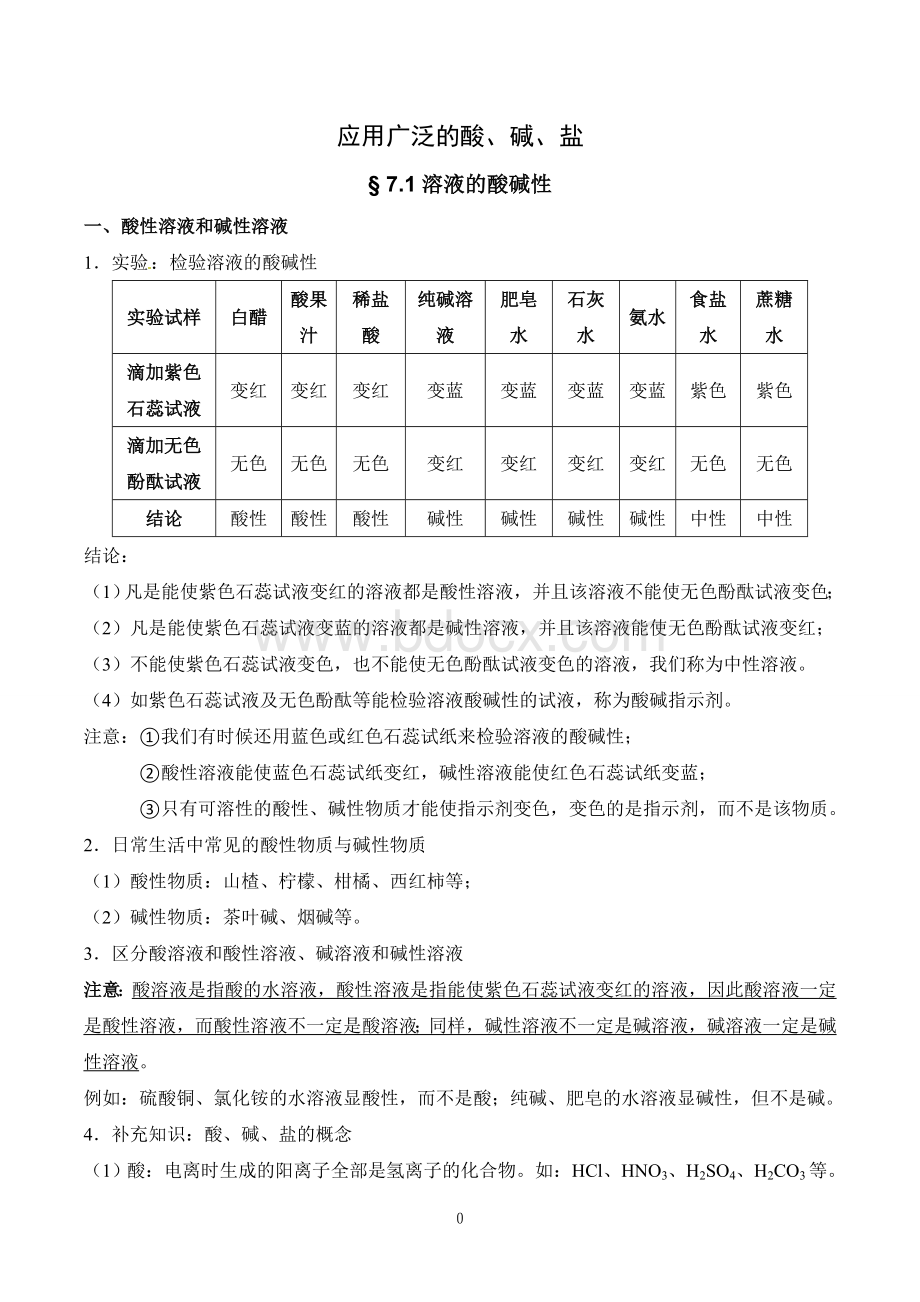
中性
结论:
(1)凡是能使紫色石蕊试液变红的溶液都是酸性溶液,并且该溶液不能使无色酚酞试液变色;
(2)凡是能使紫色石蕊试液变蓝的溶液都是碱性溶液,并且该溶液能使无色酚酞试液变红;
(3)不能使紫色石蕊试液变色,也不能使无色酚酞试液变色的溶液,我们称为中性溶液。
(4)如紫色石蕊试液及无色酚酞等能检验溶液酸碱性的试液,称为酸碱指示剂。
注意:
①我们有时候还用蓝色或红色石蕊试纸来检验溶液的酸碱性;
②酸性溶液能使蓝色石蕊试纸变红,碱性溶液能使红色石蕊试纸变蓝;
③只有可溶性的酸性、碱性物质才能使指示剂变色,变色的是指示剂,而不是该物质。
2.日常生活中常见的酸性物质与碱性物质
(1)酸性物质:
山楂、柠檬、柑橘、西红柿等;
(2)碱性物质:
茶叶碱、烟碱等。
3.区分酸溶液和酸性溶液、碱溶液和碱性溶液
酸溶液是指酸的水溶液,酸性溶液是指能使紫色石蕊试液变红的溶液,因此酸溶液一定是酸性溶液,而酸性溶液不一定是酸溶液;
同样,碱性溶液不一定是碱溶液,碱溶液一定是碱性溶液。
例如:
硫酸铜、氯化铵的水溶液显酸性,而不是酸;
纯碱、肥皂的水溶液显碱性,但不是碱。
4.补充知识:
酸、碱、盐的概念
(1)酸:
电离时生成的阳离子全部是氢离子的化合物。
如:
HCl、HNO3、H2SO4、H2CO3等。
HCl==H++Cl-;
H2SO4==2H++SO42-;
(2)碱:
电离时生成的阴离子全部是氢氧根离子的化合物。
NaOH、Ca(OH)2等。
NaOH==Na++OH-;
Ca(OH)2==Ca2++2OH-;
(3)盐:
电离时生成金属离子(或铵根离子)和酸根离子的化合物。
NaCl、NH4NO3等。
NaCl==Na++Cl-;
NH4NO3==NH4++NO3-;
二、溶液的酸碱性的强弱
1.酸碱度:
用来表示溶液的酸性或碱性的强弱程度。
2.pH试纸用来定量的测定溶液的酸碱度。
pH值1234567891011121314
|
酸性增强中性碱性增强
溶液的pH值与酸碱性关系:
pH=7,溶液呈中性;
pH<
7,溶液呈酸性,且pH越小,酸性越强;
pH>
7,溶液呈碱性,且
pH越大,碱性越强。
3.pH试纸的使用方法:
用胶头滴管(或玻璃棒)把待测试液滴(或涂)在pH试纸上,然后把试纸显示的颜色(半分钟内)与标准比色卡对照,标准比色卡上相同颜色的pH即为该溶液的pH。
(1)不能直接把pH试纸浸入待测溶液中,以免带入杂质,同时这种操作可能泡掉pH试纸上
一部分指示剂,以致比色发生较大的误差;
(2)不能先用水将pH试纸润湿,再进行测试,因为水润湿后的pH试纸将测定的是稀释后溶
液的pH。
(3)我们实验室一样使用的pH试纸是广泛pH试纸,测出的pH值是1~14的整数。
(4)为了比较精确的测定溶液的pH,我们可以用精密pH试纸和酸度计(又称pH计)来测量。
三、溶液酸碱性与生命活动的关系
1.人的体液有一定的酸碱度。
血液、组织间液和细胞内液的酸碱度都接近于中性,而且变化极小;
2.胃液的pH在0.9~1.5之间,在这样的环境中铁屑都可被溶解,但胃本身却能安然无恙。
因为胃里有一层“粘液屏障”,它是由粘液细胞和上皮细胞分泌出的一种胶冻状粘液,在胃粘膜表面构成一个保护膜,用来保护胃,防止胃酸对其本身的腐蚀及胃蛋白酶对胃本身的消化,还能防止粗糙的食物对胃的机械性损伤。
3.大多数的农作物适宜在接近中性(pH在6.5~7.5之间)的土壤中生长,在改良酸性土壤时,我们一般是使用熟石灰来调节其酸碱度。
4.雨水一般呈略酸性(由于空气中的二氧化碳溶解在雨水中),人们一般把pH小于5.6的雨水称为酸雨。
7.2常见的酸和碱
一、常见的酸
1.生活中常用的酸:
胃液中含有的盐酸(HCl),蓄电池中含有硫酸(H2SO4),酸雨中含有的硫酸及硝酸(HNO3),食醋中含有的醋酸(CH3COOH或HAc);
饮料中可能含有的碳酸、柠檬酸等。
2.酸的分类:
无氧酸(如HCl)、含氧酸(HNO3、H2SO4)等。
3.浓硫酸、浓盐酸和浓硝酸的物理性质
浓硫酸
浓盐酸
浓硝酸
溶质的化学式
H2SO4
HCl
HNO3
颜色
状态
粘稠、油状液体
液体
气味
无味
刺激性气味
浓度
98%
36%~37%
70%
密度(与水比较)
1.84g/mL
1.17g/mL
1.42g/mL
敞开试剂瓶口发生的现象
无明显现象
产生白雾
是否具有挥发性
不易挥发
有挥发性
与水混合
放出大量的热
无明显放热
露置在空气中后的溶液质量
变大
变小
露置在空气中后的溶质质量
不变
露置在空气中后的溶剂质量
露置在空气中后的质量分数
浓硫酸具有一定的特性:
(1)吸水性(物理性质)用于气体干燥,但除NH3等碱性气体除外[2NH3+H2SO4==(NH4)2SO4]
(2)脱水性(化学性质)——黑面包实验(浓硫酸与蔗糖反应,使之炭化。
)
(3)强氧化性,腐蚀性——与金属发生反应,生成的气体不生成氢气而是二氧化硫。
在加热的条件下,能与排在氢后面的金属(如Cu)反应,如:
Cu+2H2SO4(浓)△==CuSO4+SO2↑+H2O
又如,冷的浓硫酸与铁或铝反应后,能生成一层致密的氧化膜,阻止反应进一步进行。
(4)浓硫酸的稀释:
酸入水,沿器壁,不断搅拌。
浓硫酸溶于水放出大量的水,足以使水分沸腾,并且水的密度小于浓硫酸的密度。
如果把水倒入浓硫酸中,水就会浮在浓硫酸上面,溶解时放出大量的热,致使水沸腾而使硫酸液滴向四周飞溅而造成事故。
(5)安全事故的处理:
浓硫酸溅到皮肤上后,首先迅速用抹布将其擦拭,然后用大量水冲洗,最后用3%~5%的NaHCO3涂敷。
稀硫酸溅到皮肤上后,应该马上冲洗,因为随着稀硫酸中溶剂的蒸发,也会变成浓硫酸。
4.酸的化学性质
(1)实验:
稀硫酸、稀盐酸、稀硝酸化学性质的比较
实验内容
现象与结论
稀硫酸
稀硝酸
将镁条、锌粒、铜片分别放入酸溶液中
镁条、锌粒表面出现大量气泡,并且放镁条的试管底部明显发烫。
铜片表面没有明显变化。
现象与稀硫酸相似
硝酸(包括浓硝酸和稀硝酸)与金属反应都不能产生氢气,因为其都具有强氧化性。
酸溶液分别于生锈的铁钉反应
铁锈逐渐消失,溶液逐渐变黄。
过量的酸与铁钉反应,可能会有大量的气泡
酸溶液与石灰石
作用
石灰石表面有大量的气泡,一会儿就马上停止
石灰石表面有大量的气泡冒出
现象同稀盐酸相似
总结:
酸所具有的共同特点:
酸在水溶液中都能电离出氢离子,因此酸溶液会具有许多共同的性质(酸的五大通性):
(1)酸溶液与酸碱指示剂的反应
A.紫色石蕊试液或蓝色石蕊试纸遇到酸溶液变红色;
B.无色酚酞试剂遇到酸溶液不变色。
提醒:
紫色石蕊试剂变色情况为:
“酸红碱蓝”;
是指示剂变色,而非待测溶液本身变色。
(2)酸溶液与某些金属反应
酸溶液+(氢前)金属→盐溶液+氢气
A.在金属活动性顺序表中,排在氢前面的金属能置换出酸中的氢,排在氢后面的金属则不能;
B.排在金属活动性顺序表越前面的金属,反应现象越剧烈,速度越快,如Mg反应有明显放
热现象;
C.强氧化性酸与金属反应后,不能生成氢气,而是生成水。
如浓硫酸、硝酸等强氧化性酸;
D.该类反应属于置换反应
Zn+2HCl==ZnCl2+H2↑;
Fe+H2SO4==FeSO4+H2↑
(3)酸溶液与某些金属氧化物反应(金属氧化物又称碱性氧化物)
酸溶液+金属氧化物→盐溶液+水
该反应过程中,金属元素的化合价不变,酸中的原子团不变
如:
CuO+2HCl==CuCl2+H2O;
Fe2O3+3H2SO4==Fe2(SO4)3+3H2O
ZnO+2HNO3==Zn(NO3)2+H2O
酸性氧化物
碱性氧化物
定义
凡能与碱反应生成盐和水的氧化物大多数非金属氧化物是酸性氧化物大多数酸性氧化物是非金属氧化物。
凡能与酸反应生成盐和水的氧化物大多数金属氧化物是碱性氧化物所有碱性氧化物是金属氧化物。
化学性质
大多数可与水反应生成酸:
CO2+H2O==H2CO3
SO2+H2O==H2SO3
SO3+H2O==H2SO4
少数可与水反应生成碱:
Na2O+H2O==2NaOH
K2O+H2O==2KOH
BaO+H2O==Ba(OH)2
CaO+H2O==Ca(OH)2
酸性氧化物+碱→盐+水CO2+Ca(OH)2==CaCO3↓+H2O
(不是复分解反应)
碱性氧化物+酸→盐+水Fe2O3+6HCl==2FeCl3+3H2O
(是复分解反应)
(4)酸溶液与碱的反应(又称为中和反应)
酸+碱→盐+水
(5)酸溶液与某些盐反应
酸溶液+盐→新酸+新盐
A.我们通常遇到的盐是碳酸盐,因此绝大部分反应是:
酸+碳酸盐→新盐+水+二氧化碳
如:
CaCO3+2HCl==CaCl2+H2O+CO2↑;
Na2CO3+H2SO4==Na2SO4+H2O+CO2↑;
K2CO3+2HNO3==2KNO3+H2O+CO2↑;
MgCO3+CH3COOH==(CH3COO)2Mg+H2O+CO2↑;
B.某些特殊的盐能与酸反应,生成特殊的沉淀
HCl+AgNO3==AgCl↓+HNO3;
BaCl2+H2SO4==BaSO4↓+2HCl
补充:
Cl-及SO42-的检验
A.向待测溶液中加入AgNO3溶液后有白色沉淀生成,滴入稀硝酸溶液后,沉淀不消失,则溶液中含有Cl-,如果没有沉淀或者沉淀消失,则不含有Cl-。
B.向待测溶液中加入Ba(NO3)2溶液后有白色沉淀生成,滴入稀硝酸溶液后,沉淀不消失,则溶液中含有SO42-,如果没有沉淀或者沉淀消失,则不含有SO42-。
二.常见的碱
实验现象
氢氧化钠、氢氧化钙、氨水
物理性质的比较
名称
氢氧化钠
氢氧化钙
化学式
NaOH
Ca(OH)2
NH3•H2O
白色
片状固体
粉末状固体
有氨臭气味