高二化学选修4溶液pH的计算PPT文档格式.ppt
《高二化学选修4溶液pH的计算PPT文档格式.ppt》由会员分享,可在线阅读,更多相关《高二化学选修4溶液pH的计算PPT文档格式.ppt(45页珍藏版)》请在冰豆网上搜索。
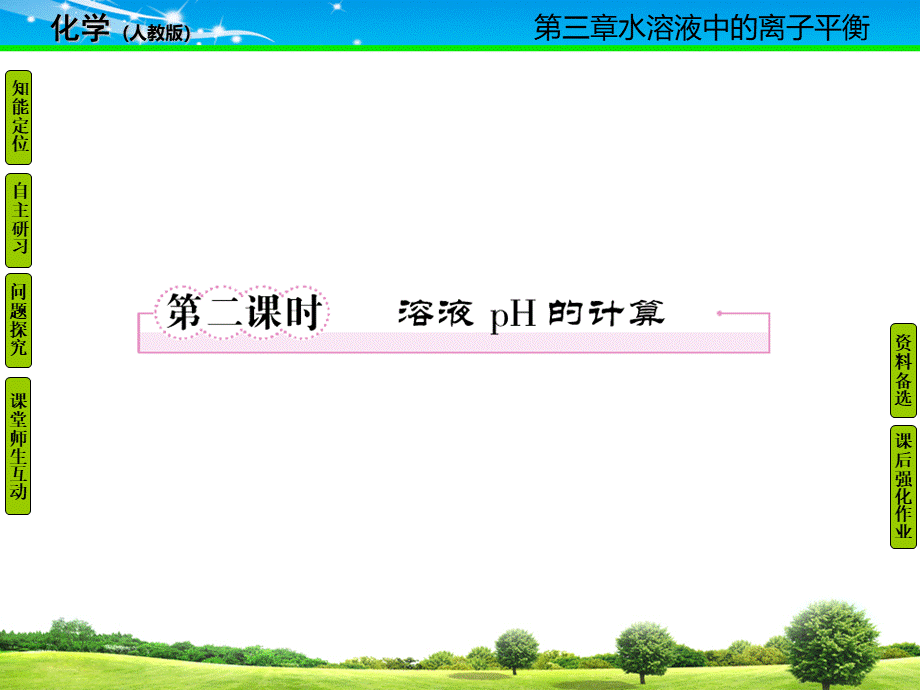
如一元弱碱BOH,设浓度为cmol/L,则c(OH)cmol/L,c(H)mol/L,pH14lgc答案:
一、1.lgc(H)c(H)2
(1)ncmol/Llg(nc)
(2)ncmol/Lmol/L14lg(nc),1等物质的量浓度的盐酸和醋酸相比哪个pH大?
等物质的量浓度的NaOH溶液与氨水哪个pH大?
提示:
比较pH大小最终要比较c(H)大小,等物质的量浓度的盐酸比醋酸中c(H)大,pH小,等物质的量浓度的NaOH溶液比氨水中c(H)小,pH大。
2进行pH计算时,为什么遇酸必须用c(H)、而遇碱必须用c(OH)计算?
提示:
由于水的电离平衡的存在,酸溶液中仍有少量OH,碱溶液中仍有少量H,但酸溶液中起决定作用的是H,计算pH时当然用c(H)计算;
同样碱溶液中起决定作用的是OH,而c(H)的大小受c(OH)大小的制约,因此在碱溶液稀释或混合的计算中,必须根据c(OH)的变化来计算。
如pH10的NaOH溶液加水稀释10倍后pH的计算,如直接根据c(H)计算,会得出pH11,这当然是不可能的。
计算步骤应是pH10的NaOH溶液,c(H)1010molL1,则c(OH)104molL1,稀释10倍后,c(OH)105molL1,则c(H)molL1109molL1,即稀释10倍后pH9。
(1)两种强酸混合:
c(H)混当两种溶液的pH之差pH2的强酸以等体积混合时,pH混pH小0.3(相当于将浓度大的酸溶液稀释了一倍)。
(2)两种强碱溶液混合:
c(OH)混当两种溶液的pH之差pH2的强碱以等体积混合后,pH混pH大0.3(相当于将浓度大的碱溶液稀释了一倍)。
(3)强酸强碱混合强酸和强碱恰好完全反应,溶液呈中性,pH7。
酸过量,先求c(H)余。
c(H)余,再求pHlgc(H)。
碱过量,先求c(OH)余。
c(OH)余,再求c(H),最后求pH。
(4)酸碱等体积混合酸与碱pH之和为14,若为强酸与强碱,则pH7;
若为强酸与弱碱,则pH7;
若为弱酸与强碱,则pH7。
说明:
对于弱酸来讲,c(弱酸)c(H),对于弱碱,c(弱碱)c(OH),等体积混合pH之和为14的酸碱时,谁弱谁过量。
(5)强酸强碱混合呈中性时二者体积与pH的变化规律若pH酸pH碱14,则V酸V碱11若pH酸pH碱14,则V酸V碱10pH酸pH碱141若pH酸pH碱14,则V酸V碱11014(pH酸pH碱),(6)强酸、强碱稀溶液等体积混合后的pH(近似计算),案例精析【例1】25时,某溶液由水电离出的c(H)11012mol/L,则该溶液的pH可能为()A12B7C6D2,解析纯水中由水电离出的c(H)水c(OH)水,向纯水中加酸或加碱,水的电离都会受到抑制,水的电离平衡向左移动,水电离出的c(H)和c(OH)均减小,但仍有c(H)水c(OH)水。
若该溶液为酸性溶液,c(OH)液c(OH)水c(H)水11012mol/L,由KWc(H)液c(OH)液得c(H)液11014/110121102,即pH2;
若该溶液为碱性溶液,c(H)液c(H)水11012mol/L,pH12,故正确答案为AD。
答案AD,【例2】pH13的强碱溶液与pH2的强酸溶液混合,所得混合溶液的pH11,则强碱与强酸的体积比是()A111B91C111D19,解析本题酸、碱反应后pH11,说明碱过量,必须按c(OH)进行计算。
如果忽略了这一点而用c(H)计算,那就会出现错误。
强酸与强碱混合后,余下的溶液显碱性,且c(OH)103mol/L,因此,若设强碱、强酸的体积分别为x、y,则由题意得:
103,xy19。
故正确答案为D。
答案D,室温下等体积混合0.1molL1的盐酸和0.06molL1的Ba(OH)2溶液后,溶液的pH等于()A2.0B12.3C1.7D12.0,解析该题是酸碱混合的计算。
首先要判断哪种物质过量,盐酸溶液的c(H)0.1molL1,Ba(OH)2溶液的c(OH)0.06molL120.12molL1,故碱过量,又因等体积混合,可求出混合溶液中的c(OH)。
c(OH)0.01molL1故pHlgc(H)14lg0.0112。
答案D,有pH12的KOH溶液10mL,要使它的pH降为11:
(1)如果加入蒸馏水,应加_mL。
(2)若加入pH10的NaOH溶液应加_mL。
(3)若加入0.001molL1H2SO4应加_mL。
答案
(1)90
(2)100(3)30,在25时,有pHa的盐酸和pHb的NaOH溶液,取VaL盐酸溶液与NaOH溶液中和,需VbLNaOH溶液,问:
(1)若ab14,则Va/Vb_(填数字)。
(2)若ab13,则Va/Vb_(填数字)。
(3)若ab14,则Va/Vb_(填表达式),且Va_Vb(填、或)。
(4)若ab15,则Va/Vb_(填数字)。
解析题目给出了酸和碱溶液pH所满足的一系列关系式,求完全中和所需两种溶液的体积关系。
四个问题求解过程相似,依题意有:
pHa的盐酸c(HCl)c(H)10amolL1pHb的NaOH溶液c(H)10bc(NaOH)10b14molL1,完全中和应满足c(HCl)Vac(NaOH)Vb
(1)若ab14,则1014141001
(2)若ab13,则101314101,(3)若ab14,则10ab141,VaVb(4)若ab15,则10151410答案
(1)1
(2)110(3)10ab141,(4)10,25时,若体积为Va、pHa的某一元强酸与体积为Vb、pHb的一元强碱混合,恰好中和,且已知VaVb和a0.5b,请填写下列空白:
(1)a值可否等于3(填“可”或“否”)_,其理由是_。
(2)a值可否等于5(填“可”或“否”)_,其理由是_。
(3)a的取值范围是_。
解析
(1)若a3,由a0.5b,可知b6,由题设pHb是一强碱,与题设矛盾。
(2)若a5,则b10c(OH)b104molL1,发生酸碱中和时,应有Vac(H)aVbc(OH)b。
与题设VaVb不符。
(3)由题设1,可得10ab141即ab140又a0.5b解得a,又pHbb2a7(强碱溶液)解得a因此a的取值范围是:
答案
(1)否,若a3,由a0.5b,可知b6。
由题设pHb是一强碱,与题设矛盾。
(2)否,若a5,则b10,c(OH)b104mol/L,发生酸碱中和时,应有Vac(H)aVbc(OH)b。
即。
(3)a,一、稀释后溶液pH的变化规律1酸碱溶液无限稀释,pH只能无限接近于7,不可能大于或小于7。
2对于pHa的强酸和弱酸溶液,每稀释10n倍,强酸的pH就增大n个单位,即pHan(an7),弱酸的pH范围是:
apHan,可用图示表示:
3对于pHb的强碱和弱碱溶液,每稀释10n倍,强碱的pH减小n个单位,即pHbn(bn7),弱碱的pH的范围是:
bnpHb,可用图示表示:
4对于物质的量浓度相同的强酸和弱酸稀释相同倍数,强酸pH变化程度比弱酸大(强碱和弱碱类似)。
二、酸、碱溶液稀释后pH的计算1强酸溶液每稀释10n倍,c(H)减小为原来的1/10n,pH稀pH原n。
2强碱溶液每稀释10n倍,c(OH)减小为原来的1/10n,pH稀pH原n。
3强酸或强碱溶液无限稀释时,由于水的电离不能忽略,故pH只能接近于7(或约等于7)。
如pH6的盐酸稀释100倍后溶液的pH7(不可能大于7),pH8的NaOH溶液稀释100倍后溶液pH7(不可能小于7)。
4弱酸溶液每稀释10n倍,c(H)减小的程度比强酸小,则pH稀pH原n。
5弱碱溶液每稀释10n倍,c(OH)减小的程度比强碱小,则pH稀pH原n。
案例精析【例3】
(2008潍坊模拟)常温下,关于溶液的稀释下列说法正确的是()ApH3的醋酸溶液稀释100倍,pH5BpH4的H2SO4溶液加水稀释100倍,溶液中由水电离产生的c(H)1106molL1C将1L0.1molL1的Ba(OH)2溶液稀释为2L,pH13DpH8的NaOH溶液稀释100倍,其pH6,解析A项,pH3的醋酸溶液在稀释过程中电离平衡正向移动,稀释100倍时,3pH5;
B项,pH4的H2SO4稀释100倍时,溶液中的c(H)106mol/L,溶液中的c(OH)1014/106molL1108molL1,水电离的c(OH)108molL1,而水电离的c(H)水电离的c(OH)108molL1;
C项,0.1molL1Ba(OH)2溶液稀释到2L时,c(OH)molL10.1molL1,c(H)1013molL1,pH13;
D项,NaOH是碱溶液无论怎么稀释,pH在常温下不可能成为6,只能无限接近于7。
答案C,室温下,将pH4的H2SO4溶液加水稀释100倍后,c(H)c()等于多少?
此时再将溶液稀释100倍后,c(H)c()等于多少?
在25的条件下,将体积都为10mL、pH都等于3的醋酸和盐酸加水稀释至amL和bmL,测得稀释后溶液的pH均为5。
则稀释后溶液的体积()Aab100mLBab1000mLCabDab,解析pH3的盐酸稀释后溶液体积为1000mL时pH5pH3的醋酸稀释后溶液体积为1000mL时pH5,若要pH5应再加水稀释,故ab答案D,H计及其使用方法pH计是用来测量被测溶液的pH的,在科研实验中有很大的用处。
下面以PHS3C型pH计为例来说明它的使用方法。
pH计结构:
它由主机、复合电极组成,主机上有四个旋钮,它们分别是:
选择、温度、斜率和定位旋钮。
pH计的使用:
安装好仪器、电极,打开仪器后部的电源开关,预热半小时。
在测量之前,首先对pH计进行校准,我们采用两点定位校准法,具体的步骤如下:
调节选择旋钮至pH档;
用温度计测量被测溶液的温度,读数,例如25。
调节温度旋钮至测量值25。
调节斜率旋钮至最大值。
打开电极套管,用蒸馏水洗涤电极头部,用吸水纸仔细将电极头部吸干,将复合电极放入混合磷酸盐的标准缓冲溶液,使溶液淹没电极头部的玻璃球,轻轻摇匀,待读数稳定后,调定位旋钮,使显示值为该溶液25时标准pH数值6.86。
将电极取出,洗净、吸干,放入邻苯二甲酸氢钾标准缓冲溶液中,摇匀,待读数稳定后,调节斜率旋钮,使显示值为该溶液25时标准pH数值4.00。
取出电极,洗净、吸干,再次放入混合磷酸盐的标准缓冲溶液,摇匀,待读数稳定后,调定位旋钮,使显示值为25时标准pH数值6.86。
取出电极,洗净、吸干,放入邻苯二甲酸氢钾的缓冲溶液中,摇匀,待读数稳定后,再调节斜率旋钮,使显示值为25时标准pH数值4.00。
取出电极,洗净、吸干。
重复校正,直到两标准溶液的测量值与标准pH基本相符为止,校正过程结束后,进入测量状态。
将复合电极放入盛有待测溶液的烧杯中,轻轻摇匀,待读数。
完成测试后,移走溶液,用蒸馏水冲洗电极,吸干,套上套管,关闭电源,结束实验。