高考化学难点剖析专题12化工流程中铝化合物的处理讲解.docx
《高考化学难点剖析专题12化工流程中铝化合物的处理讲解.docx》由会员分享,可在线阅读,更多相关《高考化学难点剖析专题12化工流程中铝化合物的处理讲解.docx(13页珍藏版)》请在冰豆网上搜索。
高考化学难点剖析专题12化工流程中铝化合物的处理讲解
专题12化工流程中铝化合物的处理
铝及其化合物的考查是高考必考内容,主要考查铝及其化合物的性质,化工流程中考查较多。
一、铝化合物的制备
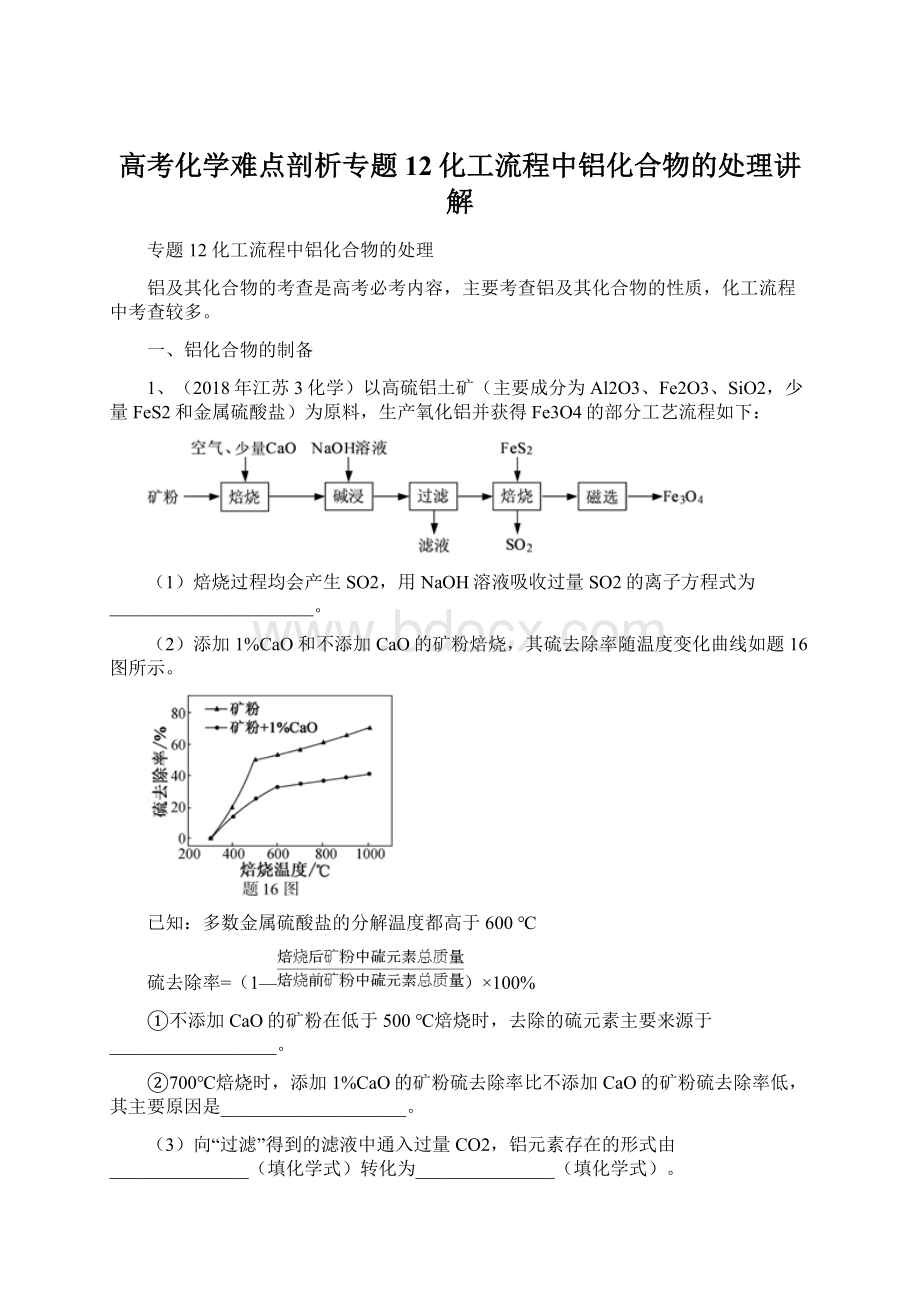
1、(2018年江苏3化学)以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:
(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为______________________。
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如题16图所示。
已知:
多数金属硫酸盐的分解温度都高于600℃
硫去除率=(1—)×100%
①不添加CaO的矿粉在低于500℃焙烧时,去除的硫元素主要来源于__________________。
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是____________________。
(3)向“过滤”得到的滤液中通入过量CO2,铝元素存在的形式由_______________(填化学式)转化为_______________(填化学式)。
(4)“过滤”得到的滤渣中含大量的Fe2O3。
Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=__________________。
【答案】SO2+OH−HSO3−FeS2硫元素转化为CaSO4而留在矿粉中NaAlO2Al(OH)31∶16
【解析】
(1)过量SO2与NaOH反应生成NaHSO3和H2O,反应的化学方程式为SO2+NaOH=NaHSO3,离子方程式为SO2+OH-=HSO3-。
(2)①根据题给已知,多数金属硫酸盐的分解温度高于600℃,不添加CaO的矿粉低于500℃焙烧时,去除的硫元素主要来源于FeS2。
②添加CaO,CaO起固硫作用,添加CaO发生的反应为2CaO+2SO2+O2=2CaSO4,根据硫去除率的含义,700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低的原因是:
硫元素转化为CaSO4留在矿粉中。
(4)Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,反应的化学方程式为FeS2+16Fe2O311Fe3O4+2SO2↑,理论上完全反应消耗的n(FeS2):
n(Fe2O3)=1:
16。
2、(2018届山东K12联盟高三开年迎春考试)某再回收利用公司对一厨房铁铝合金废旧家具进行回收利用,其流程如下图所示:
请回答下列问题:
(1)流程中加碳酸钠溶液浸泡的目的是_______________;在空气中久置的目的是_________________。
(2)同条件下Na2FeO4溶解度__________K2FeO4溶解度(填“低于”,“高于”,“不确定”),推测K2FeO4在净水方面的作用_______________。
(至少答两条)
(3)已知K2FeO4水解显碱性。
在洗涤K2FeO4固体时最好选用__________。
A.水B.亚硫酸氢钠溶液C.氢氧化钠溶液D.先氢氧化钠溶液后乙醇
(4)熔融盐电镀中铝元素和氯元素主要以AlCl4-和Al2Cl7-形式存在,铝电镀的主要电极反应式为___________________。
(写出一个电极反应即可)
(5)已知氯化铝受热易升华,气态氯化铝的密度为11.92g/L(已转化为标准状况),则气态氯化铝的分子式为______________________。
(6)氢氧化铝经常用于做药品,有两种溶解方式:
可以溶解为Al3+或[Al(OH)4]-。
已知25℃时氢氧化铝在pH=3和pH=10的两溶液中溶解度均为7.8×10-3g(溶液密度近似为1g/mL),则25℃下氢氧化铝的两种溶解方式的溶度积之比为____________。
【答案】除油污利用空气中的氧气将亚铁氧化为三价铁高于杀菌消毒、吸附悬浮物D7AlCl4+Al-3e=4Al2Cl7或相反Al2Cl61023或10-23
【解析】
(1)铁铝合金废旧家具用碳酸钠溶液浸泡可以除去表面的油脂;铁铝合金粉碎后用盐酸溶解生成氯化铝和氯化亚铁,在空气中久置可以将将亚铁氧化为三价铁,故答案为:
除油污;利用空气中的氧气将亚铁氧化为三价铁;
(3)K2FeO4水解显碱性。
A.用水洗涤,K2FeO4水解,错误;B.K2FeO4中铁为+6价,具有强氧化性,能够与亚硫酸氢钠溶液发生氧化还原反应,错误;C.用氢氧化钠溶液洗涤,可以抑制K2FeO4水解,但会引入新杂质,错误;D.先用氢氧化钠溶液洗涤,可以抑制K2FeO4水解,后乙醇洗涤,除去表面的氢氧化钠,且乙醇易挥发,正确;故选D;
(4)电镀池中镀件金属铝作阳极,金属铝失电子发生氧化反应,Al+7AlCl4-3e-=4Al2Cl7,故答案为:
阳;Al+7AlCl4-3e-=4Al2Cl7;
(5)气态氯化铝的密度为11.92g/L,则气态氯化铝的摩尔质量=11.92g/L×22.4L/mol=267g/mol,分子式为Al2Cl6,故答案为:
Al2Cl6;
(6)假设溶液体积为0.1L,则0.1L溶液中含有氢氧化铝的物质的量==1×10-4mol,则pH=10时,c{[Al(OH)4]-}==1×10-3mol/L,Al(OH)3+H2O[Al(OH)4]-+H+,溶度积=c{[Al(OH)4]-}c(H+)=1×10-3×1×10-10=1×10-13,pH=3时,c(Al3+)=1×10-3mol/L,Al(OH)3Al3++3OH-,溶度积=c(Al3+)c3(OH-)=1×10-3×(1×10-11)3=1×10-36,则25℃下氢氧化铝的两种溶解方式的溶度积之比为=1023,故答案为:
1023。
3、(安徽省江南十校2018届高三冲刺二模)盐酸法是在一定温度下盐酸与铝土矿、高岭土或粉煤灰等固体中的活性Al2O3发生反应制备Al2O3的工艺。
氯化铝溶液可通过蒸发结晶生成结晶氯化铝,进而焙烧得到氧化铝;也可利用氯化铝在酸溶液中的溶解度随着盐酸浓度的升高而急剧降低的特点,生成氯化铝晶体,从而焙烧得到氧化铝。
图1是我国某公司研发的具有自主知识产权的“一步酸溶法”工艺流程。
回答下列问题:
(1)“氯化铝在酸溶液中的溶解度随着盐酸浓度的升高而急剧降低”的原因是________________________________________________________(结合必要的化学方程式说明)。
(2)精制液蒸发结晶后分离出纯净结晶氯化铝的操作名称是_______,用_____洗涤。
(3)写出结晶氯化铝(AlCl3·6H2O)焙烧的化学方程式:
_____________________________。
(4)工业上冶炼金属铝的方法是电解熔融的_______(填化学式),电解过程中作阳极的石墨易消耗,原因是___________________________。
(5)铝粉在1000℃时可与N2反应制备AlN。
在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_______________________________________。
【答案】AlCl3溶液中存在水解平衡AlCl3+3H2OAl(OH)3+3HCl,及结晶溶解平衡AlCl3(s)Al3+(aq)+3Cl-(aq),盐酸浓度越大,两平衡都向左移动,AlCl3溶解度越小过滤浓盐酸2(AlCl3·6H2O)Al2O3+6HCl+9H2OAl2O3石墨电极被阳极上产生的O2氧化NH4Cl分解产生的HCl能够破坏Al表面的Al2O3薄膜
(2)固液分离采用过滤操作,因此精制液蒸发结晶后分离出纯净结晶氯化铝的操作是过滤;由于氯化铝溶液水解显酸性,浓盐酸能抑制其水解,洗涤时减小氯化铝晶体的损失;正确答案:
过滤;浓盐酸。
(3)氯化铝(AlCl3·6H2O)加热后水解生成氢氧化铝,氢氧化铝灼烧后生成氧化铝,化学方程式:
2(AlCl3·6H2O)Al2O3+6HCl+9H2O;正确答案:
2(AlCl3·6H2O)Al2O3+6HCl+9H2O。
(4)金属铝活泼性较强,工业上用电解熔融的氧化铝得到金属铝,阳极发生极反应为:
2O2—-4e-=O2↑,反应生成的氧气与石墨(主成分为碳)电极发生反应生成二氧化碳,造成阳极的石墨被消耗;正确答案:
Al2O3;石墨电极被阳极上产生的O2氧化。
(5)铝表面有氧化膜(Al2O3),NH4Cl分解产生的HCl能够与Al2O3反应,Al表面的Al2O3薄膜被反应掉,有利于铝粉与氮气反应生成AlN;正确答案:
NH4Cl分解产生的HCl能够破坏Al表面的Al2O3薄膜。
二、化工流程中杂质铝的除去
杂质铝主要以Al(OH)3的形式沉淀,考查内容是调节溶液的pH范围。
4、(2018届吉林市普通中学高中毕业班第三次调研测试)以冶炼金属铝的废弃物铝灰为原料制取超细-氧化铝,既能降低环境污染又可提高铝资源的利用率。
已知铝灰的主要成分为A12O3(含少量杂质SiO2、FeO、Fe2O3),其制备流程如下:
(1)用上图中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为____(填选项编号)。
(2)流程中加入H2O2有气体产生,原因是_______________________________。
(3)通过调节溶液的pH来“沉铁”,得到Fe(OH)3。
己知:
为保证产品的纯度,可以选用下列物质中的_______调节溶液pH(填字母),调节pH的范围为_______________。
a.A12O3b.NaOHc.Al(OH)3d.Na2CO3
(4)煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4Al(SO4)2·12H2O]2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,
将产生的气体通过下图所示的装置:
①集气瓶中收集到的气体是_____________________(填化学式);
②装有KMnO4溶液洗气瓶的作用是__________________________________;
③选用一种常用化学试剂和稀硝酸检验硫酸铝铵,该试剂是______________。
【答案】BFe3+对H2O2的分解有催化作用ac3.2≤pH<3.7N2吸收SO2Ba(OH)2(溶液)
【解析】
(1)能够焙烧固体的装置是坩埚,NaOH能和二氧化硅反应生成硅酸钠,所以不能采用瓷坩埚灼烧,所以应该采用铁坩埚,故选B
(2)在实验流程中,H2O2具有氧化性,能氧化亚铁离子生成铁离子,离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,而Fe3+对H2O2的分解有催化作用。
(4)①因为4[NH4Al(SO4)2·12H2O]2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,NH3N2SO3SO2混合气体通入饱和亚硫酸钠溶液,NH3SO3被吸收,剩余N2SO2在通入酸性高锰酸钾溶液,SO2被吸收,剩余N2,所以集气瓶中收集到的气体是N2。
②装有KMnO4溶液洗气瓶的作用是吸收SO2气体。
③选用一种常用化学试剂和稀硝酸检验硫酸铝铵,鉴别硫酸根用Ba2=,鉴别NH4+用OH-,所以该试剂是Ba(OH)2(溶液)。
答案:
Ba(OH)2(溶液)。
5、(2018年宁德市普通高中毕业班5月理综)FeFe2O3纳米线是一种新型铁基材料,在催化、生物医药、环境科学等领域具有广阔应用前景。
某研究小组以赤泥(铝土矿提取氧化铝过程中产生的固体废弃物,含SiO2、Fe2O3、Al2O3)为原料,设计下列流