化学键总结.docx
《化学键总结.docx》由会员分享,可在线阅读,更多相关《化学键总结.docx(18页珍藏版)》请在冰豆网上搜索。
化学键总结
第二单元微粒之间的相互作用
一、化学反应本质:
1、化学反应的实质:
就是不同物质的分子中各种原子进行重新结合
化学反应本质是旧化学键断裂和新化学键形成
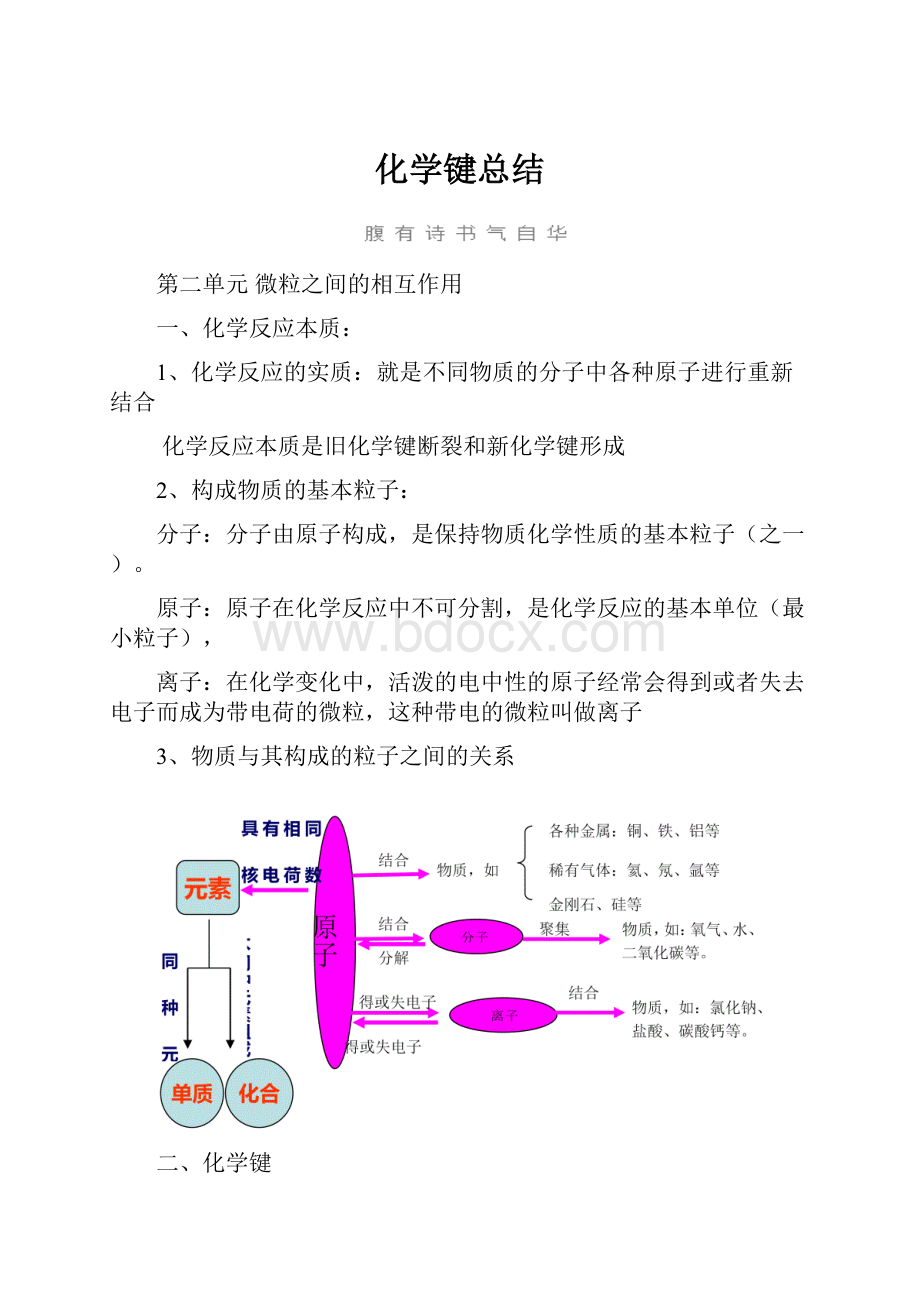
2、构成物质的基本粒子:
分子:
分子由原子构成,是保持物质化学性质的基本粒子(之一)。
原子:
原子在化学反应中不可分割,是化学反应的基本单位(最小粒子),
离子:
在化学变化中,活泼的电中性的原子经常会得到或者失去电子而成为带电荷的微粒,这种带电的微粒叫做离子
3、物质与其构成的粒子之间的关系
二、化学键
1、化学键:
物质中直接相邻的两个或多个原子(或离子)之间强烈的相互作用叫做化学键。
不同种非金属元素原子:
极性键,HCl
表2离子键、共价键和金属键的比较
化学键类型
离子键
共价键
金属键
概念
阴、阳离子间通过静电作用所形成的化学键
原子间通过共用电子对所形成的化学键
金属阳离子与自由电子通过相互作用而形成的化学键
成键微粒
阴阳离子
原子
金属阳离子和自由电子
成键性质
电子转移形成静电作用
共用电子对
电性作用
形成条件
活泼金属与活泼的非金属元素
非金属与非金属元素
金属内部
实例
NaCl、MgO
HCl、H2SO4
Fe、Mg
(一)离子键:
1、通过电子得失使阴、阳离子结合成化合物的静电作用。
Na+
Cl-
电子转移
1
氯化钠的形成过程:
不稳定
较稳定
在氯化钠中Na+和Cl-间存在哪些作用力?
2、离子化合物:
含有离子键的化合物(可以有共价键)
3、离子化合物与电解质:
离子化合物都是强电解质。
在熔融状态下:
都可以导电。
在水溶液中:
有的可以导电,有的不可以导电(此类物质易与水反应或不溶于水)。
思考:
1、所有金属和非金属化合都能形成离子键吗?
举例说明。
2、所有非金属化合都不能形成离子键吗?
举例说明。
练习:
下列物质中属于离子化合物的是()
1、H2O2、CaCl23、NaOH4、H2SO45、Na2SO4
6、CO27、Na2O28、NH4Cl9、NH310、CH4
11、NH3.H2O12、AlCl313、HAlO2
4、离子:
1.定义:
带电荷的原子(或原子团)叫做离子。
离子所带电荷数由该元素原子的最外层电子数决定。
2、离子的分类:
阳离子:
带正电荷的原子或原子团。
Na+、Mg2+、Al3+、NH4+
阴离子:
带负电荷的原子或原子团。
F-、Cl-、O2-、S2-、OH-、SO42-
离子类型:
1、金属离子:
Na+、Mg2+、Al3+
2、带负电荷的非金属离子:
F-、Cl-、O2-、S2-
3、带电的原子团:
SO4(硫酸根离子)CO3(碳酸根离子)
NO3(硝酸根离子)OH(氢氧根)
NH4(铵根离子)
切记:
带电的原子团也是离子。
5、电子式:
定义:
在元素符号周围用小黑点“.”或小叉“×”来表示原子的最外层电子的式子。
⑴、原子的电子式:
H
O
Cl
Mg
Na
练习:
用电子式表示出
K:
S:
K+:
S2-:
K2S:
Na2O:
Na2O2:
NaCl:
MgO:
MgCl2:
NH4Cl:
(二)共价键:
通过共用电子对成键
练习:
.写出下列物质的电子式和结构式
1、氯气:
4、甲烷CH4
2、溴化氢
3、氮气5、过氧化氢
共价化合物与离子化合物的区别:
⑴NaOH、⑵H2S、⑶MgCl2、⑷H2SO4、⑸KNO3、⑹CO2、⑺NH3.H2O、⑻AlCl3
离子化合物:
共价化合物:
含共价键的离子化合物:
判断非极性键和极性键的依据:
同种元素的原子之间形成的共价键一定是非极性键;
不同种元素的原子之间形成的共价键一定是极性键。
非极性分子和极性分子的比较
非极性分子
极性分子
形成原因
整个分子的电荷分布均匀,对称
整个分子的电荷分布不均匀、不对称
存在的共价键
非极性键或极性键
极性键
分子内原子排列
对称
不对称
实例
H2、O2、P4、CO2、CH4、CCl4
HCl、NO、H2O、SO2
常见分子的类型与形状比较
分子类型
分子形状
键角
键的极性
分子极性
代表物
A
球形
非极性
He、Ne
A2
直线形
非极性
非极性
H2、O2
AB
直线形
极性
极性
HCl、NO
ABA
直线形
180°
极性
非极性
CO2、CS2
ABA
角形
≠180°
极性
极性
H2O、SO2
A4
正四面体形
60°
非极性
非极性
P4
AB3
平面三角形
120°
极性
非极性
BF3、SO3
AB3
三角锥形
≠120°
极性
极性
NH3、NCl3
AB4
正四面体形
109°28′
极性
非极性
CH4、CCl4
AB3C
四面体形
≠109°28′
极性
极性
CH3Cl、CHCl3
AB2C2
四面体形
≠109°28′
极性
极性
CH2Cl2
小结:
物质相似相溶原则:
极性分子易溶于极性溶剂中;非极性分子易溶于非极性溶剂中。
例如:
碘(非极性分子)易溶于四氯化碳(非极性分子),但是在水(极性分子)中溶解度很小。
练习:
下列物质中,
A、KFB、H2OC、N2D、F2
E、CS2F、CaCl2、G、CH4
H、CCl4I、CO2
非极性分子:
极性分子:
下列说法是否正确?
并举例说明:
•①含有离子键的化合物一定是离子化合物
•②含有共价键的化合物一定是共价化合物
•③全部由非金属元素组成的化合物一定是共价化合物
•④含金属元素的化合物一定是离子化合物
•⑤水溶液电离出阴阳离子的化合物一定是离子化合物
•⑥离子化合物中可能含有非极性共价键
•⑦在气态单质分子里一定有共价键
•⑧离子化合物一定是电解质;共价化合物中不存在离子键
9、非金属原子间不可能形成离子键。
10、由非极性键构成的物质一定是非极性分子
11、由极性键构成的物质一定是极性分子
答案:
1、正确2、错,如:
NaOHNa2SO43、错,如NH4Cl等铵盐
4、错,如AlCl35、错,如:
HCl,H2SO4等酸
6、正确,如:
Na2O27、错,如:
He、Ne等稀有气体8、正确
9、错,如铵盐:
NH4Cl10、正确,如H2,O2,P4
11、错,由极性键构成对称分子是非极性分子。
如:
CO2,CH4,CCl4
三、分子间作用力:
三、化学键与分子间作用力
表1化学键与分子间作用力的比较
化学键
分子间作用力
概念
相邻的原子间强烈的相互作用叫化学键
把分子聚集在一起的作用力,叫做分子间作用力,又称范德华力
作用范围
分子内或晶体内
分子之间
作用力强弱
较强
与化学键相比弱得多
影响的性质
主要影响化学性质(如稳定性等)
主要影响物理性质(如熔沸点)
结论:
组成和结构相似的物质,相对分子质量越大,分子间作用力越大、熔沸点越高。
练习1、比较下列物质的沸点高低
HClHBrHI
2、下列物质变化时,需克服的作用力不属于化学键的是
A、HCl溶于水B、I2升华
C、H2O电解D、烧碱熔化
练习:
1、化学反应的实质
(1)化学键的形成
化学键的形成与有关,主要通过两个方面来实现。
①原子的价电子间的——离子键。
②原子的价电子间的——共价键。
(2)化学反应的本质
反应物分子内和产物分子中______。
2、分子间作用力和氢键
(1)分子间作用力
①定义:
的作用力,又称。
②特点
a.分子间作用力比化学键得多,它主要影响物质的、等物理性质,而化学键主要影响物质的化学性质。
b.分子间作用力存在于由共价键形成的多数和绝大多数气态、液态、固态非金属分子之间。
但像二氧化硅、金刚石等由共价键形成的物质,微粒之间分子间作用力。
③变化规律
一般说来,对于组成和结构相似的物质,相对分子
质量越大,分子间作用力,物质的熔、沸点
也。
例如,熔、沸点:
I2Br2Cl2F2。
(2)氢键
①定义:
分子间存在着一种比分子间作用力的相互作用。
②形成条件
除H外,形成氢键的原子通常是、、。
③存在
氢键存在广泛,如蛋白质分子、H2O、NH3、HF等
分子之间。
分子间氢键会使物质的熔点和沸点。
四、晶体。
定义:
由结晶物质构成的、其内部的构造质点(如原子、分子)呈平移周期性规律排列的固体。
特性:
(1)晶体拥有整齐规则的几何外形,即晶体的自限性。
(2)晶体拥有固定的熔点,在熔化过程中,温度始终保持不变。