初中常用相对分子质量及计算公式两份.docx
《初中常用相对分子质量及计算公式两份.docx》由会员分享,可在线阅读,更多相关《初中常用相对分子质量及计算公式两份.docx(10页珍藏版)》请在冰豆网上搜索。
初中常用相对分子质量及计算公式两份
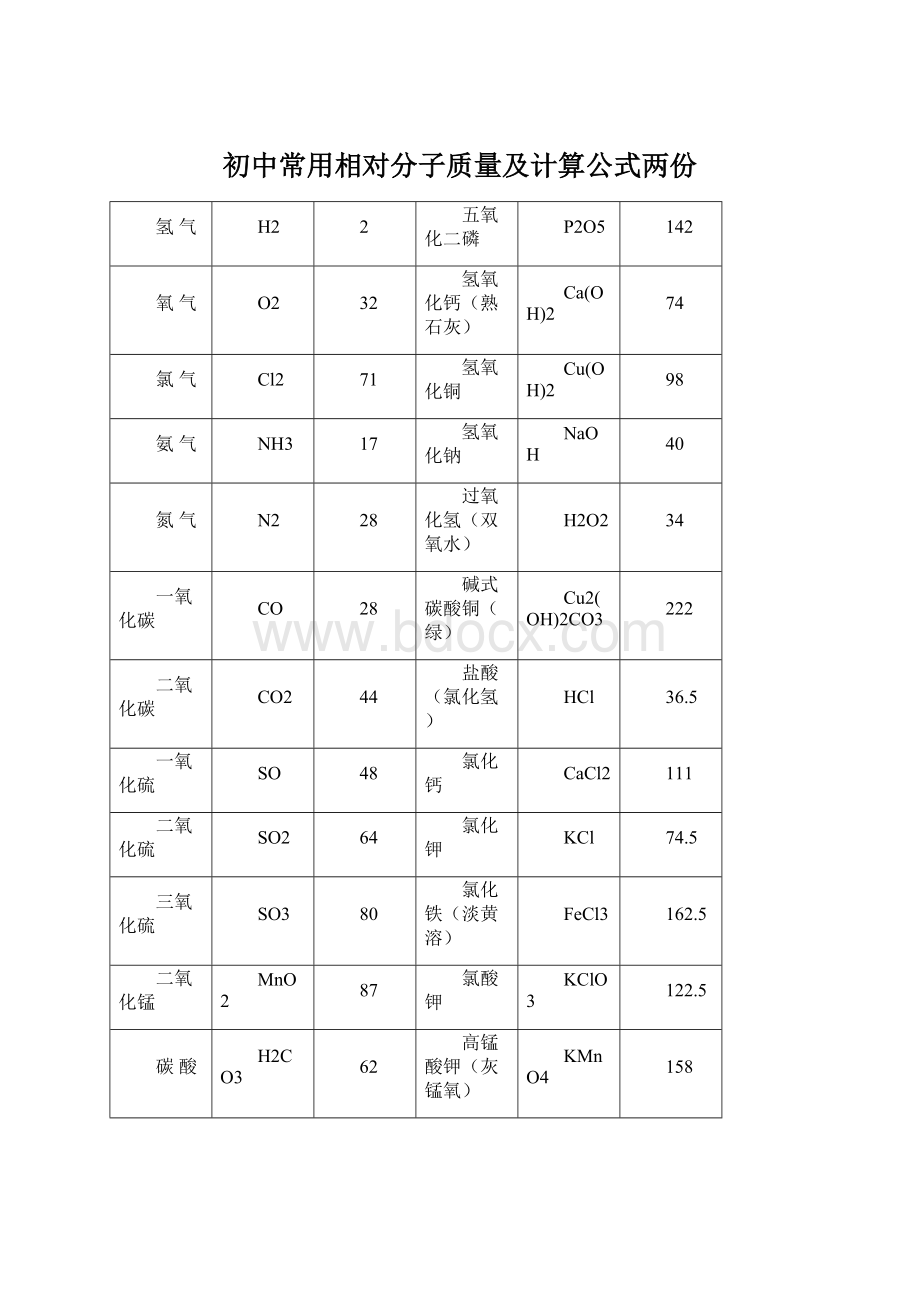
氢气
H2
2
五氧化二磷
P2O5
142
氧气
O2
32
氢氧化钙(熟石灰)
Ca(OH)2
74
氯气
Cl2
71
氢氧化铜
Cu(OH)2
98
氨气
NH3
17
氢氧化钠
NaOH
40
氮气
N2
28
过氧化氢(双氧水)
H2O2
34
一氧化碳
CO
28
碱式碳酸铜(绿)
Cu2(OH)2CO3
222
二氧化碳
CO2
44
盐酸(氯化氢)
HCl
36.5
一氧化硫
SO
48
氯化钙
CaCl2
111
二氧化硫
SO2
64
氯化钾
KCl
74.5
三氧化硫
SO3
80
氯化铁(淡黄溶)
FeCl3
162.5
二氧化锰
MnO2
87
氯酸钾
KClO3
122.5
碳酸
H2CO3
62
高锰酸钾(灰锰氧)
KMnO4
158
碳酸钙
CaCO3
100
硫酸铜(白固蓝溶)
CuSO4
160
碳酸氢铵
NH4HCO3
79
硫酸钠
Na2SO4
142
硝酸
HNO3
63
硝酸铵
NH4NO3
80
硫酸
H2SO4
98
甲烷
CH4
16
亚硫酸
H2SO3
82
尿素
CO(NH2)2
60
磷酸
H3PO4
98
甲醇
CH3OH
32
水
H2O
18
乙醇(酒精)
C2H5OH
46
氧化铜(黑)
CuO
80
乙炔
C2H2
26
氧化镁(白)
MgO
40
乙酸(醋酸)
CH3COOH
60
氧化钙(白)
CaO
56
硫酸锌(白/无)
ZnSO4
161
四氧化三铁(黑)
Fe3O4
232
硫酸亚铁(淡绿)
FeSO4
152
氧化铁(红)
Fe2O3
160
氧化亚铁(黑)
FeO
72
氢H
(1);氦He(4);碳C(12);氮N(14);氧O(16);氟F(19);氖Ne(20);钠Na(23);镁Mg(24);铝Al(27);硅Si(28);磷P(31);
硫S(32);氯Cl(35.5);氩Ar(40);钾K(39);钙Ca(40);锰Mn(55);铁Fe(56);铜Cu(63.5);锌Zn(65);银Ag(108);钡Ba(137);铂Pt(195);金Au(197);汞Hg(201);碘I(127).
钾钙钠镁铝,锌铁锡铅(氢),铜汞银铂金.
K、Ca、Na、Mg、Al,Zn、Fe、Sn、Pb、(H),Cu、Hg、Ag、Pt、Au.
钾钙钠可以与水剧烈反应,镁与水反应不剧烈,铝可以与热水反应(要加热).
初中化学反应常见基本的化学方程式:
(1)单质与氧气的反应:
(化合反应)
1.镁在空气中燃烧:
2Mg+O2点燃====2MgO
2.铁在氧气中燃烧:
3Fe+2O2点燃====Fe3O4
3.铜在空气中受热:
2Cu+O2加热====2CuO
4.铝在空气中燃烧:
4Al+3O2点燃====2Al2O3
5.氢气中空气中燃烧:
2H2+O2点燃====2H2O
6.红磷在空气中燃烧(研究空气组成的实验):
4P+5O2点燃====2P2O5
7.硫粉在空气中燃烧:
S+O2点燃====SO2
8.碳在氧气中充分燃烧:
C+O2点燃====CO2
9.碳在氧气中不充分燃烧:
2C+O2点燃====2CO
(2)化合物与氧气的反应:
10.一氧化碳在氧气中燃烧:
2CO+O2点燃====2CO2
11.甲烷在空气中燃烧:
CH4+2O2点燃====CO2+2H2O
12.酒精在空气中燃烧:
C2H5OH+3O2点燃====2CO2+3H2O
(3)氧气的来源:
13.玻义耳研究空气的成分实验2HgO加热====2Hg+O2↑
14.加热高锰酸钾:
2KMnO4加热====K2MnO4+MnO2+O2↑(实验室制氧气原理1)
15.过氧化氢在二氧化锰作催化剂条件下分解反应:
H2O2MnO2=====2H2O+O2↑(实验室制氧气原理2)
二、自然界中的水:
16.水在直流电的作用下分解(研究水的组成实验):
2H2O通电====2H2↑+O2↑
17.生石灰溶于水:
CaO+H2O==Ca(OH)2
18.二氧化碳可溶于水:
H2O+CO2==H2CO3
三、质量守恒定律:
19.镁在空气中燃烧:
2Mg+O2点燃====2MgO
20.铁和硫酸铜溶液反应:
Fe+CuSO4===FeSO4+Cu
21.氢气还原氧化铜:
H2+CuO加热====Cu+H2O
22.镁还原氧化铜:
Mg+CuO加热====Cu+MgO
四、碳和碳的氧化物:
(1)碳的化学性质
23.碳在氧气中充分燃烧:
C+O2点燃====CO2
24.木炭还原氧化铜:
C+2CuO高温====2Cu+CO2↑
25.焦炭还原氧化铁:
3C+2Fe2O3高温====4Fe+3CO2↑
(2)煤炉中发生的三个反应:
(几个化合反应)
26.煤炉的底层:
C+O2点燃====CO2
27.煤炉的中层:
CO2+C高温====2CO
28.煤炉的上部蓝色火焰的产生:
2CO+O2点燃====2CO2
(3)二氧化碳的制法与性质:
29.大理石与稀盐酸反应(实验室制二氧化碳):
CaCO3+2HCl==CaCl2+H2O+CO2↑
30.碳酸不稳定而分解:
H2CO3==H2O+CO2↑
31.二氧化碳可溶于水:
H2O+CO2==H2CO3
32.高温煅烧石灰石(工业制二氧化碳):
CaCO3高温====CaO+CO2↑
33.石灰水与二氧化碳反应(鉴别二氧化碳):
Ca(OH)2+CO2===CaCO3↓+H2O
(4)一氧化碳的性质:
34.一氧化碳还原氧化铜:
CO+CuO加热====Cu+CO2
35.一氧化碳的可燃性:
2CO+O2点燃====2CO2
其它反应:
36.碳酸钠与稀盐酸反应(灭火器的原理):
Na2CO3+2HCl==2NaCl+H2O+CO2↑
五、燃料及其利用:
37.甲烷在空气中燃烧:
CH4+2O2点燃====CO2+2H2O
38.酒精在空气中燃烧:
C2H5OH+3O2点燃====2CO2+3H2O
39.氢气中空气中燃烧:
2H2+O2点燃====2H2O
六、金属
(1)金属与氧气反应:
40.镁在空气中燃烧:
2Mg+O2点燃====2MgO
41.铁在氧气中燃烧:
3Fe+2O2点燃====Fe3O4
42.铜在空气中受热:
2Cu+O2加热====2CuO
43.铝在空气中形成氧化膜:
4Al+3O2=2Al2O3
(2)金属单质+酸--------盐+氢气(置换反应)
44.锌和稀硫酸Zn+H2SO4=ZnSO4+H2↑
45.铁和稀硫酸Fe+H2SO4=FeSO4+H2↑
46.镁和稀硫酸Mg+H2SO4=MgSO4+H2↑
47.铝和稀硫酸2Al+3H2SO4=Al2(SO4)3+3H2↑
48.锌和稀盐酸Zn+2HCl==ZnCl2+H2↑
49.铁和稀盐酸Fe+2HCl==FeCl2+H2↑
50.镁和稀盐酸Mg+2HCl==MgCl2+H2↑
51.铝和稀盐酸2Al+6HCl==2AlCl3+3H2↑
(3)金属单质+盐(溶液)-------新金属+新盐
52.铁和硫酸铜溶液反应:
Fe+CuSO4==FeSO4+Cu
53.锌和硫酸铜溶液反应:
Zn+CuSO4==ZnSO4+Cu
54.铜和硝酸汞溶液反应:
Cu+Hg(NO3)2==Cu(NO3)2+Hg
(3)金属铁的治炼原理:
55.3CO+2Fe2O3高温====4Fe+3CO2↑
七、酸、碱、盐
1、酸的化学性质
(1)酸+金属--------盐+氢气(见上)
(2)酸+金属氧化物--------盐+水
56.氧化铁和稀盐酸反应:
Fe2O3+6HCl==2FeCl3+3H2O
57.氧化铁和稀硫酸反应:
Fe2O3+3H2SO4==Fe2(SO4)3+3H2O
58.氧化铜和稀盐酸反应:
CuO+2HCl==CuCl2+H2O
59.氧化铜和稀硫酸反应:
CuO+H2SO4==CuSO4+H2O
(3)酸+碱--------盐+水(中和反应)
60.盐酸和烧碱起反应:
HCl+NaOH==NaCl+H2O
61.盐酸和氢氧化钙反应:
2HCl+Ca(OH)2==CaCl2+2H2O
62.氢氧化铝药物治疗胃酸过多:
3HCl+Al(OH)3==AlCl3+3H2O
63.硫酸和烧碱反应:
H2SO4+2NaOH==Na2SO4+2H2O
(4)酸+盐--------另一种酸+另一种盐
64.大理石与稀盐酸反应:
CaCO3+2HCl==CaCl2+H2O+CO2↑
65.碳酸钠与稀盐酸反应:
Na2CO3+2HCl==2NaCl+H2O+CO2↑
66.碳酸氢钠与稀盐酸反应:
NaHCO3+HCl==NaCl+H2O+CO2↑
67.硫酸和氯化钡溶液反应:
H2SO4+BaCl2==BaSO4↓+2HCl
2、碱的化学性质
(1)碱+非金属氧化物--------盐+水
68.苛性钠暴露在空气中变质:
2NaOH+CO2==Na2CO3+H2O
69.苛性钠吸收二氧化硫气体:
2NaOH+SO2==Na2SO3+H2O
70.苛性钠吸收三氧化硫气体:
2NaOH+SO3==Na2SO4+H2O
71.消石灰放在空气中变质:
Ca(OH)2+CO2==CaCO3↓+H2O
72.消石灰吸收二氧化硫:
Ca(OH)2+SO2==CaSO3↓+H2O
(2)碱+酸--------盐+水(中和反应,方程式见上)
(3)碱+盐--------另一种碱+另一种盐
73.氢氧化钙与碳酸钠:
Ca(OH)2+Na2CO3==CaCO3↓+2NaOH
3、盐的化学性质
(1)盐(溶液)+金属单质-------另一种金属+另一种盐
74.铁和硫酸铜溶液反应:
Fe+CuSO4==FeSO4+Cu
(2)盐+酸--------另一种酸+另一种盐
75.碳酸钠与稀盐酸反应:
Na2CO3+2HCl==2NaCl+H2O+CO2↑
碳酸氢钠与稀盐酸反应:
NaHCO3+HCl==NaCl+H2O+CO2↑
(3)盐+碱--------另一种碱+另一种盐
76.氢氧化钙与碳酸钠:
Ca(OH)2+Na2CO3==CaCO3↓+2NaOH
(4)盐+盐-----两种新盐
77.氯化钠溶液和硝酸银溶液:
NaCl+AgNO3==AgCl↓+NaNO3
78.硫酸钠和氯化钡:
Na+SO4+BaCl2==BaSO4↓+2NaCl
【力学部分】
1、速度:
V=S/t2、重力:
G=mg3、密度:
ρ=m/V4、压强:
p=F/S
5、液体压强:
p=ρgh
6、浮力:
(1)、F浮=F’-F(压力差)(3)、F浮=G(漂浮、悬浮)
(4)、阿基米德原理:
F浮=G排=ρ液gV排
7、杠杆平衡条件:
F1L1=F2L28、理想斜面:
F/G=h/L
9、理想滑轮:
F=G/n10、实际滑轮:
F=(G+G动)/n(竖直方向)
11、功:
W=FS=Gh(把物体举高)12、功率:
P=W/t=FV
13、功的原理:
W手=W机14、实际机械:
W总=W有+W额外
15、机械效率:
η=W有/W总
16、滑轮组效率:
(1)、η=G/nF(竖直方向)
(2)、η=G/(G+G动)(竖直方向不计摩擦)
(3)、η=f/nF(水平方向)
【热学部分】
1、吸热:
Q吸=Cm(t-t0)=CmΔt2、放热:
Q放=Cm(t0-t)=CmΔt
3、热值:
q=Q/m4、炉子和热机的效率:
η=Q有效利用/Q燃料
5、热平衡方程:
Q放=Q吸6、热力学温度:
T=t+273K
【电学部分】
1、电流强度:
I=Q电量/t2、电阻:
R=ρL/S3、欧姆定律:
I=U/R
4、焦耳定律:
(1)、Q=I2Rt普适公式)
(2)、Q=UIt=Pt=UQ电量=U2t/R(纯电阻公式)
5、串联电路:
(1)、I=I1=I2
(2)、U=U1+U2
(3)、R=R1+R2
(1)、W=UIt=Pt=UQ(普适公式)
(2)、W=I2Rt=U2t/R(纯电阻公式)
9电功率:
(1)、P=W/t=UI(普适公式)
(2)、P=I2R=U2/R(纯电阻公式)
【常用物理量】
1、光速:
C=3×108m/s(真空中)2、声速:
V=340m/s(15℃)
3、人耳区分回声:
≥0.1s4、重力加速度:
g=9.8N/kg≈10N/kg
5、标准大气压值:
760毫米水银柱高=1.01×105Pa
6、水的密度:
ρ=1.0×103kg/m37、水的凝固点:
0℃
8、水的沸点:
100℃9、水的比热容:
C=4.2×103J/(kg•℃)
10、元电荷:
e=1.6×10-19C11、一节干电池电压:
1.5V
12、一节铅蓄电池电压:
2V
氢气
H2
2
五氧化二磷
P2O5
142
氧气
O2
32
氢氧化钙(熟石灰)
Ca(OH)2
74
氯气
Cl2
71
氢氧化铜
Cu(OH)2
98
氨气
NH3
17
氢氧化钠
NaOH
40
氮气
N2
28
过氧化氢(双氧水)
H2O2
34
一氧化碳
CO
28
碱式碳酸铜(绿)
Cu2(OH)2CO3
222
二氧化碳
CO2
44
盐酸(氯化氢)
HCl
36.5
一氧化硫
SO
48
氯化钙
CaCl2
111
二氧化硫
SO2
64
氯化钾
KCl
74.5
三氧化硫
SO3
80
氯化铁(淡黄溶)
FeCl3
162.5
二氧化锰
MnO2
87
氯酸钾
KClO3
122.5
碳酸
H2CO3
62
高锰酸钾(灰锰氧)
KMnO4
158
碳酸钙
CaCO3
100
硫酸铜(白固蓝溶)
CuSO4
160
碳酸氢铵
NH4HCO3
79
硫酸钠
Na2SO4
142
硝酸
HNO3
63
硝酸铵
NH4NO3
80
硫酸
H2SO4
98
甲烷
CH4
16
亚硫酸
H2SO3
82
尿素
CO(NH2)2
60
磷酸
H3PO4
98
甲醇
CH3OH
32
水
H2O
18
乙醇(酒精)
C2H5OH
46
氧化铜(黑)
CuO
80
乙炔
C2H2
26
氧化镁(白)
MgO
40
乙酸(醋酸)
CH3COOH
60
氧化钙(白)
CaO
56
四氧化三铁(黑)
Fe3O4
232
氧化铁(红)
Fe2O3
160
氧化亚铁(黑)
FeO
72
硫酸亚铁(淡绿)
FeSO4
152
硫酸锌(白/无)
ZnSO4
161
初中化学常用计算公式
一.常用计算公式:
(1)相对原子质量=某元素一个原子的质量/一个碳原子质量的1/12
(2)设某化合物化学式为AmBn
①它的相对分子质量=A的相对原子质量×m+B的相对原子质量×n
②A元素与B元素的质量比=A的相对原子质量×m:
B的相对原子质量×n
③A元素的质量分数ω=A的相对原子质量×m/AmBn的相对分子质量
(3)混合物中含某物质的质量分数(纯度)=纯物质的质量/混合物的总质量×100%
(4)标准状况下气体密度(g/L)=气体质量(g)/气体体积(L)
(5)纯度=纯物质的质量/混合物的总质量×100%=
纯物质的质量/(纯物质的质量+杂质的质量)×100%=
1-杂质的质量分数
(6)溶质的质量分数=溶质质量/溶液质量×100%=溶质质量/(溶质质量+溶剂质量)×100%
(7)溶液的稀释与浓缩
M浓×a%浓=M稀×b%稀=(M浓+增加的溶剂质量)×b%稀
(8)相对溶质不同质量分数的两种溶液混合
M浓×a%浓+M稀×b%稀=(M浓+M稀)×c%
(9)溶液中溶质的质量
=溶液的质量×溶液中溶质的质量分数
=溶液的体积×溶液的密度