高中化学人教版必修一复习之综合填空实验计算推断题.docx
《高中化学人教版必修一复习之综合填空实验计算推断题.docx》由会员分享,可在线阅读,更多相关《高中化学人教版必修一复习之综合填空实验计算推断题.docx(83页珍藏版)》请在冰豆网上搜索。
高中化学人教版必修一复习之综合填空实验计算推断题
人教版必修一复习
之综合,填空,实验,计算,推断题
一、综合题
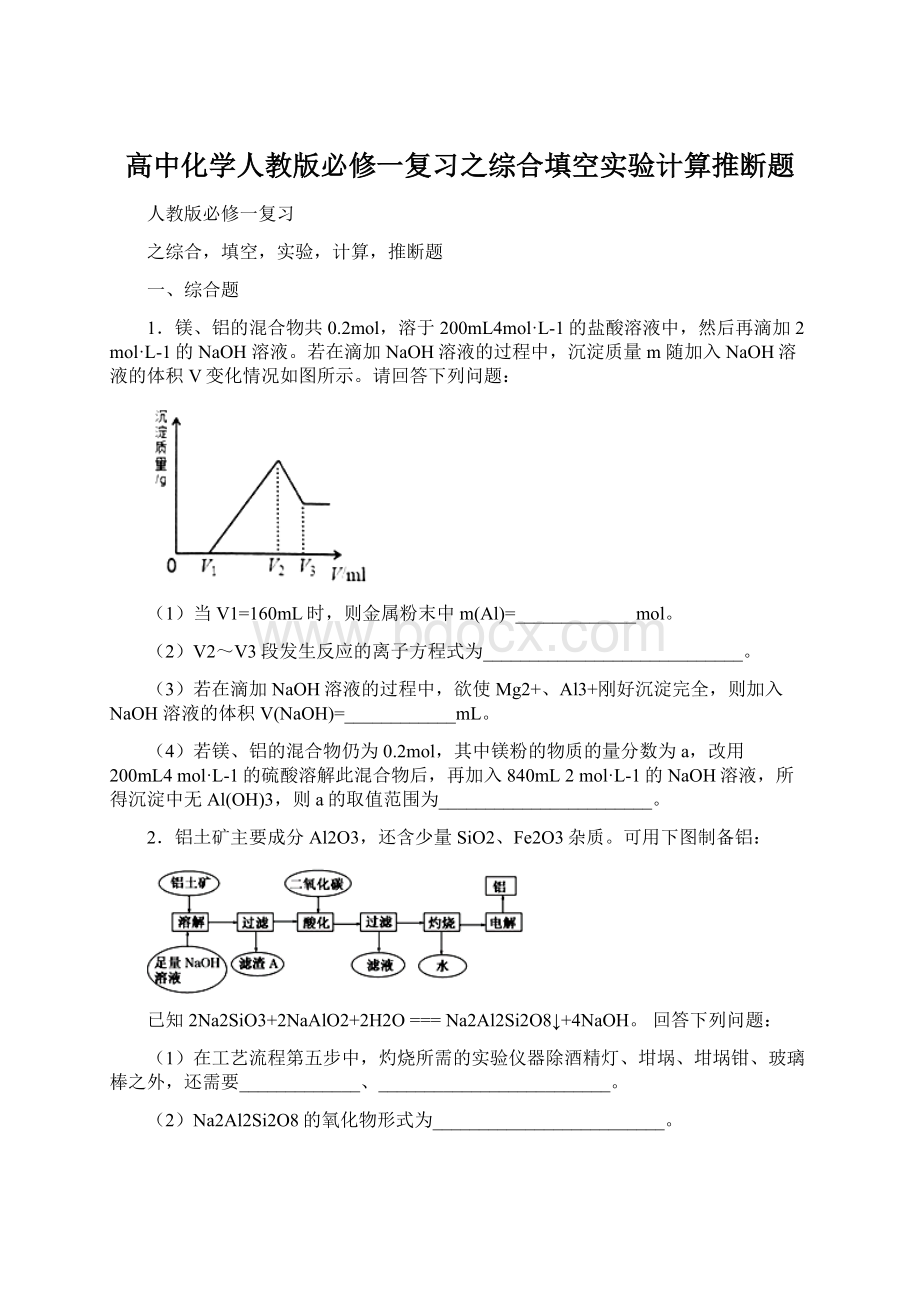
1.镁、铝的混合物共0.2mol,溶于200mL4mol·L-1的盐酸溶液中,然后再滴加2mol·L-1的NaOH溶液。
若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化情况如图所示。
请回答下列问题:
(1)当V1=160mL时,则金属粉末中m(Al)=_____________mol。
(2)V2~V3段发生反应的离子方程式为____________________________。
(3)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则加入NaOH溶液的体积V(NaOH)=____________mL。
(4)若镁、铝的混合物仍为0.2mol,其中镁粉的物质的量分数为a,改用200mL4mol·L-1的硫酸溶解此混合物后,再加入840mL2mol·L-1的NaOH溶液,所得沉淀中无Al(OH)3,则a的取值范围为_______________________。
2.铝土矿主要成分Al2O3,还含少量SiO2、Fe2O3杂质。
可用下图制备铝:
已知2Na2SiO3+2NaAlO2+2H2O===Na2Al2Si2O8↓+4NaOH。
回答下列问题:
(1)在工艺流程第五步中,灼烧所需的实验仪器除酒精灯、坩埚、坩埚钳、玻璃棒之外,还需要_____________、_________________________。
(2)Na2Al2Si2O8的氧化物形式为_________________________。
(3)滤渣A经多步可制得粗硅,请写出由二氧化硅制得粗硅的化学方程式________________。
(4)在工艺流程第三步中,通入过量的二氧化碳时,该反应的离子方程式有_______________,得到的滤液与足量Ba(OH)2溶液反应的主要离子方程式为____________________。
(5)将ag铝土矿经过以上一系列操作之后,最终得到bgAl(不考虑实验过程中操作引起的损耗),下列说法正确的是____________。
(NA表示阿伏加德罗常数)
A.铝土矿中Al3+数目小于
B.铝土矿中Al2O3物质的量小于b/54mol
C.铝土矿中铝元素的质量分数为
×100℅
3.铝热反应是铝的一个重要性质,该性质用途十分广泛.“铝热反应”的现象有这样的描述:
“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”.已知:
Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如表:
物质
Al
Al2O3
Fe
Fe2O3
熔点/℃
660
2054
1535
1462
沸点/℃
2467
2980
2750
﹣
I.
(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金.理由是:
该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.你认为他的解释是否合理?
_____(填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是________,反应的离子方程式为_____________________。
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是_________(填序号)。
A、浓硫酸B、稀硫酸C、稀硝酸D、氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出,此时溶液中氮元素的存在形式只有NO3-和NH4+,铁元素的存在形式为Fe3+,在反应结束后的溶液中,逐滴加入6mol•L﹣1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
(1)依题意,请写出熔融物中铁与该稀的硝酸反应的离子方程式:
___________;
(2)在CD段,沉淀的物质的量减少,则此阶段发生反应的离子方程式为________________;
(3)熔融物中铝元素的物质的量为_______mol。
(4)B点对应的沉淀的物质的量为____mol。
4.雾霾天气严重影响人们的生活质量,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。
消除氮氧化物和硫氧化物有多种方法。
(1)氮、氧元素非金属性较强的是_____。
(用元素符号回答)
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。
反应原理如图1所示:
①由图1可知SCR技术中的氧化剂为:
_________________。
②用Fe做催化剂时,在氨气足量的情况下,不同c(NO)/c(NO2)对应的脱氮率如图2所示,效果最佳的c(NO)/c(NO2)=_________。
(3)硝酸厂常用如下烧碱吸收法处理氦氧化物(NO与NO2)尾气。
氮氧化物(NO与NO2)用烧碱进行吸收,产物为NaNO2、NaNO3和H2O。
现有含0.5mol氮氧化物的尾气,恰好被一定体积的25%NaOH溶液(密度1.28g/cm3)完全吸收。
已知反应后溶液中含有0.35mo1NaNO2。
则尾气中NO与NO2的物质的量之比为______。
(已知:
2NO2+2NaOH=NaNO3+NaNO2+H2O、NO+NO2+2NaOH=2NaNO2+H2O)
(4)现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的稀硝酸[假设反应中稀硝酸的还原产物只有NO),产生气体在标准状况下的体积与剩余固体的质量如下表:
硝酸体枳(mL)
100
200
300
400
剩余固体(g)
18.0
9.6
0
0
放出气体的体积(mL)
2240
4480
6720
计算原混合物中铁和铜的物质的量比为_______________。
5.铁黄是一种重要的颜料,化学式为Fe2O3•xH2O,广泛用于涂料、橡胶、塑料、文教用品等工业。
实验室模拟工业利用硫酸渣(含Fe2O3及少量的CaO、MgO等)和黄铁矿粉(主要成分为FeS2)制备铁黄的流程如图:
(1)操作Ⅰ与操作Ⅱ中都用到玻璃棒,玻璃棒在两种操作中的作用分别是________、________。
(2)试剂a最好选用______(供选择使用的有:
铝粉、空气、浓HNO3);其作用是________。
(3)上述步骤中需用到氨气.下列装置可用于实验室制氨气的是______(填序号)。
(4)检验溶液Z中含有NH4+的方法是________。
(5)查阅资料知,在不同温度下Fe2O3被CO还原,产物可能为Fe3O4、FeO或Fe,固体质量与反应温度的关系如下图所示。
根据图像推断650℃时Fe2O3还原产物的化学式为________,并设计一个简单的实验,证明该还原产物的成分(简述实验操作、现象和结论)________。
仪器自选。
可供选择的试剂:
稀H2SO4、稀盐酸、H2O2溶液、NaOH溶液、KSCN溶液。
6.某研究性学习小组对Mg和Al的性质进行了下列的实验及研究。
(1)以镁条、铝片为电极,稀NaOH溶液为电解质构成的原电池(如图1所示)时发现,刚开始时,电流表指针向右偏转,镁条做负极;但随后很快指针又向左偏转,镁条表面有极少量的气泡产生。
①开始阶段,负极发生的反应是________。
②随后阶段,铝片发生的电极反应式是_______;则镁电极发生的电极反应式是________。
(2)经研究测定,镁与不同浓度的硝酸反应,生成气体产物的含量随HNO3浓度变化曲线如图2所示,溶液中的产物有Mg(NO3)2、NH4NO3和H2O。
96mgMg在1L4mol•L﹣1的HNO3中完全溶解,并可收集到22.4mL(标准状况下)气体(忽略反应过程中HNO3浓度的变化),该反应的化学方程式是________。
7.某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验内容如下:
根据以上信息,回答下列问题:
(1)写出①中反应生成气体A的离子方程式:
___________________________________
(2)上述离子中,溶液X中除H+外还肯定含有的离子是_______________,不能确定是否含有的离子是___________________,若要确定其中阳离子的存在,最常见的操作方法是____________(用文字表述)。
(3)沉淀G的化学式为_________,写出生成沉淀I的离子方程式_____________________。
8.H、C、N、C、Na、S、Fe是中学化学中常见的元素,请根据题意回答与这些元素有关的问题:
(1)Fe元素在元素周期表中的位置:
___________________;
(2)写出(CN)2的电子式:
__________________;
(3)用电子式表示Na3N的形成过程:
__________________;
(4)各种氮氧化物(NO、NO2)是主要的大气污染物之一,治理氨氧化物(NOx)废气的方法之一是用NaOH溶液进行吸收,其反应原理可表示如下:
NO2+NO+2NaOH=2NaNO2+H2O2NO2+2NaOH=NaNO2+NaNO3+H2O
现有NO与NO2的混合气体,将其通入50mL2mol/L的NaOH溶液中,恰好完全吸收,测得溶液中含有NO3-0.02mol,混合气体中v(NO):
v(NO2)=_________;
(5)向FeI2溶液中不断通入Cl2,溶液中I-、I2、IO3-、Fe3+、Fe2+等粒子物质的量随n(Cl2)/n(FeI2)的变化可用下图简单表示
当n(Cl2)/n(FeI2)=6.5时,溶液中n(Cl-):
n(IO3-)=_________;
9.某研究性学习小组请你参与“铁及其化合物”有关性质的实验探究,并共同解答下列问题:
探究一 设计如图所示装置进行“铁与水反应”的实验(夹持仪器略)。
(1)硬质玻璃管B中发生反应的化学方程式为_______________________________。
(2)反应前A中投放碎瓷片的目的是____________________。
(3)装置E中的现象是__________________________________。
探究二FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:
I.实验需要90mL0.10mol·L-1FeBr2溶液
(1)配制FeBr2溶液除烧杯、量筒、玻璃棒、胶头滴管外还需的玻璃仪器是________。
(2)下列有关配制过程中说法正确的是________(填序号)。
a.用托盘天平称量质量为1.944g的FeBr2
b.将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解
c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高
II.探究FeBr2的还原性
取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。
某同学对产生黄色的原因提出了假设:
假设1:
Br-被Cl2氧化成Br2溶解在溶液中;
假设2:
Fe2+被Cl2氧化成Fe3+。
(3)请你完成下表,验证假设
实验步骤、预期现象
结论
①向溶液中加入__________,振荡、静置,
现象:
下层呈橙红色,上层呈无色
假设1正确
②向溶液中加入_____________
现象:
溶液变为红色
假设2正确
若假设1正确,从实验①中分离出Br2的实验操作名称是_______________。
(4)已知:
Br2+2Fe2+=2Fe3++2Br-。
若在50mL上述FeBr2溶液中通入标准状况112mlCl2,反应的离子方程式为__________________________________________。
10.I、硬质玻璃管是化学实验中经常使用的一种仪器,分析下列实验并回答:
如图1所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表(认为所产生的气体与棉球上的试剂均得到充分的反应)。
则浓硫酸在该反应中表现的性质_________________;
棉球
棉球上滴加试剂
实验现象
解释或结论
a
___________
棉球变白,微热后又恢复红色
该气体具有______性。
b
含酚酞的NaOH溶液
棉球变为白色
离子方程式_________
c
__________
棉球变为白色
化学方程式___________,该气体具有_______性。
II.通常情况下,向硫酸亚铁溶液中滴加氢氧化钠溶液时,生成的白色絮状沉淀会迅速变为_____色,最终变为____色写出上述白色絮状沉淀变化过程的化学方程式_______;
用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:
用不含O2的蒸馏水配制的NaOH溶液与硫酸亚铁反应制备。
(1)除去蒸馏水中溶解的O2常采用_________的方法。
(2)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。
方法二:
如右图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管I里加入的试剂是___________。
(2)为了制得白色Fe(OH)2沉淀,在试管I和II中加入试剂,打开止水夹,塞紧塞子后,检验试管II出口处排出的氢气的纯度。
当排出的氢气纯净时,再________(如何操作)。
这样生成的Fe(OH)2沉淀能较长时间保持白色。
原因是____________。
11.某无色溶液中含有的金属阳离子为Mg2+、Al3+,向该溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的物质的量与加入NaOH的物质的量的关系如图所示。
(1)由此确定原溶液中一定还大量含有某阳离子,它可能是________。
(2)若溶质为MgCl2和Al2(SO4)3,则原溶液中铝离子的物质的量为______________。
(3)下列图象中,横坐标表示加入试剂或通入气体的物质的量,纵坐标表示产生沉淀的质量,用图象的序号或文字回答下列问题:
Ⅰ.表示向AlCl3溶液中逐渐滴加NaOH溶液的是______;
Ⅱ.表示向NaAlO2溶液中逐渐滴加稀盐酸的是________;
Ⅲ.表示向NaAlO2溶液中通入CO2的是________;
Ⅳ.③图____________(填“能”或“不能”)代表向含NaOH的澄清石灰水中通入CO2。
12.下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件来列出)。
其中,I是由地壳中含量最多的金属元素组成的单质,K是一种红棕色气体,C是一种强酸。
请填写下列空白:
(1)写出下列物质的化学式:
A:
___________E:
_____________。
(2)写出反应④的离子方程式:
______________________。
写出反应⑦的化学方程式:
______________________。
写出反应⑩的化学方程式:
______________________。
(3)在反应②、③、⑥、⑧、⑨中,既属于化合反应又属于氧化还原反应的__________________(填写序号)。
(4)写出检验M溶液中阳离子的方法:
______________________。
(5)将化合物D与KNO3、KOH高温共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O。
写出该反应的化学方程式并用双线桥标出电子转移方向和数目:
___________。
(6)ClO2也是绿色净水剂,ClO2制备方法较多,我国科学家探索的新方法是:
氯气(Cl2)和固体亚氯酸钠(NaClO2)反应,写出该反应的化学方程式:
__________________。
13.某无色稀溶液X中,可能含有下表所列离子中的某几种
阳离子
H+、Na+、Al3+、Fe3+、NH4+、Mg2+
阴离子
OH-、CO32-、SiO32-、AlO2-、Cl-
现取适量该溶液,向其中加入某试剂Y,产生沉淀物质的量(n)与加入试剂的体积(V)关系如图所示:
(1)若Y是盐酸,所得到的关系图如甲图所示,则X中一定含有的阴离子是______,X中一定存在的几种阴离子物质的量之比为____(按题干表格中阴离子出现的顺序写比例顺序);ab段发生反应的离子方程式为_________________;cd段发生的反应的离子方程式为______________。
(2)若Y是NaOH 溶液,所得到的关系图如乙用所示,X中一定含有的阳离子是_______;ab段发生反应的离子________________;bc段发生反应的离子为________________;cd段发生反应的离子方程式为______________。
14.某同学用软锰矿(主要含MnO2,还含有少了SiO2、Al2O3、Fe2O3等杂质)模拟工业制高锰酸钾流程如下。
试回答下列问题。
(1)配平焙烧时MnO2参与的化学反应:
□MnO2+□_____+□O2
□K2MnO4+□H2O;第二次通入过量CO2时发生反应的离子方程式为:
______________________。
(2)滤渣I、II的成分中能与NaOH反应的是__________________(填化学式)。
产生滤渣II时不能用稀盐酸代替CO2,因为______________________。
(3)将滤液Ⅲ进行一系列操作可得到KMnO4晶体。
由下图可知,从滤液Ⅲ得到KMnO4需经过____、____洗涤等操作。
(4)用重结晶提纯的产品配制成0.10mol·L-1的酸性KMnO4溶液来测定某草酸样品的纯度(杂质不参与反应,草酸为弱酸,分子式H2C2O4)。
①试给出反应的离子方程式:
_______________________。
②若某测定大致共需要230毫升酸性KMnO4溶液,配制时所需玻璃仪器为:
___、___烧杯、胶头滴管等。
③取草酸样品5克,配成100mL溶液,取20mL于适当容器中,用前述所配酸性KMnO4溶液滴定,至反应结束消耗KMnO4溶液20mL,则样品的纯度为:
___________。
15.工业上常用含少量SiO2、Al2O3的铬铁矿(FeO·Cr2O3)冶炼铬,简要流程如下:
(1)完成下列化学方程式(在横线上填写物质的化学式及计量数):
2FeO·Cr2O3+4Na2CO3+7NaNO3
4Na2CrO4+Fe2O3+4CO2↑+________。
(2)操作①包括过滤与洗涤,在实验室中进行洗涤沉淀的操作是_____________________;操作②可选用的装置(部分夹持装置略去)是________(填序号)。
(3)写出能够完成操作③的相关反应的化学方程式:
__________________________________。
(4)化学需氧量(COD)可度量水遭受有机物污染的程度。
在强酸并加热的条件下,用K2Cr2O7作强氧化剂处理水样,并测定消耗的K2Cr2O7的量,然后换算成相当于O2的含量称为化学需氧量(以mg·L-1计)。
化学兴趣小组测定某水样的化学需氧量(COD)过程如下:
a.取amL水样置于锥形瓶中,加入10.00mL0.2500mol·L-1的K2Cr2O7溶液。
b.……
c.加指示剂,用cmol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定,终点时消耗bmL(此步骤的目的是用Fe2+把多余的Cr2O
转化为Cr3+)。
①计算该水样的化学需氧量时需用到下列关系:
要除去1molCr2O
需消耗_______molFe2+,1molCr2O
相当于________molO2。
②该废水中加入硫酸亚铁铵和稀硫酸,发生反应的离子方程式为______________________。
③若用硫酸亚铁铵[(NH4)2Fe(SO4)2]处理该含铬(Cr2O
)废水过程中,反应中铁元素和铬元素完全转化为沉淀。
该沉淀经干燥后得到nmolFeO·FeyCrxO3。
不考虑处理过程中的实际损耗,下列叙述正确的是____。
a.消耗硫酸亚铁铵的物质的量为1.5nmol
b.处理废水中的Cr2O72-的物质的量为0.25nmol
c.反应中发生转移的电子数为3nxmol
16.某中学化学兴趣小组为了调查当地某一湖泊的水质污染情况,在注入湖泊的3个主要水源的入口处采集水样,并进行了分析,给出了如下实验信息:
其中一处水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E为五种常见化合物,均由下表中的离子形成,其中C中有两种阳离子:
为了鉴别上述化合物。
分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中都能产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出C、D的化学式:
C________,D________。
(2)将含1molA的溶液与含lmolE的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为___________。
(3)在A溶液中加入少量澄清石灰水,其离子方程式为_____________________________。
(4)若向含溶质lmol的C溶液中逐滴加入Ba(OH)2溶液,生成沉淀质量最大为_______g。
17.有一无色溶液100mL,其中可能含有Fe3+、Al3+、Na+、Mg2+、Cu2+、NH
、K+、CO
、SO
等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下图所示。
请回答下列问题:
(1)焰色反应是________(填“物理”或“化学”)变化;实验②中经过滤得到白色沉淀,该沉淀如何洗涤?
______________________________________________________________。
(2)原溶液中一定存在的离子有________(写化学式),可能存在的离子有________。
(3)实验③中产生的白色沉淀的成分可能是_________________________________。
(4)若溶液中K+物质的量为0.04mol,则c(Na+)=________。
18.将一定量的KClO3与MnO2的混合物溶于0.1L10mol/L的浓盐酸中加热,若不考虑溶液体积的变化,待充分反应后混合物无剩余且测得溶液中K+浓度为0.2mol/L,将逸出的所有气体通过饱和食盐水再干燥后发现其体积约为1.568L(标况下),而饱和食盐水增重7.3g,请计算下列问题,并写出计算过程:
(1)混合物中MnO2的质量是多少_________