现行人教社高中化学必修一 第五章3.docx
《现行人教社高中化学必修一 第五章3.docx》由会员分享,可在线阅读,更多相关《现行人教社高中化学必修一 第五章3.docx(12页珍藏版)》请在冰豆网上搜索。
现行人教社高中化学必修一第五章3
第三节 元素周期律
我们在碱金属和卤素的学习中,已经意识到元素之间存在着某种内在联系,现在就来研究元素之间究竟存在着什么内在联系,以及这种联系的本质是什么。
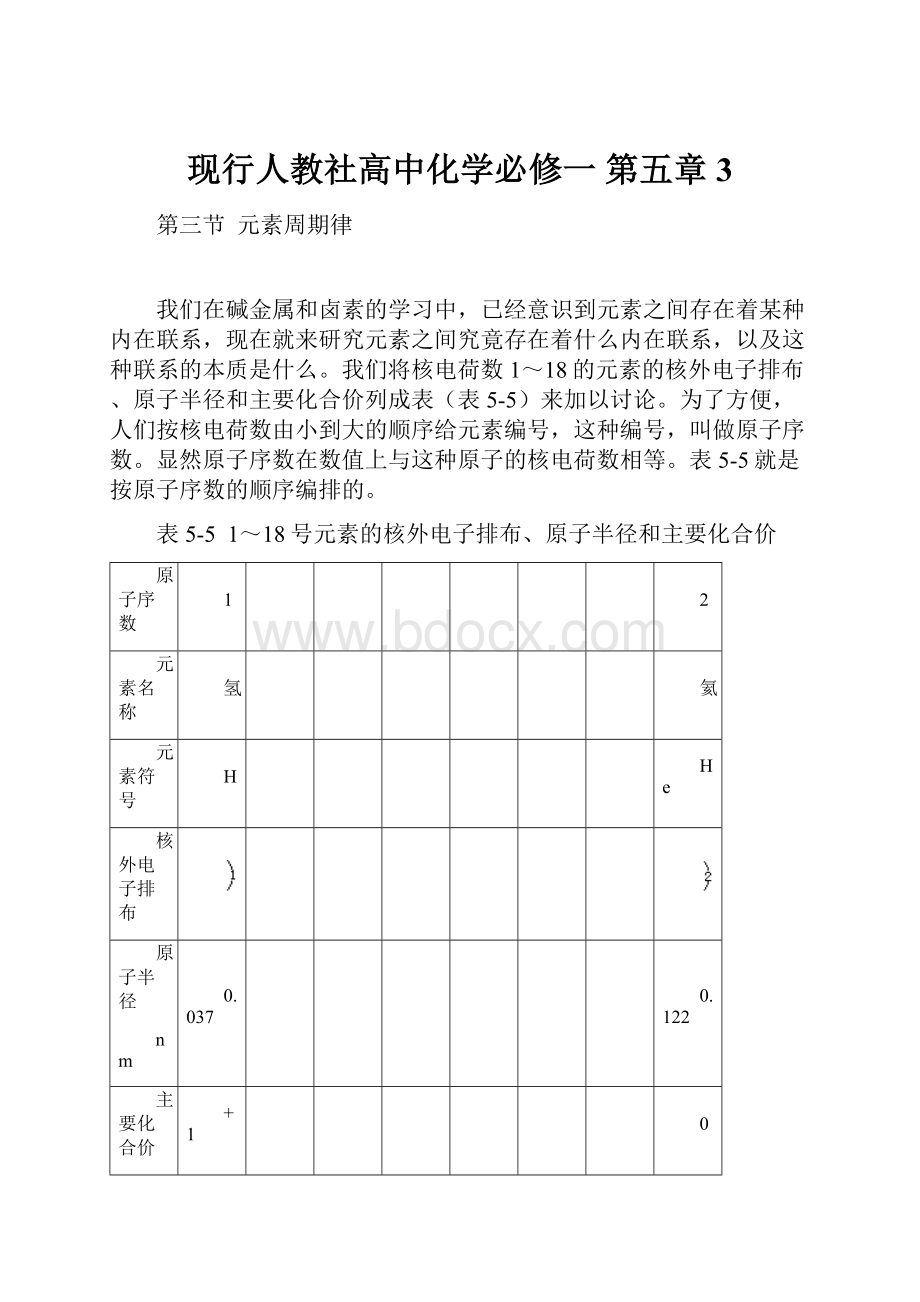
我们将核电荷数1~18的元素的核外电子排布、原子半径和主要化合价列成表(表5-5)来加以讨论。
为了方便,人们按核电荷数由小到大的顺序给元素编号,这种编号,叫做原子序数。
显然原子序数在数值上与这种原子的核电荷数相等。
表5-5就是按原子序数的顺序编排的。
表5-5 1~18号元素的核外电子排布、原子半径和主要化合价
原子序数
1
2
元素名称
氢
氦
元素符号
H
He
核外电子排布
原子半径
nm
0.037
0.122
主要化合价
+1
0
原子序数
3
4
5
6
7
8
9
10
元素序数
锂
铍
硼
碳
氮
氧
氟
氖
元素符号
Li
Be
B
C
N
O
F
Ne
核外电子排布
原子半径
nm
0.125
0.089
0.082
0.077
0.075
0.074
0.071
0.160
主要化合价
+1
+2
+3
+4
-4
+5
-3
-2
-1
0
原子序数
11
12
13
14
15
16
17
18
元素名称
钠
镁
铝
硅
磷
硫
氯
氩
元素符号
Na
Mg
Al
Si
P
S
Cl
Ar
核外电子排布
原子半径
nm
0.186
0.160
0.143
0.117
0.110
0.102
0.099
0.191
主要化合价
+1
+2
+3
+4
-4
+5
-3
+6
-2
+7
-1
0
讨论
1.根据表5-5,你认为随着原子序数的递增,原子的核外电子层排布呈现什么规律性的变化?
将讨论的结果填在表5-6中。
表5-6 随着原子序数的递增,原子核外电子层排布变化的规律性
原子序数
电子层数
最外层电子数
达到稳定结构时的最外层电子数
1~2
1
1──→2
2
3~10
11~18
结论:
随着原子序数的递增,元素原子的最外层电子排布呈现______变化。
讨论
2.根据表5-5,你认为随着原子序数的递增,元素原子半径呈现什么规律性的变化(稀有气体元素暂不考虑)?
将讨论的结果填在表5-7中,并与图5-5做对照。
表5-7 随着原子序数的递增,元素原子半径变化的规律性
原子序数
原子半径的变化
3~9
0.152nm────────→0.071nm
大────────→小
11~17
结论:
随着原子序数的递增,元素原子半径呈现____的变化。
资料
稀有气体元素原子半径跟相邻的非金属元素相比显得较大,这是由于它们测定的根据跟其他元素不同。
讨论
3.根据表5-5,你认为随着元素原子序数的递增,元素的化合价呈现什么规律性的变化?
将讨论的结果填入表5-8。
表5-8 随着原子序数的递增,元素化合价变化的规律性
原子序数
化合价的变化
1~2
+1────────────→0
3~10
+1──────→+5
-4────→-1──→0
11~18
结论:
随着原子序数的递增,元素化合价呈现________的变化。
从上述讨论中,我们认识到随着原子序数的递增,元素原子的电子层排布,原子半径和化合价均呈现周期性的变化。
我们知道,元素的化学性质是由原子结构决定的,那么,我们是否可以认为元素的金属性与非金属性也将随着元素原子序数的递增而呈现周期性的变化?
下面通过实验来研讨这个问题。
元素金属性的强弱,可以从它的单质跟水(或酸)反应置换出氢的难易程度,以及它的氧化物的水化物——氢氧化物的碱性强弱来判断。
如果元素的单质跟水(或酸)反应置换出氢容易,而且它的氢氧化物碱性强,这种元素金属性就强,反之则弱。
元素非金属性的强弱,可以从它的氧化物的水化物的酸性强弱,或跟氢气生成气态氢化物的难易程度以及氢化物的稳定性来判断。
如果元素的氧化物的水化物的酸性强,或者它跟氢气生成气态氢化物容易且稳定,这种元素的非金属性就强,反之则弱。
下面按照这个标准,研究11~18号元素的金属性、非金属性的变化情况。
第11号元素是钠。
我们知道,钠是一种非常活泼的金属,能与冷水迅速发生反应,置换出水中的氢。
钠的氧化物的水化物——氢氧化钠显强碱性。
第12号元素镁,它的单质与水反应的情况怎样呢?
【实验5-1】取两段镁带,用砂纸擦去表面的氧化膜,放入试管中。
向试管中加3mL水,并往水中滴2滴无色酚酞试液。
观察现象。
然后,加热试管至水沸腾。
观察现象。
实验表明,镁与冷水反应很微弱,说明镁不易与冷水反应,但能跟沸水迅速地反应并产生气泡。
反应后的生成物使无色酚酞试液变红。
这个反应的化学方程式为:
Mg+2H2O
Mg(OH)2+H2↑
镁能从水中置换出氢,说明它是一种活泼金属。
但从镁与冷水反应比较困难,以及反应所生成的Mg(OH)2的碱性比NaOH弱的事实来看,表明镁的金属性不如钠强。
我们再来研究第13号元素铝。
【实验5-2】取一小片铝和一小段镁带,用砂纸擦去表面的氧化膜,分别放入两支试管,再各加入2mL1mol/L盐酸。
观察发生的现象。
实验表明,镁、铝都能跟盐酸起反应,置换出H2,这两个反应的化学方程式为:
Mg+2HCl=MgCl2+H2↑
2Al+6HCl=2AlCl3+3H2↑
实验还表明铝与酸的反应不如镁与酸的反应剧烈。
也就是说,铝的金属性不如镁强。
下面,我们再来研究铝的氧化物的性质。
在一定的条件下,Al2O3既能与盐酸作用,又能与NaOH溶液反应。
反应的化学方程式为:
像Al2O3这类既能与酸起反应生成盐和水,又能与碱起反应生成盐和水的氧化物,叫做两性氧化物。
Al2O3对应的水化物是Al(OH)3(氢氧化铝),它的性质又怎样呢?
【实验5-3】取少量1mol/LAlCl3溶液注入试管中,加入3mol/LNaOH溶液至产生大量Al(OH)3白色絮状沉淀为止。
将Al(OH)3沉淀分盛在两支试管中,然后在两支试管中分别加入3mol/LH2SO4溶液和6mol/LNaOH溶液。
观察现象。
我们看到,两支试管中的白色沉淀都消失了。
这说明,Al(OH)3既能跟酸反应,又能跟碱反应。
上述反应的化学方程式为:
AlCl3+3NaOH=Al(OH)3↓+3NaCl
2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O
Al(OH)3+NaOH=NaAlO2+2H2O
像Al(OH)3这样既能跟酸起反应,又能跟碱起反应的氢氧化物,叫做两性氢氧化物。
Al2O3和Al(OH)3既然呈现两性,这说明铝虽然是金属,但已表现出了一定的非金属性。
第14号元素硅是非金属。
硅的氧化物——SiO2是酸性氧化物,它的对应水化物是原硅酸(H4SiO4)。
H4SiO4是一种很弱的酸。
硅只有在高温下才能跟氢气反应生成少量气态氢化物——SiH4。
第15号元素磷是非金属。
磷的最高价氧化物是P2O5,它的对应水化物是磷酸(H3PO4),H3PO4属于中强酸。
磷的蒸气和氢气能起反应生成气态氢化物——PH3,但相当困难。
第16号元素硫是比较活泼的非金属。
硫的最高价氧化物是SO3,SO3的对应水化物是H2SO4。
H2SO4是一种强酸。
硫在加热时能跟氢气起反应生成气态氢化物——硫化氢(H2S)。
H2S不很稳定,在较高温度时可以分解。
第17号元素氯是很活泼的非金属。
氯的最高价氧化物是Cl2O7,Cl2O7的对应水化物是高氯酸(HClO4),它是已知酸中最强的一种酸。
氯气跟氢气在光照或点燃时就能发生爆炸而化合,生成的气态氢化物是HCl,HCl十分稳定。
第18号元素氩是一种稀有气体元素。
现将以上研究的结论归纳于表5-9和表5-10中。
表5-9 钠、镁、铝的性质比较
性质
Na
Mg
Al
单质与水(或酸)的反应情况
与冷水剧烈反应放出氢气
与冷水反应缓慢,与沸水迅速反应,放出氢气,与酸剧烈反应放出氢气
与酸迅速反应放出氢气
最高价氧化物对应水化物的碱性强弱
NaOH强碱
Mg(OH)2中强碱
Al(OH)3两性氢氧化物
表5-10 硅、磷、硫、氯的性质比较
性质
Si
P
S
Cl
非金属单质与氢气反应的条件
高温
磷蒸气与氢气能反应
须加温
光照或点燃时发生爆炸而化合
最高价氧化物对应水化物的酸性强弱
H4SiO4弱酸
H3PO4中强弱
H2SO4强酸
HClO4最强酸
综上所述,我们可以从11~18号元素性质的变化中得出如下的结论:
如果我们对其他元素也进行同样的研究,也会得出类似的结论:
元素的金属性和非金属性随着原子序数的递增而呈现出周期性的变化。
通过以上事实,我们可以归纳出一条规律,就是元素的性质随着元素原子序数的递增而呈周期性的变化。
这个规律叫做元素周期律。
元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。
习 题
一.填空题
1.用元素符号回答原子序数11~18的元素的有关问题:
(1)除稀有气体外,原子半径最大的是______;
(2)最高价氧化物的水化物碱性最强的是______;
(3)最高价氧化物的水化物呈两性的是________;
(4)最高价氧化物的水化物酸性最强的是_______;
(5)能形成气态氢化物且最稳定的是_________。
2.X和Y是原子序数小于18的元素,X原子比Y原子多1个电子层;X原子的最外电子层中只有1个电子;Y原子的最外电子层中有7个电子。
这两种元素形成的化合物的化学式是________。
3.A、B、C三种元素原子的核电荷数在10~18之间,它们可以分别形成A3+、B2-、C-;B2-的M层中有8个电子;在A、B形成的化合物里,A的质量分数为36%;C-具有Ar的电子层结构。
这三种元素彼此间能两两形成的化合物有_______。
二.选择题
1.元素的性质随着原子序数的递增呈现周期性变化的原因是 [ ]。
A.元素原子的核外电子排布呈周期性变化
B.元素原子的电子层数呈周期性变化
C.元素的化合价呈周期性变化
D.元素原子半径呈周期性变化
2.在下列元素中,最高正化合价数值最大的是 [ ]。
A.Na B.P
C.Cl D.Ar
3.在下列元素中,原子半径最小的是 [ ]。
A.N B.F
C.Mg D.Cl
4.原子序数从3~10的元素,随着核电荷数的递增而逐渐增大的是[ ]。
A.电子层数 B.电子数
C.原子半径 D.化合价
5.元素X原子的最外层有3个电子,元素Y原子的最外层有6个电子,这两种元素形成的化合物的化学式可能是 [ ]。
A.XY2 B.X2Y3
C.X3Y2 D.XY2
6.某元素最高价氧化物对应水化物的化学式是H2XO3,这种元素的气态氢化物的化学式为 [ ]。
A.HX B.H2X
C.XH3 D.XH4
7.某元素R的最高价氧化物化学式为RO2,且R的气态氢化物中氢的质量分数为25%,此元素是 [ ]。
A.C B.N
C.Si D.S
三.有X、Y、Z三种元素,X、Y原子的最外层电子数相同;Y、Z原子的电子层数相同;X与Y可形成YX2和YX3化合物,Y原子核内的质子数是X的2倍,X与Z可形成化合物Z2X5。
X、Y、Z各是什么元素?
分别画出它们的原子结构示意图