植物内生菌分离处理方法.docx
《植物内生菌分离处理方法.docx》由会员分享,可在线阅读,更多相关《植物内生菌分离处理方法.docx(24页珍藏版)》请在冰豆网上搜索。
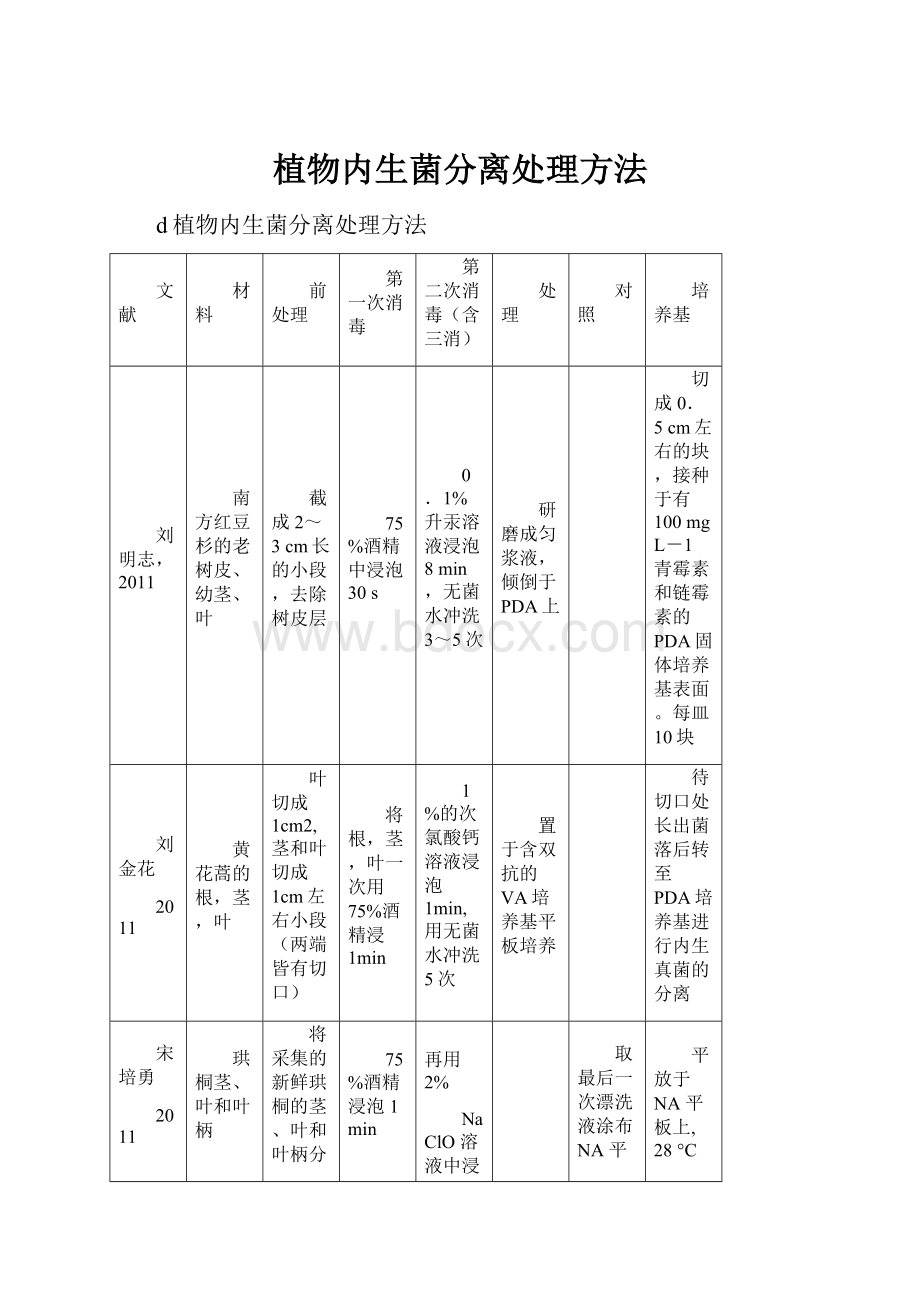
植物内生菌分离处理方法
d植物内生菌分离处理方法
文献
材料
前处理
第一次消毒
第二次消毒(含三消)
处理
对照
培养基
刘明志,2011
南方红豆杉的老树皮、幼茎、叶
截成2~3cm长的小段,去除树皮层
75%酒精中浸泡30s
0.1%升汞溶液浸泡8min,无菌水冲洗3~5次
研磨成匀浆液,倾倒于PDA上
切成0.5cm左右的块,接种于有100mgL-1青霉素和链霉素的PDA固体培养基表面。
每皿10块
刘金花
2011
黄花蒿的根,茎,叶
叶切成1cm2,茎和叶切成1cm左右小段(两端皆有切口)
将根,茎,叶一次用75%酒精浸1min
1%的次氯酸钙溶液浸泡1min,用无菌水冲洗5次
置于含双抗的VA培养基平板培养
待切口处长出菌落后转至PDA培养基进行内生真菌的分离
宋培勇
2011
珙桐茎、叶和叶柄
将采集的新鲜珙桐的茎、叶和叶柄分
别用流水冲洗,风干表面水分,剪成小块或小段,
无菌水漂洗2次
75%酒精浸泡1min
再用2%
NaClO溶液中浸泡3min,转入75%酒精中浸泡30s,
接着用无菌水漂洗3次,
取最后一次漂洗液涂布NA平板作为对照
平放于NA平板上,28°C培养2−3d
孙传伯2011
台湾7303毛豆全株
采回的样本用自来水洗净,并用无菌纸吸干水分,并用无菌纸吸干水分,切取支根110cm长的小段,须根切成115cm的小块
用75%酒精浸泡5min、7min、10min
分别用0.1%升汞溶液处理4min、6min、8min进行表面灭菌,此试验分别重复3次。
最后用无菌水冲洗4次,。
最后用无菌水冲洗4次
将组织块在研钵中充分研磨成匀浆
最后一次冲洗液涂3种不同培养基平板,26~28e下培养2~3d,筛选出最佳消毒时间和培养基,将表面消毒彻底棉花根部切块放入灭菌研钵中用无菌水冲洗4次,取上清液涂抹于培养基上。
以无菌水冲洗为对照试验。
取上清匀浆涂抹于3种不同培养基上,取匀浆涂布于不同培养基平板,每浓度重复3次,然后将培养皿置于26~28e恒温箱中培养2~3d,观察培养出的菌落形态
张鑫
2011
植物圣罗勒的健康
叶子
将叶子用流水冲洗10min
1%的次氯酸钠中浸泡10min
0.02mol/L、pH7.0的无菌磷酸钾缓冲液(PB)漂洗
4次
加无菌水将材料研磨
涂布培养
李铭,
2011
石耳目地衣
为了诱导产孢,黑化菌株在光照/黑暗(12h∶12h)条件下,于2%的PDA
培养基上,18℃下培养3个月
刘杰凤
2011
健康的小白菜,染病的小白菜根,茎,叶
流水冲洗干净,剪成小段
75%酒精中浸泡3min
10%次氯酸钠浸泡茎为8min,根和叶由于气孔较茎大,浸泡5min即可,然后用无菌水浸泡多次,每次3min
无菌条件下用适量的
PBS
缓冲液捣碎
以最后一次的漂洗液作对照
,30℃
下培养
一个星期
搅拌后静置3min,取上清液0.5mL分别涂布于分离培养基平板上,每种材料做3次平行
朱士茂
2011
新采集的银杏枝条,叶子和根
在自来水中冲洗干净,然后将枝条和根截成3-4cm长,将叶子和叶柄分开,分别将根,枝,叶放在不同的灭菌后的广口瓶中
(一),根的表面灭菌:
0.1%的土温20消毒1min,无菌蒸馏水冲洗2次。
(二)枝,叶和叶柄:
75%的乙醇消毒30s,无菌蒸馏冲洗3次
(一),根:
75%的乙醇消毒30s,无菌蒸馏水冲洗2次,0.1%升汞消毒5min,无菌蒸馏水冲洗5次。
(二)枝,叶和叶柄:
0.1%升汞消毒7min,无菌蒸馏水冲洗5次
茎,将其表皮剥离,用无菌小刀纵切表皮取其中间的部分,然后将其切成0.5cm×0.5cm大小
叶和叶柄,用研钵将叶磨碎(内放石英砂和生理盐水)然后用无菌移液管吸取0.2ml放入培养皿中
①将以上接入的每种平皿按相同的方法接入5min后用无菌镊子取出;②用无菌蒸馏水冲洗已表面灭菌后的材料,然后将此液体移入培养基中,培养观察。
KB培养基:
PL培养基:
PDA培养基:
肖淑贤
2011.
长势好、无病害的植株
在自来水中冲洗干净
采用升汞、乙醇、H2O2、次氯酸钠等表面消毒剂进行消毒,无菌水冲洗
直接切取植物组织或榨取植物组织汁液稀释
王剑峰
2011
取生长15天马铃薯
无表面灭菌方法
马铃薯内生菌单菌落的分离取生长15天马铃薯LK99组培苗,剪成长度约1.0cm的带腋芽茎段接种于PSA培养基上,分别于光下(28℃、2200Lx、16hr光/8hr黑暗)或28℃暗培养,3天后光下和黑暗条件下组培苗周围的培养基上出现黄色菌块,挑取黄色菌块,用稀释涂布法[66]分离单菌落。
李晓红
不同表面消毒方法对核桃叶内生菌分离效果的比较
内容残缺)
熊亚南
2011
刺五加植株流水冲洗去土,根,茎,根茎等部
流水冲洗去土
按根,茎,根茎等部进行分割,每段长10cm左右,按下列程序表面消毒:
无菌水冲洗→95%酒精漂洗1min→6%的Naclo浸3min
→无菌水漂洗3次
进行分割,每段长10cm左右
同样处理的材料不做切割直接滚印于对照平板,并去最后一次漂洗的无菌水平板涂布,置相同条件下培养,无菌长出即为表面消毒彻底。
×0.4cm的薄片,然后将薄片直插入和水平贴附两种方式置于分离平板上,25-28℃暗箱培养,带材料边缘有菌苔长出后转接与纯化平板划线法分离纯化,镜检验纯后转接到斜面。
邓正山
2012
健康的大蒜鳞茎
用纯净水冲洗干净
依次用体积分数75%的乙醇浸泡3min
0.1%的氯化汞表面消毒15s,再用无菌水漂洗5次
杨明琰
2012
新鲜的杜仲
将新鲜植物材料用自来水冲洗外表面直至干净,晾干。
用无菌刀将样品切割成3cm左右的小段
75%的酒精溶液中浸泡6min,用无菌水冲洗样品表面3~5次
再在4%的次氯酸钠溶液中浸泡3min,用无菌水冲洗样品表面3~5次
用镊子及解剖取其韧皮部,切除两端后切成大约1cm×0.5cm的小段
①漂洗液检验法:
把最后一次漂洗材料的无菌水涂布于PDA平板上,28℃恒温培养。
②组织印迹法:
将上述表面灭菌处理的完整枝段压入PDA平板内,使表面灭菌材料与培养基接触30min后,移去植物材料,28℃恒温培养。
③组织压入法:
将灭菌材料不经切割直接贴于PDA培养基表面,28℃恒温培养
将小段,贴于PDA培养基的表面,每皿放3块材料,于28℃恒温培养箱内培养5~10d。
待菌丝从植物组织长出后,从边缘挑取菌丝移至另一PDA平板上进行纯化
胡秀荣
2011
采集健康的柑橘植株
放线菌
:
先在自来水下冲洗掉样品表面的泥土,再用超声波清洗
放线菌:
然后用99%乙醇处理1min,3%次氯酸钠处理5min
放线菌:
最后用99%乙醇再处理30s
放线菌:
灭菌好的材料用无菌刀切成1cm×1cm小块,置于分离培养基表面
放线菌:
将最后一次处理植物样品的清洗液涂在ISP2培
养基上,用以检测表面灭菌的效果
熊党生
2012
取新鲜健康的葛根的根、茎、叶
分别用水冲洗干净,用滤纸吸干水分
无菌水冲洗2遍,先用体积分数75%酒精浸泡3~5min(叶子3min,茎4min,根5min),无菌水冲洗3~4遍
用0.1%升汞浸泡2~4min(叶子2min,茎3min,根4min),无菌水冲洗4~5次
在无菌的条件下,用灭过菌的手术剪刀将植物根、茎、叶剪成小段,从中间剪开后,分别置于含有葛根浸出夜的PDA琼脂培养基上,置于生化培养箱中培养一段时间
将上述经过表面消毒后未作任何处理的材料直接置于平板中,27℃培养,结果材料周围未见任何菌长出,证明所分离的菌株为葛根的内生菌。
挑取内生细菌到牛肉膏蛋白胨培养基中,挑取内生真菌的菌丝到PDA培养基中纯化数次,将纯化好的菌种接种到斜面培养基上保存备用
张彦涛
2012
白蜡、茅草、射干、罗布麻、蓼草、胡杨、怪柳。
取采集的新鲜样品,用蒸馏水将植物表面洗净
干后分别取其根、茎、叶,在75%乙醇消毒液中浸泡3~5min
3%次氯酸钠浸泡5min,75%乙醇浸泡5min。
最后用无菌水冲洗3~4次
将样品在灭菌的研钵中研磨,加适量无菌生理盐水研磨至匀浆状
最后一次冲洗的无菌水涂布平板做空白对照
(分离培养基)取1mL液体分别按照10-1、10-2、10-3、10-4、10-5、10-6、10-7依次梯度稀释,并分别涂布平板,37℃恒温培养2d。
红树林内生放线菌
文件不完整
李雁津2012
完整交城骏枣,
用自来水清洗表面后再用无菌水冲洗,晾干称重后浸入30%的乙醇中3min
浸入2.6%的次氯酸钠溶液中5min
浸入30%的乙醇中30s进行表面消毒,最后用无菌水冲洗5次,晾干
用无菌剪刀将枣果去皮,果肉剪碎,加入无菌生理盐水研磨
取最后一次淋洗水150微升涂于LB平板上,28°C培养72小时,检测表面灭菌效果。
将碾磨液分别涂布于胰酶大豆琼脂培养基(TSA)、任氏培养基(R2A)、金氏培养基(KMB)、肉汁胨培养基(BPA)、LB培养基、酵母膏蛋白胨琼脂培养基(YPM)、无氮培养基,28°C培养箱中倒置培养3-7天。
张慧茹
2012
挑选新鲜、生长旺盛的葎草,用保鲜袋包装
用自来水冲洗干净,置无菌操作台中紫外灯照射5min后晾干。
用75%酒精进行全草消毒1min
升汞消毒时间分别为:
根65s、茎50s、叶35s。
再用无菌水冲洗干净
将上述组织块剪成0.5cm×0.5cm大小
分别取各种组织最后一次冲洗的无菌水,涂布于营养琼脂平板上;将表面消毒处理过的完整的根、茎、叶各组织贴压在PDA培养基平板内;在超净工作台内放置一敞开的PDA平板。
将上述3种对照平板置于28℃恒温培养箱内培养7d,用于检查表面灭菌效果。
置于马铃薯葡萄糖琼脂(PDA)培养基中,28℃恒温培养箱中培养约5~7d,待内生菌长出后,挑取单个菌落进行纯化,PDA培养基斜面保菌。
李勇
2011
健康人参
自来水将人参根表面粘连的土壤清洗,再用无菌水冲洗1次
依次用70%乙醇浸泡3min
2.6%次氯酸钠浸泡5min,再用70%乙醇浸泡30s。
最后用无菌水淋洗5次
将无菌人参根剪成碎块,放入无菌研钵中,加入适量无菌石英砂和生理盐水(0.85%),充分研磨,梯度稀释1万倍
取最后一次淋洗液150μL涂平板,28℃培养3d,观察平板上是否有菌长出
。
取200μL稀释液至细菌分离培养基,涂布均匀。
25℃恒温培养7d,记录每个平板上的菌落形态及菌落数,纯化培养。
林娜
2012
随机挑选100g左右根、茎、叶、果实
洗净风干
75%乙醇分别浸泡2、3、1、1min,无菌水冲洗6次,无菌滤纸吸干
0.1%HgCl2分别浸泡50、60、40、40s,无菌水冲洗6次
加无菌石英砂研磨,梯度稀释至10-3,每一稀释梯度涂布10个分离平板
每个样品都取最后一次无菌水洗液涂于相应平板上,以检测表面消毒是否彻底
定期观察分离平板,挑取单菌落划线纯化于牛肉膏蛋白胨斜面上。
张鑫
2012
无纹背苔藓
取苔藓叶片用无菌水洗净
紫外先线(功率18QW)照射6min(苔藓叶正反面个照射30min)灭菌
然后用75%的酒精漂洗15min,用无菌水冲洗3次,再利用酒精灯火焰进行表面灭菌
将验证表面无菌的叶子于无菌碾钵中碾磨,用无菌水梯度稀释
将表面灭菌的叶子直接贴于固体PDA和LB培养基表面,28℃培养3-4h,观察叶子周围是否长菌,以检验鲜苔表面灭菌是否彻底。
各取200微升稀释液涂布于固体PDA和LB培养基进行内生菌的分离。
根据菌落形态,颜色等特征初步判断处分理出菌落的中类,并按常规的方法挑取菌落保存。
蓝江林
2012
香蕉,处于成果期的健株和病株各1株
将样品用自来水冲洗干净,吸干水分,称重
先用75%酒精浸泡40s左右,用无菌水充分淋洗
再用10%KClO3溶液浸8min,无菌水反复淋洗,无菌滤纸吸干
根部选取根尖和根基部分;假茎部从茎基部到茎顶端等分为5段,每段随机取样;叶片根据生长的位置分为上部、中部和下部叶片,每部分取叶基部中部和叶尖部分
以组织消毒后无菌水淋洗的最后淋洗液作为对照,涂NA平板培养,如长菌落,则判定研磨液所培养的菌落为非内生菌,丢弃;若对照中无菌落,则基本可判定研磨液中长出的菌落可能是内生菌,纯化后保存待用。
在无菌研钵中充分研磨匀浆,无菌水梯度稀释至102、103和104,取200μL稀释液涂布于NA平板上,每梯度3个重复,静置20min后,30℃倒置暗培养24~48h。
史应武
2012
新疆醉马草
将醉马草的根、茎、叶(包括叶鞘)、种子分别用自来水冲洗干净,
再用无菌水冲洗一次;在75%的0乙醇浸泡30s将醉马草的根、茎、叶(包括叶鞘)、种子分别用自来水冲洗干净
然后在0.1%的升汞中浸泡1min;无0菌水淋洗5次,在无菌条件下晾干
取最后一次淋洗水涂于LB平板上,28℃培养72h,检测表面灭菌效果
马赟
2012
阿尔泰虫草
取阿尔泰虫草用水粗洗
再用乙醇擦洗2min
然后在0.1%氯化汞溶液中消毒3min,无菌水冲洗4~6次
将虫草切成0.1~0.5cm长的小段
将小段接到马铃薯培养基(PDA)、LB培养基培养
刘明志。
南方红豆杉产紫杉醇内生真菌的分离。
热带亚热带植物学报,2011,19(4):
360~364
剥取红豆杉的老树皮,截成2~3cm长的小段,去除树皮层,先用75%酒精中浸泡30s,无菌水冲洗3次,再用0.1%升汞溶液浸泡8min,无菌水冲洗3~5次。
用无菌滤纸吸干表面水分,用无菌解剖刀将小段切成0.5cm左右长的小块,接种于加有100mgL-1青霉素和链霉素的PDA固体培养基表面。
每皿放置10块,依次编号,置于25℃恒温培养箱中培养。
幼茎内生菌的分离方法同上,将幼茎切成1cm长的小段,以伤口断面垂直接种于PDA固体培养基上培养。
红豆杉叶片内生菌的分离采用两种方法,第一种方法与树皮内生菌的分离方法类似,分离时将叶片切成2至3段,接种于PDA固体培养基上;第二种方法是将叶片消毒后用无菌研钵研磨成匀浆液,然后将研磨液倾倒于PDA固体培养基上,置于25℃恒温培养箱中培养。
1刘金花。
黄花蒿内生菌的分离与初步鉴定。
2011,33(4):
27~30
黄花蒿的根,茎,叶,叶切成1cm2,茎和叶切成1cm左右小段(两端皆有切口),将根,茎,叶一次用75%酒精浸1min,再用1%的次氯酸钙溶液浸,置于含双抗的VA培养基平板培养泡1min,用无菌水冲洗5次。
待切口处长出菌落后转至PDA培养基进行内生真菌的分离。
2宋培勇,珙桐内生细菌的分离鉴定及系统发育分析,2011,38
(1):
8−13
将采集的新鲜珙桐的茎、叶和叶柄分别用流水冲洗,风干表面水分,剪成小块或小段,无菌水漂洗2次,75%酒精浸泡1min,再用2%NaClO溶液中浸泡3min,转入75%酒精中浸泡30s,接着用无菌水漂洗3次,平放于NA平板上,28°C培养2−3d。
取最后一次漂洗液涂布NA平板作为对照。
内生菌分离和纯化。
将NA平板上组织块下或周缘长出的菌落或菌苔划线稀释分离1-2次直到获得纯培养
3孙传伯。
毛豆内生菌的分离及生物学特征观察。
(2011)10-0026-02
(1)从供试材料上取植物组织1.0g,用70%(体积分数)酒精浸泡30s,用无菌水漂洗后,置于1%(体积分数)次氯酸钠水溶液中表面消毒3-5min(其中叶片和花消毒3min,茎和果消毒5min),再取出植物组织用无菌水冲洗3次.样品晾干后分别置于无菌研钵中加5mL无菌水研磨成浆状,静置10-15min后,每一样品各取上层澄清液50LL分别涂布在培养基(NA、KB和TSA)平板上,每种培养基涂布3皿,28e黑暗培养48-72h,计算每一平板的菌落数.表面消毒后,在研磨前取50LL无菌水冲洗液涂布平板;或是通过组织印迹试验,将最后一次清洗的植物组织在培养基平板上印一下,按上述条件培养48h,观察有无菌落产生,以验证采用该消毒方法是否能杀死供试材料表生微生物.根据菌落形态、颜色等挑取单菌落,划线分离、纯化后保存、备用.在融化并冷却至45e的NA培养基中加入待测病原菌的悬浮液,其中每100mL培养基加1mL细菌悬浮液,倒入平板.采用点接法将内生菌接种于NA平板上,每个平板上等距离点接5株不同的内生细菌菌株,每组进行2次平行试验,在恒温箱中28e下培养,2d后观察有无抑菌圈生成.
(2)采用组织切块法,进行表面消毒,再用灭菌的蒸馏水清洗,检验灭菌效果。
内生细菌的分离前,将采回的样本用自来水洗净,并用无菌纸吸干水分,切取支根110cm长的小段,须根切成115cm的小块,进行组织表面清毒,棉花根部切段后经无菌水冲洗3次,用75%酒精浸泡5min、7min、10min后,然后分别用011%升汞溶液处理4min、6min、8min进行表面灭菌,此试验分别重复3次。
最后用无菌水冲洗4次,最后一次冲洗液涂3种不同培养基平板,26~28e下培养2~3d,筛选出最佳消毒时间和培养基,将表面消毒彻底棉花根部切块放入灭菌研钵中用无菌水冲洗4次,取上清液涂抹于培养基上。
以无菌水冲洗为对照试验。
培养2d后观察灭菌效果,直到彻底表面灭菌,再进行最后的内生菌分离。
将组织块在研钵中充分研磨成匀浆,取上清匀浆涂抹于3种不同培养基上,取匀浆涂布于不同培养基平板,每浓度重复3次,然后将培养皿置于26~28e恒温箱中培养2~3d,观察培养出的菌落形态。
(3)再将材料放进经过紫外线消毒的超净工作台内,切割成小段,按常规无菌操作进行表面消费处理:
75%乙醇浸泡3miny无菌水冲洗3遍y011%升汞浸泡8miny无菌水冲洗3遍。
将上述处理过的材料经滤纸吸干水分后,在无菌条件下切成015cm@015cm的小块,放置于新鲜的PDA平板培养基上,每个平板放置4块,28e恒温培养3~7d。
待切口边缘长出真菌菌丝,及时转接至新鲜PDA培养基上培养,采用菌丝顶端纯化法逐步纯化。
同时,以消毒后不做切割的材料作为空白对照,同样条件下观察是否有菌长出,结果对照材料周围无任何菌长出,证明表面消费彻底。
212内生真菌的鉴定:
采用真菌学插片培养方法,对分离获得的见血封喉内生真菌进行显微形态特征(菌丝、孢子形态等)的观察、分类鉴定。
分类检索参照文献报道[8]。
213内生真菌的发酵上清液制备:
将分离得到的菌株,切取黄豆粒大小的菌丝块,接种于PDB培养基中。
1L三角瓶装400mL培养液,室温,164r/min振荡培养7d,同时以纯培养基作空白对照。
无菌条件下取发酵液15mL于离心管中,12000r/min离心30min后取上清液,用012Lm微孔滤膜滤过除菌,-20e保存备用。
214抑菌活性测定:
采用杯碟法测定样品抑菌活性。
金黄色葡萄球菌和MRSA采用NA培养基,白色念珠菌采用YPD培养基。
将金黄色葡萄球菌、MRSA和白色念珠菌分别制成一定浓度的菌悬液(1@105~1@107cfu/mL),用棉签将其均匀涂布在供试无菌培养皿中,制成含菌平板,然后在每个平板放入3个牛津杯,分别取样品200微升加入其内,同时以发酵纯培养基作阴性对照。
金黄色葡萄球菌和MRSA在37e下恒温培养,白色念珠菌在28e下恒温培养。
24h后观察结果,测量并记录抑菌圈直径。
每个样品做3个重复,以抑菌圈直径的平均值为试验结果
4张鑫,生菌的分离方法及其次级代谢产物研究,(2011)02-0023-04
内从药用植物圣罗勒的健康叶子上分离出4种内生细菌OS-9、OS-10、OS-11和OS-12。
他们首先将叶子用流水冲洗10min,随后于1%的次氯酸钠中浸泡10min,再用0.02mol/L、pH7.0的无菌磷酸钾缓冲液(PB)漂洗4次,每次洗后取100μL漂洗液转移到装有5mL肉汤培养基的离心管中,经过48h震荡培养(条件是200rpm,28℃),检测样品表面消毒是否彻底。
分离过程为选用紫外线和75%酒精作为表面消毒剂,经过多次消毒,加无菌水将材料研磨后,再将研磨液涂布。
5李铭,石耳目地衣(2011)02-0014-07
无
6刘杰凤,小白菜内生菌的分离及菌核菌拮抗菌的筛选(2011)13-2676-04
健康的小白菜,染病的小白菜。
采回的植株用流水冲洗干净,剪成小段,75%酒精中浸泡3min,再用10%次氯酸钠浸泡一定时间:
茎为8min,根和叶由于气孔较茎大,浸泡5min即可,然后用无菌水浸泡多次,每次3min,表面消毒检测至漂洗液无菌落长出为止,一般为3~4次。
在无菌条件下用适量的PBS缓冲液捣碎,充分搅拌后静置3min,取上清液0.5mL分别涂布于分离培养基平板上,每种材料做3次平行,以最后一次的漂洗液作对照,30℃下培养一个星期。
挑取不同形态的菌落,平板划线进行3~4次的传代纯化、镜检、斜面低温保存。
选取具有明显菌核菌病症的小白菜,采用常规组织分离方法从长菌丝及菌核处取样,接种于PDA培养基中(添加10%的1/3000孟加拉红溶液),30℃培养至长出白色菌丝后,取白色菌丝进行多次划线纯化至纯种,斜面低温保存。
7将朱士茂,银杏内生菌的分离与鉴定2011
新采集的银杏枝条,叶子和根放在自来水中冲洗干净,然后将枝条和根截成3-4cm长,将叶子和叶柄分开,分别将根,枝,叶放在不同的灭菌后的广口瓶中.之后在超净工作台进行消毒。
根的表面灭菌:
0.1%的土温20消毒1min,无菌蒸馏水冲洗2次,75%的乙醇消毒30s,无菌蒸馏水冲洗2次,0