中考化学二模试题及答案.docx
《中考化学二模试题及答案.docx》由会员分享,可在线阅读,更多相关《中考化学二模试题及答案.docx(49页珍藏版)》请在冰豆网上搜索。
中考化学二模试题及答案
2020年中考化学二模试题及答案
一、选择题(培优题较难)
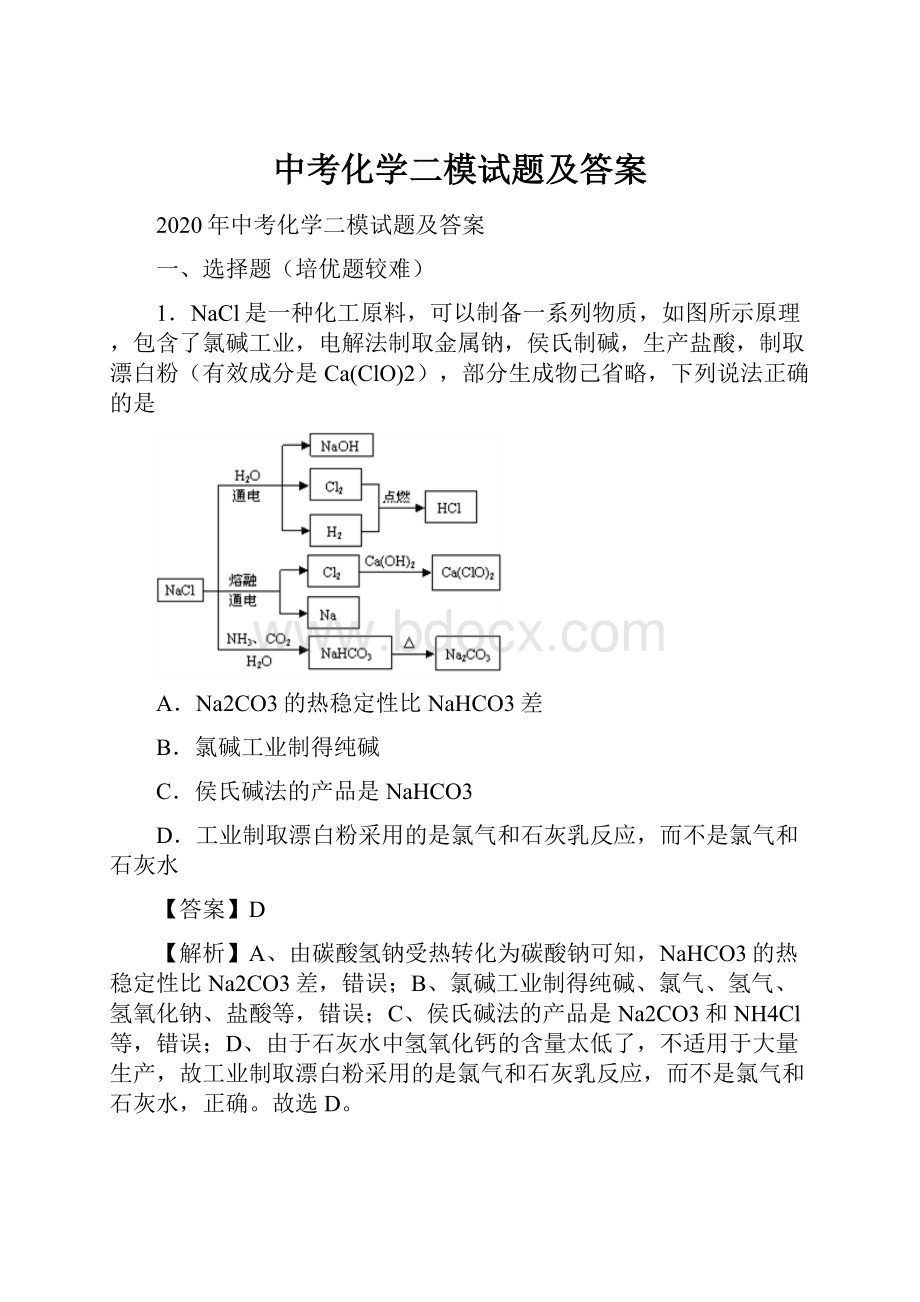
1.NaCl是一种化工原料,可以制备一系列物质,如图所示原理,包含了氯碱工业,电解法制取金属钠,侯氏制碱,生产盐酸,制取漂白粉(有效成分是Ca(ClO)2),部分生成物己省略,下列说法正确的是
A.Na2CO3的热稳定性比NaHCO3差
B.氯碱工业制得纯碱
C.侯氏碱法的产品是NaHCO3
D.工业制取漂白粉采用的是氯气和石灰乳反应,而不是氯气和石灰水
【答案】D
【解析】A、由碳酸氢钠受热转化为碳酸钠可知,NaHCO3的热稳定性比Na2CO3差,错误;B、氯碱工业制得纯碱、氯气、氢气、氢氧化钠、盐酸等,错误;C、侯氏碱法的产品是Na2CO3和NH4Cl等,错误;D、由于石灰水中氢氧化钙的含量太低了,不适用于大量生产,故工业制取漂白粉采用的是氯气和石灰乳反应,而不是氯气和石灰水,正确。
故选D。
2.下列四个图象,分别对应四种操作过程,其中正确的是( )
A.向pH=2的酸溶液中不断加水
B.向NaOH溶液中逐滴加入稀盐酸
C.向一定量的水中持续加入食盐(m表示食盐的质量,A%表示溶质质量分数)
D.等质量的锌、铁与足量的稀硫酸反应,产生氢气的质量随反应时间t的变化
【答案】D
【解析】A.溶液的pH小于7,溶液呈酸性,pH越小,酸性越强;溶液的pH大于7,溶液呈碱性,pH越大碱性越强;pH等于7,溶液呈中性。
向pH=2的酸溶液中不断加水,使溶液的酸性变弱,溶液pH变大,但是始终呈酸性,不会出现pH等于7或pH大于7;B.向NaOH溶液中逐滴加入稀盐酸,开始是氢氧化钠溶液,pH大于7;随酸的加入,pH不断减小,刚好完全反应pH等于7;酸过量时,溶液呈酸性,pH小于7;C.向一定量的水中持续加入食盐,开始,随食盐的溶解,溶质的质量分数增大,饱和后,溶质的质量分数不再改变;D.等质量的锌、铁与足量的稀硫酸反应,锌的活动性比铁强,所以锌先反应完,但是铁比同质量的锌生成氢气多。
选D
点睛:
图像的问题主要是结合化学反应分析图的起点的位置,变化趋势,终点的位置是否正确
3.如图所示A~F是初中化学常见的物质。
图中“→”表示转化关系,“﹣”表示相互能反应(部分物质和反应条件未标出)。
其中A是紫红色金属,B常温下是气体,C是人体胃液中含有的酸。
则下列说法正确的是()
A.E一定是二氧化碳
B.B可能为氢气或一氧化碳
C.该过程中没有涉及到复分解反应
D.D转化为A的反应可以为置换反应
【答案】D
【解析】
A是紫红色金属,那么A是铜;C是人体胃液中含有的酸,那么C是盐酸;B常温下是气体,盐酸能与某物质反应得到B,根据盐酸的性质生成的气体可能是氢气或二氧化碳,但二氧化碳不能转化为铜,故B是氢气;要得到金属铜,除了通过还原反应外,还可通过置换反应得到。
盐酸能转化为D,D能转化为铜,故D可能氯化铜:
盐酸与氧化铜反应生成氯化铜和水,氯化铜和铁反应生成铜和氯化亚铁;盐酸还能转化为E和F,E和F能发生反应,根据盐酸的性质,那么酸能转化为水和二氧化碳,二氧化碳和水反应生成碳酸。
A、E可能是二氧化碳,也可能是水,错误;B、B一定是氢气,错误;C、盐酸与碳酸盐反应转化为水和二氧化碳属复分解反应,错误;D、氯化铜与铁反应转化为铜属置换反应,正确。
故选D。
点睛:
做推断题时首先要找题眼,如物质的颜色,具有特殊性质的物质或特殊的反应条件等,再根据转化关系利用已有知识进行解答。
4.工业上利用生产钛白的副产品硫酸亚铁制备还原铁粉的流程如图
下列说法不正确的是
A.“转化”时在溶液中生成了FeCO3沉淀,该反应的基本反应类型是复分解反应
B.“过滤”后得到的滤液中的溶质只有(NH4)2SO4
C.“干燥”过程中有少量的FeCO3转化为FeOOH和CO2,此时与FeCO3反应的物质有O2和H2O
D.取14.06g还原铁粉(仅含有Fe和少量FexC)在氧气流中充分加热,得到0.22gCO2,另取相同质量的还原铁粉与足量稀硫酸充分反应(FexC与稀硫酸不反应),得到0.48gH2,则FexC的化学式是Fe2C
【答案】B
【解析】
【分析】
【详解】
A、转化时,硫酸亚铁与碳酸铵反应生成碳酸亚铁和硫酸铵,该反应符合“两种化合物互相交换成分生成另外两种化合物”的反应属于复分解反应,不符合题意;
B、硫酸亚铁与碳酸铵反应生成碳酸亚铁和硫酸铵,碳酸铵过量,故“过滤”后得到的滤液中的溶质有硫酸铵和碳酸铵,符合题意;
C、“干燥”过程中有少量的FeCO3转化为FeOOH和CO2,根据质量守恒定律,化学反应前后,元素的种类不变,生成物中含铁、氧、氢、碳元素,故反应物中也应含铁、氧、氢、碳元素,故有水参与了反应,反应后,铁元素化合价升高,故应该有氧化剂参与了反应,故有氧气参与了反应,不符合题意;
D、14.06g还原铁粉(仅含有Fe和少量FexC)在氧气流中充分加热,得到0.22gCO2,根据质量守恒定律,化学反应前后,元素的质量不变,故FexC中的碳元素全部转化到了二氧化碳中,二氧化碳中碳元素的质量为:
,设还原铁粉中铁的质量为x
x=13.44g
故还原铁粉中FexC的质量为:
14.06g-13.44g=0.62g,故FexC中铁元素的质量为:
0.62g-0.06g=0.56g,故56x:
12=0.56g:
0.06g,x=2,故FexC的化学式为:
Fe2C,不符合题意。
故选B。
5.下列除去物质中的少量杂质(括号内为杂质)的方法,正确的是( )
A.CO(CO2)——通过足量的灼热氧化铜
B.MnO2粉末(KCl)——溶解、过滤、洗涤、干燥
C.FeSO4溶液(CuSO4)——加入足量锌粉、过滤
D.Na2SO4溶液(NaCl)——加入适量硝酸银溶液、过滤
【答案】B
【解析】
试题分析:
A、CO能与灼热氧化铜反应生成铜和二氧化碳,二氧化碳不与灼热氧化铜反应,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误.
B、KCl易溶于水,MnO2粉末难溶于水,可采取加水溶解、过滤、洗涤、干燥的方法进行分离除杂,故选项所采取的方法正确.
C、FeSO4溶液和CuSO4均能与锌粉反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误.
D、NaCl能与硝酸银溶液反应生成氯化银沉淀和硝酸钠,能除去杂质但引入了新的杂质硝酸钠,不符合除杂原则,故选项所采取的方法错误.
故选B.
考点:
物质除杂或净化的探究;混合物的分离方法;常见气体的检验与除杂方法;盐的化学性质.
点评:
物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.
6.有Mg、Al、Zn的混合物共7.2g,与足量盐酸反应,生成H2的质量可能是()
A.0.2 gB.0.6gC.0.8gD.0.9g
【答案】B
【解析】
用极限法计算,假设全为Zn,生成氢气的质量为x。
Zn+2HCl==ZnCl2+H2↑
652
7.2gx
x=0.22g
同理,假设全为Mg,生成氢气的质量为y。
可得y=0.6g;假设全为Al,生成氢气的质量为z。
可得z=0.8g。
所以Al、Mg、Zn合金与盐酸反应放出氢气的质量0.8g>m(氢气)>0.22g。
故选B。
7.有NaHCO3与NaCl的混合物20.0g,加热一段时间,得剩余固体16.9g。
向剩余固体中加入足量稀盐酸,并将该反应生成的气体通入澄清石灰水中,得到白色固体15.0g,下列说法正确的是()
A.NaHCO3加热生成CO2的质量为3.1g
B.剩余固体为Na2CO3和NaCl的混合物
C.反应后,所得溶液中NaCl的质量为11.7g
D.原混合物中NaHCO3与NaCl的质量比为63:
37
【答案】D
【解析】
【分析】
混合物20.0g,加热一段时间,得剩余固体16.9g,减少的3.1g是水和CO2的质量,设NaHCO3分解产生CO2的质量为
,分解的NaHCO3的质量为
,
,解得
=2.2g
,解得
=8.4g;
得剩余固体中加入盐酸后产生的二氧化碳,被石灰水吸收,得到碳酸钙15.0g,根据质量守恒定律这些二氧化碳来自NaHCO3,设NaHCO3的质量为
,生成NaCl的质量为
,则有:
,解得
=12.6g,
,解得
=8.775g,则原混合物中NaCl的质量为20g-12.6g=7.4g。
根据以上计算分析作答。
【详解】
A.由计算可知,混合物20.0g,加热一段时间,得剩余固体16.9g,生成CO2的质量是2.2g,不符合题意;
B.原混合物中NaHCO312.6g,加热一段时间,分解的NaHCO38.4g,得剩余固体16.9g中还有NaHCO3,所以剩余固体为NaHCO3、Na2CO3和NaCl的混合物,不符合题意;
C.反应后,所得溶液中NaCl的质量为:
原混合物中NaCl的质量为7.4g和生成NaCl的质量为8.775g之和,共16.175g,不符合题意;
D.原混合物中NaHCO3与NaCl的质量比为12.6g:
7.4g=63:
37,符合题意。
故选D。
8.下列四位同学分别设计实验方案,你认为可行的是( )
A.分离碳酸钙和氯化钠的混合物,先加入足量的水,然后充分溶解、过滤、洗涤、烘干
B.某无色溶液中滴加稀硝酸无明显现象,再加BaCl2溶液,产生白色沉淀,证明无色溶液中一定含有SO42-离子
C.将CO、CO2、N2的混合气体,依次通过浓NaOH溶液,浓硫酸,灼热CuO后(假设每次反应均完全),最后得到N2
D.不用其它试剂就能鉴别NaOH、H2SO4、Mg(NO3)2、FeCl3、NaNO3
【答案】D
【解析】
【分析】
【详解】
A、碳酸钙不溶于水,氯化钠易溶于水,分离碳酸钙和氯化钠的混合物,先加入足量的水,然后充分溶解、过滤、洗涤、烘干得碳酸钙,再将滤液蒸发结晶得氯化钠,选项错误;
B.某无色溶液中滴加稀硝酸无明显现象,再加BaCl2溶液,产生白色沉淀,不能证明无色溶液中一定含有SO42-离子,也可能有银离子,因氯化银、硫酸钡都是白色的不溶于硝酸的沉淀,选项错误;
C、将CO、CO2、N2的混合气体,通过浓NaOH溶液,能吸收二氧化碳;通过浓硫酸,能吸收水蒸气;通过灼热CuO,一氧化碳能与灼热CuO反应生成铜和二氧化碳,最后得到N2、CO2,选项错误;
D、NaOH、H2SO4、Mg(NO3)2、FeCl3、NaNO3中黄色的是氯化铁溶液,能和氯化铁生成红褐色沉淀的是氢氧化钠,能和氢氧化钠生成白色沉淀的是硝酸镁,能和上述两种沉淀反应,将沉淀溶解的是硫酸,余下物质是硝酸钠,不用其它试剂就能鉴别,选项正确。
故选D。
9.下列有关量的变化图象与其对应叙述相符的是()
A.①常温下,向一定量的饱和石灰水中加入氧化钙
B.②一定温度下,向不饱和硝酸钾溶液中加入硝酸钾
C.③向一定质量的过氧化氢的水溶液中加入二氧化锰
D.④向等质量的铁和镁中分别加入足量的稀盐酸
【答案】C
【解析】
【分析】
【详解】
A、因为氧化钙能与水发生反应生成氢氧化钙,氧化钙反应消耗了饱和溶液中的水,而使饱和溶液因减少溶剂水而析出固体,饱和溶液的溶质、溶剂质量同时减少,所以溶液的质量减少,故不符合题意;
B、一定温度下,向不饱和硝酸钾溶液中加入硝酸钾,随着加入的硝酸钾的质量的增加,溶液的质量,从一个不为0的值逐渐增大到硝酸钾饱和,饱和后溶液的质量不再增加,为一定值,故不符合题意;
C、过氧化氢的水溶液中含有水,所以开始水的质量不为0,过氧化氢溶液和二氧化锰混合生成水和氧气,所以随着反应的进行,水的质量不断增加,当反应完毕后水的质量不再增加,为一定值,故符合题意;
D、分别向等质量的镁和铁中滴入溶质质量分数相同的稀盐酸,当盐酸少量时,生成的气体由盐酸的量决定,所以开始二者放出气体一直相等,但因为盐酸过量,等质量的镁放出的气体大于铁放出的气体,所以图象比正确,不符合题意;
故选C。
10.实验室现有一瓶水垢样品,其成分为氢氧化镁和碳酸钙。
已知:
氢氧化镁受热易分解,反应的化学方程式为:
Mg(OH)2
MgO+H2O;碳酸钙高温下分解。
某兴趣小组为测定其中各成分的质量分数,取12.9g水垢样品加热,加热过程中剩余固体的质量随加热时间的变化如下图所示。
关于加热一段时间后剩余固体的判断,下列说法错误的是()
A.图中a点剩余固体是由一种盐和一种碱组成
B.若剩余固体中钙元素的质量分数为36.0%,则剩余固体的成分为CaCO3和MgO
C.图中ab间任一点(不包括a、b两点)的剩余固体成分为CaCO3、MgO和Mg(OH)2
D.若向c点的剩余固体中加入足量稀盐酸,充分反应生成CO2的质量为(12.0-x)g
【答案】B
【解析】
【分析】
由题意可知,氢氧化镁受热易分解生成了水蒸气,固体的质量要减少;碳酸钙高温下分解放出了二氧化碳气体,固体的质量要减少,完全反应后,固体的质量不再减少。
【详解】
A、图中a点剩余固体是氢氧化镁和碳酸钙,是由一种盐和一种碱组成,故A说法正确;
B、由图象可知,生成水的质量为:
12.9g-12.0g=0.9g
设氢氧化镁的质量为m
解得:
m=2.9g
则碳酸钙的质量为12.9g-2.9g=10g
设碳酸钙完全分解生成的二氧化碳的质量为n
,解得:
n=4.4g
x=12.0g-4.4g=7.6g
若碳酸钙完全分解,则剩余固体中钙元素的质量分数是:
>36.0%,说明了碳酸钙没有完全分解,则剩余固体的成分为CaCO3、MgO、CaO,故B说法错误;
C、图中ab间任一点(不包括a、b两点),说明了氢氧化镁没有完全分解,剩余固体成分为CaCO3、MgO和Mg(OH)2,故C说法正确;
D、由质量守恒定律可知,若向c点的剩余固体中加入足量稀盐酸,充分反应生成CO2的质量为(12.0-x)g,故D说法正确。
故选:
B。
11.已知某固体粉末是由NaCl、CaCl2、NaOH、K2CO3、Na2CO3中的一种或几种组成,取这种粉末24g加足量的水,振荡后呈浑浊,过滤、洗涤、烘干后得到10g沉淀和滤液。
向滤液中滴加酚酞,变红;取少量滤液于试管中滴加硝酸银溶液有白色沉淀生成,再加入稀硝酸沉淀不消失且试管中有气泡产生。
下列说法正确的是
A.原固体中一定含CaCl2、NaOH和Na2CO3
B.原固体中一定含Na2CO3,可能含K2CO3和NaCl
C.滤液中一定含NaCl和K2CO3,可能含NaOH
D.上述实验无法证明原固体中是否含NaCl、CaCl2、NaOH
【答案】B
【解析】
碳酸钙不溶于水,溶于酸生成气体,而氢氧化钠、碳酸钾、碳酸钠的溶液都可使酚酞溶液变红,氯离子和银离子会生成氯化银沉淀,再加入稀硝酸沉淀不消失。
设生成10g沉淀需要氯化钙的质量为x。
需要碳酸钠的质量为y。
需要碳酸钾的质量为m。
CaCl2——CaCO3Na2CO3——CaCO3K2CO3——CaCO3
111100106100138100
x10gy10gm10g
X=11.1gy=10.6gm=13.8g
11.1g+13.8g=24.9g>24g,故选B。
12.现有一包由3.2g铜、13g锌和2g碳组成的粉末,放到一定量的AgNO3溶液中,完全反应后得到的固体为m种,溶液中溶质为n种.下列说法中不正确的是()
A.若m=2,则n=2或3B.若固体中金属的质量为48g,则m=4
C.当m=3时,溶液可能呈蓝色D.反应后固体的质量不可能超过56g
【答案】B
【解析】
【分析】
由金属活动性顺序表可知,金属的活动性Zn>Cu>Ag,由3.2g铜、13g锌和2g碳组成的粉末,放到一定量的AgNO3溶液中,Zn首先与硝酸银溶液反应,Zn反应完成时,Cu再与硝酸银反应.碳与硝酸银不反应。
【详解】
A、当m=2时,则得到的固体为银和碳,Cu和Zn全部反应,硝酸银溶液足量,恰好反应时,溶液中的溶质为硝酸铜和硝酸锌;硝酸银过量时,溶液中的溶质为硝酸铜、硝酸锌和硝酸银,因此,n=2或3,故A正确;
B、当上述两个反应分别恰好进行完全时,设生成银的质量分别为x,y
x=43.2g
y=10.8g
当锌完全反应时,金属的质量为:
3.2g+43.2g=46.4g,铜完全反应时,金属的质量最大是:
43.2g+10.8g=54g,由于金属的质量是48g,46.4g<48g<54g.由此可知,锌完全反应,部分铜已参加反应,所以,固体物质有银、铜和碳三种,即m=3,故B不正确;
C、由上述计算分析可知,当m=3时,溶液可能呈蓝色,故C正确;
D、由上述计算分析可知,反应后固体的质量不可能超过54g+2g=56g,故D正确。
故选B。
13.将22.2gCu2(OH)2CO3放在密闭容器内高温加热一段时间后,冷却,测得剩余固体的质量为15.2g。
在剩余固体里加入100.0g稀硫酸恰好完全反应,过滤得红色金属。
已知:
Cu2O+H2SO4=Cu+CuSO4+H2O,下列说法正确的是
A.15.2g剩余固体是纯净物B.过程中生成CO2和H2O的质量和为7.0g
C.残留红色金属质量为12.8gD.稀硫酸的溶质质量分数为14.7%
【答案】D
【解析】
【分析】
【详解】
根据题中信息可知,碱式碳酸铜分解时,部分生成了氧化铜,部分生成氧化亚铜
设分解生成氧化铜的碱式碳酸铜的质量为m,生成氧化铜的质量为x
①
②
由①②计算可得
因此生成氧化铜、氧化亚铜的碱式碳酸铜的质量均为11.1g,生成氧化亚铜的质量为
设生成铜的质量为y,与氧化亚铜反应的硫酸的质量为n1,与氧化铜反应的硫酸的质量为n2
A、剩余固体加硫酸后生成铜,说明15.2g剩余固体是氧化铜和氧化亚铜,是混合物,故A不正确;
B、过程中生成CO2和H2O、氧气的质量和为7.0g,故B不正确;
C、残留红色金属为铜,质量是3.2g,故C不正确;
D、稀硫酸的溶质质量分数为
,故D正确。
故选D。
14.有一个反应在密闭容器中发生,三种物质CaCO3、CaO和CO2的质量比例变化如图所示。
下列有关该反应的说法,正确的是
A.该反应是化合反应
B.CaO在反应中起催化作用
C.CO2是生成物
D.反应中CaO和CaCO3的质量比为1:
1
【答案】A
【解析】反应后二氧化碳和氧化钙的质量都减小了,是反应物,碳酸钙的质量增大了,是生成物,该反应是二氧化碳和氧化钙反应生成碳酸钙;A、该反应是化合反应,正确;B、氧化钙在反应中不是催化剂,是反应物,错误;C、该反应中二氧化碳是反应物,错误;D、反应中CaO和CaCO,的质量比为56:
100,错误;故选A。
15.除去下列物质中的杂质,所选用的方法正确的是:
物质(括号内为杂质)
操作方法
A
CO2(HCl)
先通过过量氢氧化钠溶液,再通过浓硫酸
B
铁粉(锌粉)
加过量FeSO4溶液充分反应后过滤、洗涤、干燥
C
CO2(CO)
通入氧气后,点燃
D
NaCl溶液(Na2CO3)
加稀硫酸至恰好不再产生气泡为止
A.AB.BC.CD.D
【答案】B
【解析】
试题分析:
除杂质的要求是:
要把杂质除去,但不能除去了需要的物质,更不能带入新的杂质。
A中氢氧化钠溶液能与二氧化碳反应,错误;B中锌与硫酸亚铁反应生成铁和硫酸锌,正确;C中二氧化碳中含有少量的一氧化碳不能点燃,C错误;D中稀硫酸与碳酸钠反应生成硫酸钠和水,带入了新的杂质,D错误。
故选B。
考点:
除杂质
16.下列图象与对应的说法相匹配的是()
①表示KMnO4加热制O2生成的MnO2的质量与时间的关系图
②表示C还原CuO的实验中,试管内的固体质量与时间的关系图
③表示向饱和的Ca(OH)2溶液中加入一定量的CaO,溶液中溶质质量与时间的关系图
④等质量的铁片和锌片分别和足量的溶质质量分数相同的稀硫酸反应
A.①③B.③④C.②④D.②③
【答案】D
【解析】①KMnO4在加热条件下生成制O2、MnO2、锰酸钾,所以开始时二氧化锰的质量为零;反应中质量增加,反应结束质量不再改变;②C还原CuO生成铜和二氧化碳,参与反应的氧化铜的质量大于生成的铜的质量,所以反应中固体的质量减少,反应结束固体质量不再改变;③氧化钙和水反应生成氢氧化钙,向饱和的Ca(OH)2溶液中加入一定量的CaO,溶剂的质量减少,溶质会析出,反应放热使氢氧化钙的的溶解度减小,溶质会析出,所以溶质的质量会减少,反应结束后随温度的降低,部分析出的氢氧化钙又溶解,溶质的质量增多,但是由于水比反应前少了,所以最终溶质的质量小于开始时,溶质的质量。
④等质量的铁片和锌片分别和足量的溶质质量分数相同的稀硫酸反应,由于锌的活动性比铁强,所以锌的反应快,先反应完;锌比同质量的铁反应生成氢气少;最终铁的平线比锌的高;选D
点睛:
图像的问题主要是结合化学反应分析图的起点的位置,变化趋势,终点的位置是否正确
17.已知AgNO3见光易分解,aAgNO3=bNO2↑+cO2↑+dX(NO2能与NaOH反应)。
取34gAgNO3加热至完全反应,将所得气体依次通过NaOH溶液、均热的铜网,测得NaOH溶液增重9.2g,灼热的铜网增重3.2g。
下列说法不正确的是
A.AgNO3应保存在棕色瓶中B.生成X的质量为21.6gC.X是银D.c:
d=1:
1
【答案】D
【解析】
【分析】
将所得气体依次通过NaOH溶液、均热的铜网,测得NaOH溶液增重9.2g,灼热的铜网增重3.2g。
说明34gAgNO3加热至完全反应,生成二氧化氮9.2g,氧气3.2g。
根据质量守恒定律可知,生成X一定含有银元素,它的质量为34g-9.2g-3.2g=21.6g。
34g硝酸银中银元素的质量为,
,X一定是银。
【详解】
A、AgNO3见光易分解,AgNO3应保存在棕色瓶中,说法正确,不符合题意;
B、生成X的质量为21.6g,说法正确,不符合题意;
C、X是银,说法正确,不符合题意;
D、
,c:
d=1:
2,符合题意。
故选D。
18.实验方法能达到实验目的是
选项
实验目的
实验方法
A
鉴别NaCl、CaCO3、CuSO4三种白色固体
加入足量水溶解
B
除去CaO中的CaCO3
加入足量水,过滤
C
粗略测定空气中氧气的含量
用硫粉代替红磷在空气中燃烧
D
探究稀硫酸与NaOH溶液是否恰好完全反应
向稀硫酸与NaOH溶液反应后所得的溶液中滴加Ba(NO3)2溶液
A.AB.BC.CD.D
【答案】A
【解析】
A加水时,氯化钠溶解得溶液,碳酸钙不溶得浊液,硫酸铜溶解得蓝色溶液,能成功鉴别;B、加水时氧化钙反应生成氢氧化钙,不符合要求;C硫燃烧生成气体,不能用硫粉代替红磷在空气中燃烧;D稀硫酸与NaOH溶液好完全反应时,溶质只有硫酸钠;酸过量时,溶质为:
硫酸钠和硫酸;碱过量时,溶质为硫酸钠和氢氧化钠。
硫酸钠和硫酸,都能与硝酸钡反应生成白色沉淀;选A
点睛:
鉴别题要做到同一操作下或与同一物质反应时,现象要不同。
除杂的原则:
只除杂,不引杂。
即所加试剂只能