高三化学人教版复习专题突破训练2 常见气体的实验室制法及其性质探究.docx
《高三化学人教版复习专题突破训练2 常见气体的实验室制法及其性质探究.docx》由会员分享,可在线阅读,更多相关《高三化学人教版复习专题突破训练2 常见气体的实验室制法及其性质探究.docx(13页珍藏版)》请在冰豆网上搜索。
高三化学人教版复习专题突破训练2常见气体的实验室制法及其性质探究
专题突破训练
(二) 常见气体的实验室制法及其性质探究
(建议用时:
35分钟)
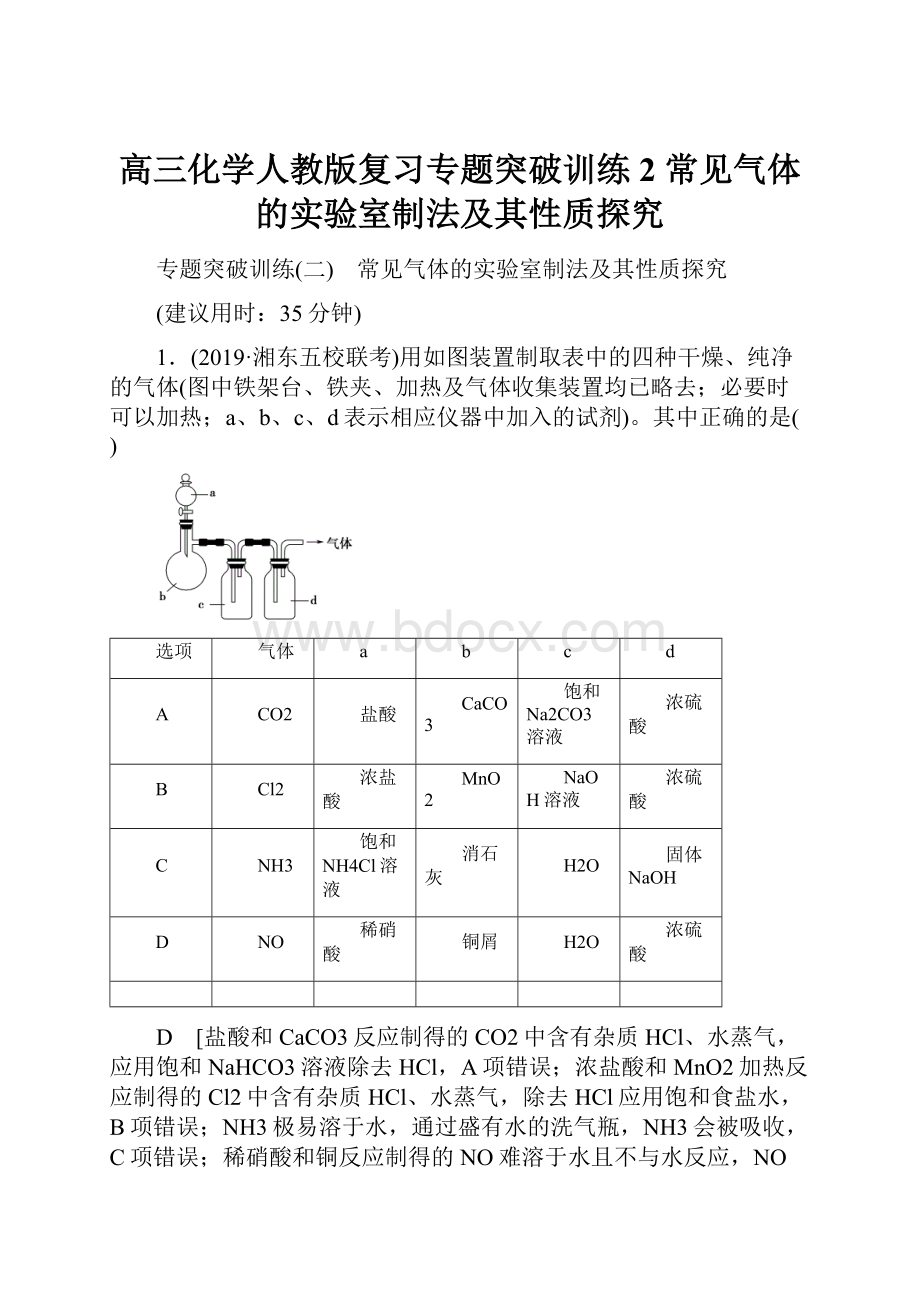
1.(2019·湘东五校联考)用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。
其中正确的是( )
选项
气体
a
b
c
d
A
CO2
盐酸
CaCO3
饱和Na2CO3溶液
浓硫酸
B
Cl2
浓盐酸
MnO2
NaOH溶液
浓硫酸
C
NH3
饱和NH4Cl溶液
消石灰
H2O
固体NaOH
D
NO
稀硝酸
铜屑
H2O
浓硫酸
D [盐酸和CaCO3反应制得的CO2中含有杂质HCl、水蒸气,应用饱和NaHCO3溶液除去HCl,A项错误;浓盐酸和MnO2加热反应制得的Cl2中含有杂质HCl、水蒸气,除去HCl应用饱和食盐水,B项错误;NH3极易溶于水,通过盛有水的洗气瓶,NH3会被吸收,C项错误;稀硝酸和铜反应制得的NO难溶于水且不与水反应,NO被空气氧化成的NO2与水反应又可生成NO,故将生成的气体依次通过水、浓硫酸,可以得到纯净、干燥的NO,D项正确。
]
2.利用如图所示装置进行下列实验,能得出相应实验结论的是( )
选项
①
②
③
实验结论
A
酸性高锰酸钾
浓盐酸
NaHCO3溶液
Cl2与水反应生成酸性物质
B
浓硫酸
蔗糖
澄清石灰水
浓硫酸具有脱水性、氧化性
C
浓硝酸
铁片
NaOH溶液
铁和浓硝酸反应可生成NO
D
稀盐酸
Na2CO3
Na2SiO3溶液
非金属性:
Cl>C>Si
B [浓盐酸易挥发,酸性高锰酸钾和浓盐酸制得的氯气中含有HCl,因此②中所得气体通入NaHCO3溶液中有气泡产生不能说明Cl2与水反应生成酸性物质,A项错误;常温下铁遇浓硝酸发生钝化,不产生NO,C项错误;稀盐酸和Na2CO3反应,说明酸性:
HCl>H2CO3,而元素的非金属性强弱应根据其最高价氧化物对应的水化物的酸性强弱来判断,即非金属性Cl>C的判断依据是酸性HClO4>H2CO3,D项错误。
]
3.某学习小组拟利用如图装置制备氮化钙(化学式为Ca3N2,极易与H2O反应)。
下列说法正确的是( )
A.打开活塞K通入N2,试管A内有气泡产生,说明装置气密性良好
B.U形管中盛放的干燥剂既可以是碱石灰,也可以是浓硫酸
C.将产物Ca3N2放入盐酸中,只能得到一种盐
D.反应结束后,先熄灭酒精灯,待反应管冷却至室温后再关闭活塞K
D [A项,不能用通气体的方法检验装置气密性;B项,U形管只能装固体;C项,Ca3N2放入盐酸中可得到两种盐CaCl2和NH4Cl。
]
4.根据下列仪器制备中学化学中常见的气体:
请回答下列问题:
(1)选择仪器A制备气体并经后续装置测量气体体积时,其优点是___________________________________________________________
___________________________________________________________;
欲制备气体并控制反应随制随停,最适宜选用的仪器是________(填代号,下同)。
(2)实验室制备CO的原理:
HCOOH
CO↑+H2O,发生装置选择________;收集装置选择________。
解析:
(1)A仪器可保持烧瓶内气压与分液漏斗内气压相等,确保液体能顺利滴下;测量的气体体积等于发生反应生成的气体体积,扣除了加入液体时排出的气体的体积。
B仪器能控制反应,实现随制随停(利用大气压原理,控制固体和液体接触与脱离)。
(2)CO有毒、密度与空气相近,选择排水法收集CO。
答案:
(1)液体顺利滴下、测定气体的体积已扣除加入液体所占体积 B
(2)C F(或G)
5.(2019·桂林模拟)现用下列装置(仪器可重复使用)制备PH3,并证明PH3具有强还原性和热不稳定性。
已知:
①标准状况时,PH3是一种无色、微溶于水、有剧毒的气体,具有强还原性,在空气中能自燃;
②白磷(P4)常温下为白色或黄色蜡状固体,不溶于水,在空气中易自燃;
③乙醚是一种易挥发的液体,沸点为34.6℃,能溶解白磷。
(1)仪器m的名称为________,装置C名称为________。
(2)实验室用白磷与NaOH浓溶液反应生成NaH2PO2的同时制得PH3,反应的化学方程式为________________________________________________
___________________________________________________________。
(3)用装置A制取PH3,实验前,在仪器n中加入适量的乙醚和白磷并微热,然后才滴入浓NaOH溶液。
实验前先微热的目的是________________________
___________________________________________________________。
(4)将A、C、E依次相连,按照(3)中操作滴入浓NaOH溶液后,同时点燃E处导出的气体,若装置C中溶液黄色变浅,同时得到白色蜡状固体,说明PH3具有______性,装置C中发生的化学反应方程式为_______________________,
点燃E处气体的目的为___________________________________
___________________________________________________________。
(5)将以上装置组合以证明PH3受热已分解,并验证PH3受热分解的气体产物,则仪器连接顺序为A→________→D→________→________→E(在“→”之间的空白处填写装置编号)。
能证明PH3分解的气体产物的现象是___________________________________________________________
___________________________________________________________。
解析:
(2)NaH2PO2中P元素为+1价,PH3中P元素为-3价,根据得失电子守恒,可得到反应方程式为P4+3NaOH(浓)+3H2O3NaH2PO2+PH3↑。
(3)乙醚易挥发,实验前微热可生成乙醚蒸气除去装置中的空气,防止P4和PH3自燃。
(4)C中溶液黄色变浅,即Fe3+被还原,可证明PH3有还原性;得到白色蜡状固体即生成P4,化学方程式为6Fe2(SO4)3+4PH3===P4↓+12FeSO4+6H2SO4。
(5)先由A装置生成PH3,在B装置加热分解,再将产物通过D装置冷却得到P4,然后第一次通过装置C除去PH3,第二次通过装置C检验PH3是否完全除去,然后检验生成的氢气;证明分解生成的是氢气,需先看到第二次通过装置C的溶液不褪色,然后点燃E处气体火焰呈蓝色。
答案:
(1)分液漏斗 洗气瓶
(2)P4+3NaOH(浓)+3H2O3NaH2PO2+PH3↑
(3)排除装置中的空气,防止P4和PH3自燃
(4)还原 6Fe2(SO4)3+4PH3===P4↓+12FeSO4+6H2SO4 防止有毒气体PH3泄漏,污染空气
(5)B C C 第二瓶C中溶液不褪色,点燃E处气体,火焰呈蓝色
6.(2019·黑龙江名校联考)过氧化钠(Na2O2)是一种淡黄色固体,常用作供氧剂、漂白剂、杀菌剂。
某小组拟制备过氧化钠并探究其性质和测定产品成分(已知:
双氧水的分解反应是放热反应)。
Ⅰ.制备过氧化钠。
他们设计图1装置利用钠与氧气反应制备过氧化钠。
图1 图2
(1)实验室中钠保存在________中。
(2)试剂X是________,D装置的作用是___________________________。
(3)部分实验步骤为:
①装药品;②点燃酒精灯;③检查装置气密性;④打开A处分液漏斗旋塞。
正确的操作顺序为________。
(4)实验完毕后,发现烧瓶里产生少量红褐色沉淀,其原因是___________________________________________________________。
Ⅱ.探究过氧化钠的性质。
(5)取少量C硬质玻璃管中固体产品于试管中,滴加稀盐酸酸化的KI淀粉溶液,振荡,溶液变蓝色。
写出反应的离子方程式:
________________________________________。
Ⅲ.探究产品中是否有Na2O(不含其他杂质)。
(6)准确称取mg产品按图2装置进行实验。
读数前,上下移动水准瓶,其目的是___________________________________________________________。
测得起始读数为V1mL,终点读数为V2mL(已转换成标准状况下)。
当________时,产品含氧化钠(用含m、V1、V2的代数式表示)。
解析:
(1)实验室中钠保存在煤油或石蜡油中。
(2)过氧化钠能与水反应,氧气必须干燥,所以,试剂X为浓硫酸,D装置的作用是吸收空气中水蒸气,避免过氧化钠变质。
(4)双氧水分解放出热量,氯化铁水解吸收热量,双氧水分解放出的热量促进氯化铁水解生成氢氧化铁沉淀。
(5)过氧化钠具有氧化性,离子方程式为Na2O2+2I-+4H+===2Na++I2+2H2O。
(6)若产品不含氧化钠,n(Na2O2)=
mol,2Na2O2+4HCl===4NaCl+O2↑+2H2O,n(O2)=
mol,则
mol=
mol,解得m=
;若产品含氧化钠,则放出的氧气量减小,m>
。
答案:
(1)煤油(或石蜡油)
(2)浓硫酸 防止空气中的水蒸气进入
(3)③①④②
(4)双氧水的分解反应是放热反应,温度升高,促进铁离子水解
(5)Na2O2+2I-+4H+===2Na++I2+2H2O
(6)保证内外气体压强相等 m>
(合理即可)
7.(2019·成都模拟)三氯化硼的熔点为-107.3℃,沸点为12.5℃,易水解生成硼酸(H3BO3),可用于制造高纯硼、有机合成催化剂等。
实验室制取三氯化硼的原理为B2O3+3C+3Cl22BCl3+3CO。
(1)甲组同学拟用下列装置制取纯净干燥的氯气(不用收集)。
①装置B中盛放的试剂是__________,装置C的作用是________________________。
②装置A中发生反应的离子方程式为____________________
___________________________________________________________。
(2)乙组同学选用甲组实验中的装置A、B、C和下列装置(装置可重复使用)制取BCl3并验证反应中有CO生成。
①乙组同学的实验装置中,依次连接的合理顺序为
A→B→C→G→________→________→________→________→F→D→I。
②能证明反应中有CO生成的现象是_______________________
___________________________________________________________
___________________________________________________________。
③开始实验时,先点燃________(填“A”或“G”)处的酒精灯。
④硼酸是一元弱酸,其钠盐化学式为Na[B(OH)4],则硼酸在水中电离方程式是___________________________________________________________
___________________________________________________________
___________________________________________________________。
解析:
(1)①高锰酸钾与浓盐酸反应生成氯气,因盐酸易挥发,制得的氯气中混有HCl和水蒸气,常用饱和食盐水除去氯气中的HCl,然后用浓硫酸除去水蒸气。
②装置A中发生的反应方程式为2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,则离子方程式为2MnO
+16H++10Cl-===2Mn2++5Cl2↑+8H2O。
(2)①从C中出来的纯净干燥的氯气与三氧化二硼和C反应生成BCl3和CO,BCl3沸点低,E中用冰水冷凝BCl3,从E中出来的气体有CO和过量的Cl2。
检验CO原理是将其通过灼热的CuO,检验生成的二氧化碳,因氯气能和澄清石灰水反应,所以气体通过CuO前应将过量的氯气除去;除去氯气用NaOH溶液,为避免BCl3水解,E后连接无水氯化钙;气体通过NaOH溶液除去氯气后,CO中仍混有水蒸气,通入CuO前应用无水氯化钙除去水蒸气,所以合理顺序为E→H→J→H。
②CO还原CuO生成Cu和二氧化碳,证明有CO生成的现象是F中黑色粉末变红,D中澄清石灰水变浑浊。
③实验开始时,应先点燃A处的酒精灯,产生氯气,排净装置中的空气,防止CO与空气混合加热发生爆炸。
④由硼酸的钠盐可知硼酸在水溶液中形成的酸根是[B(OH)4]-,H3BO3在水中电离方程式为H3BO3+H2O
[B(OH)4]-+H+。
答案:
(1)①饱和食盐水 干燥氯气 ②2MnO
+16H++10Cl-===2Mn2++5Cl2↑+8H2O
(2)①E H J H ②装置F中黑色粉末变为红色,装置D中澄清石灰水变浑浊 ③A ④H3BO3+H2O
[B(OH)4]-+H+
8.(2019·潍坊模拟)某兴趣小组同学利用如图所示装置(夹持装置已略去)探究SO2的性质,并制取一种常用食品抗氧化剂焦亚硫酸钠(Na2S2O5)。
请回答下列问题:
(实验前已除去装置中的空气)
(1)打开分液漏斗活塞,发现其中的液体不能流下,应采取的操作是___________________________________________________________
___________________________________________________________
___________________________________________________________。
(2)关闭K2、K3,打开K1,观察到装置C中发生的现象是
______________________________。
(3)装置D和F的作用是_____________________________________。
(4)关闭K1、K3,打开K2。
一段时间后E中有Na2S2O5晶体析出,装置E中发生反应的化学方程式为_________________________________
___________________________________________________________。
(5)设计实验验证Na2S2O5晶体在空气中已被氧化______________________
___________________________________________________________。
解析:
(1)使用分液漏斗时应取下分液漏斗上口的玻璃塞,使分液漏斗内的压强等于大气压强,保证液体顺利流下。
(2)装置A中生成SO2,装置C中发生反应:
H2O+SO2+Na2S===H2S+Na2SO3、SO2+2H2S===3S↓+2H2O,现象是有淡黄色沉淀生成。
(3)装置D和F的作用是吸收SO2,防止污染空气。
(4)装置E中Na2SO3与SO2反应生成Na2S2O5。
(5)若Na2S2O5晶体在空气中已被氧化,则生成Na2SO4,可以利用稀盐酸和BaCl2溶液检验SO
。
答案:
(1)拔掉分液漏斗上口的玻璃塞(或使分液漏斗玻璃塞上的凹槽或小孔对准瓶颈处的小孔)
(2)有淡黄色沉淀生成
(3)吸收SO2,防止污染空气
(4)SO2+Na2SO3===Na2S2O5↓
(5)取少量Na2S2O5晶体于试管中,加适量水溶解,再滴加足量盐酸,振荡,至不再有气体产生,再滴入BaCl2溶液,有白色沉淀生成,证明Na2S2O5晶体在空气中已被氧化
备选习题
NH4NO3热分解十分复杂。
在一定条件下:
3NH4NO32NH3↑+2NO↑+2NO2↑+3H2O(不考虑2NO2
N2O4),现要选用下列装置(部分夹持装置省略),通过实验验证反应产物:
已知:
①液化温度:
NO2(21℃)、NO(-152℃);
②NH3与灼热的氧化铜反应得到N2和Cu;
③在无催化剂的条件下NOx不能与灼热的铜反应;
④NO2能使湿润的淀粉碘化钾试纸变蓝。
(1)所选择装置的连接顺序(按左→右连接,填各装置数字)为⑧→________→________→________→④→③→②→⑤。
(2)实验开始应先向装置⑧中通入__________________________________,
再________。
(3)为验证NO,可在③中通入________________________________________
___________________________________________________________。
(4)装置⑤的作用是____________________________________________
___________________________________________________________。
解析:
⑧为加热装置,由题意3NH4NO32NH3↑+2NO↑+2NO2↑+3H2O,为了更好地检验产物中是否含有NO,在加热前先通入一定量的N2,排净装置中的空气(或O2)。
加热得到NH3、NO、NO2和H2O,利用装置⑦中无水硫酸铜检验生成的水,装置⑥吸收水蒸气,装置①检验NO2,装置④使二氧化氮液化,二氧化氮气体变成液态,装置③中通入一定量的氧气,无色气体变成红棕色,说明含有NO气体,装置②中NH3与CuO在加热的条件下反应得到N2、Cu和H2O,装置⑤尾气处理,防止污染空气,所以装置的连接顺序为⑧→⑦→⑥→①→④→③→②→⑤。
答案:
(1)⑦ ⑥ ①
(2)一定量的N2 点燃酒精灯(或加热)
(3)一定量的氧气
(4)尾气处理,防止污染空气