高三化学教案高考化学二轮复习专题4化学反应中的.docx
《高三化学教案高考化学二轮复习专题4化学反应中的.docx》由会员分享,可在线阅读,更多相关《高三化学教案高考化学二轮复习专题4化学反应中的.docx(21页珍藏版)》请在冰豆网上搜索。
高三化学教案高考化学二轮复习专题4化学反应中的
2018高考化学二轮复习
专题4化学反应中的能量变化
高考链接
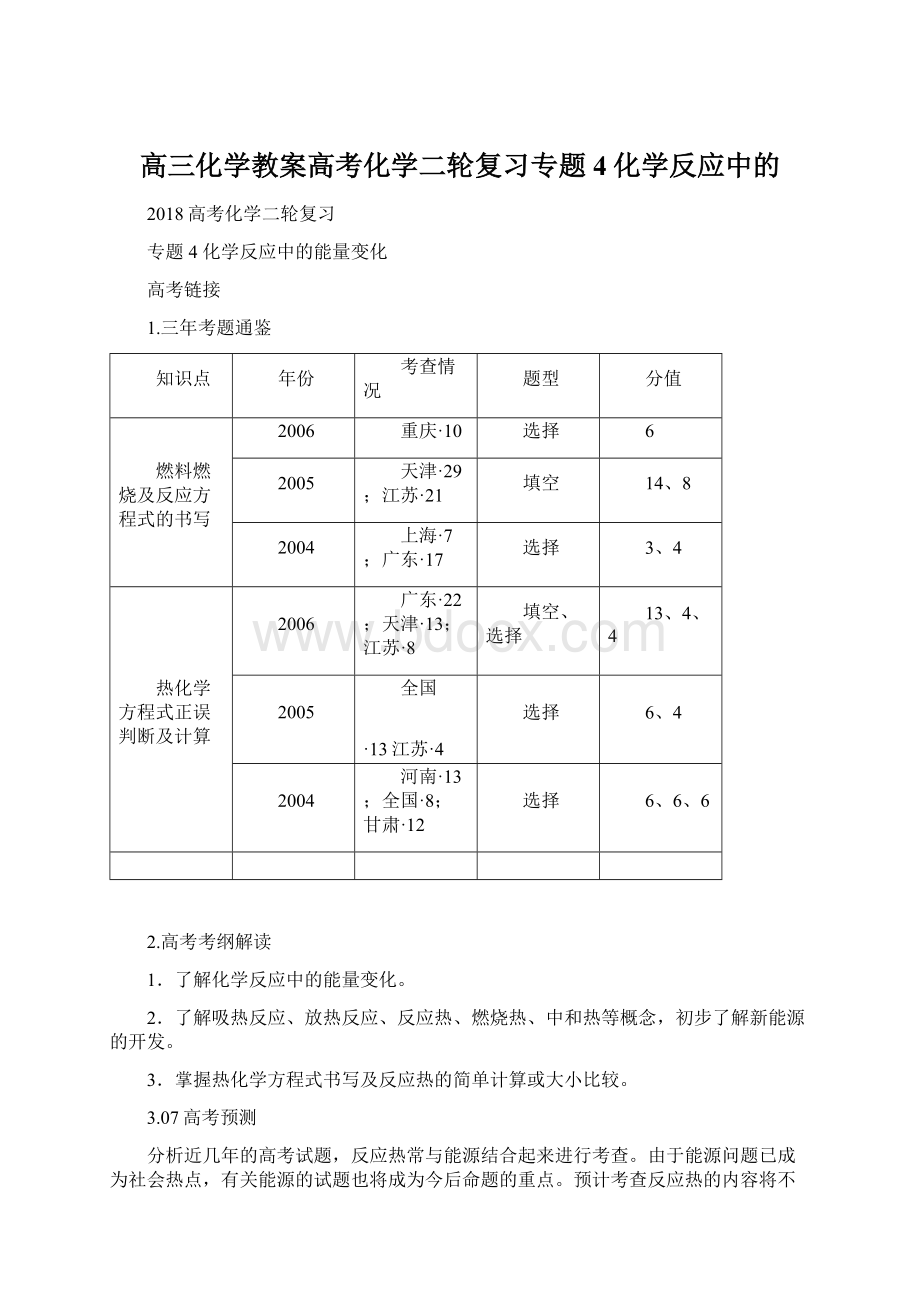
1.三年考题通鉴
知识点
年份
考查情况
题型
分值
燃料燃烧及反应方程式的书写
2006
重庆·10
选择
6
2005
天津·29;江苏·21
填空
14、8
2004
上海·7;广东·17
选择
3、4
热化学方程式正误判断及计算
2006
广东·22;天津·13;江苏·8
填空、选择
13、4、4
2005
全国
·13江苏·4
选择
6、4
2004
河南·13;全国·8;甘肃·12
选择
6、6、6
2.高考考纲解读
1.了解化学反应中的能量变化。
2.了解吸热反应、放热反应、反应热、燃烧热、中和热等概念,初步了解新能源的开发。
3.掌握热化学方程式书写及反应热的简单计算或大小比较。
3.07高考预测
分析近几年的高考试题,反应热常与能源结合起来进行考查。
由于能源问题已成为社会热点,有关能源的试题也将成为今后命题的重点。
预计考查反应热的内容将不断拓宽,题型也会有新的变化,选择、填空、实验题中都有可能出现,但难度不会大。
主要考查热点有:
(1)热化学方程式的书写及正误判断;
(2)反应热的大小比较;(3)反应热的简单计算;(4)反应热与能源的综合去考查。
可能出现的新题型:
结合社会热点问题;
与实验、计算等组合进行综合考查。
专题网络
考点扫描
考点一反应热、燃烧热、中和热等概念
1.反应热:
在化学反应过程中放出或吸收的热量,通常叫做反应热
2.燃烧热:
在101kPa时,1mol物质燃烧生成稳定的氧化物的时所放出的热量,叫做该物质的燃烧热。
①燃烧热必须以1mol可燃物燃烧为标准;可燃物必须完全燃烧,生成稳定化合物。
C→CO2,H2→H2O,S→SO2。
②反应热和燃烧热的区别在于,燃烧热对反应物的量及生成物的性质有要求,而反应热没有。
3.中和热:
在稀溶液中,酸与碱发生中和反应生成1molH2O时的反应热。
①稀溶液是指溶于大量水的离子。
②中和热不包括离子在水溶液中的生成热、电解质电离的吸热所伴随的热效应。
③中和反应的实质是H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,若反应过程中有其他物质生成,这部分反应热也不在中和热内。
如下列反应不能用上式表示:
0.5mol的稀硫酸和0.5mol的稀氢氧化钡反应;1mol氢氧化钠固体和1mol稀盐酸反应;1mol稀醋酸和1mol稀氢氧化钠反应。
4.放热反应和吸热反应
考点二热化学方程式
书写热化学方程式时明确以下问题:
(1)反应放出或吸收的热量的多少与外界的温度和压强有关,需要注明,不注明的指101kPa和25℃时的数据。
(2)物质的聚集状态不同,反应吸收和放出的热量不同,因此要注明反应物和生成物的聚集状态。
热化学方程式不用“↓”和“↑”。
(3)热化学方程式中的热量数据,是与各化学计量数为物质的量时相对应的,不是几个分子反应的热效应。
因此式中化学计量数可以是整数,也可以是分数。
一般出现分数时是以某一反应物或生成物为“1mol”时其它物质才出现的。
(4)无论热化学方程式中化学计量数为多少,△H的单位总是kJ/mol,但△H的数值与反应式中的系数有关。
ΔH只能写在化学方程式右边,并用“;”隔开。
数值前面必须带“+”(吸热)或“-”(放热)。
考点三盖斯定律的应用
化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关,如果一个反应可以分几步进行,则各分步及反应的反应热之和与该反应一步完成的反应热是相同的,这就是盖斯定律。
例如:
可以通过两种途径来完成。
如上图表:
已知:
H2(g)+1/2O2(g)=H2O(l);△H1=-241.8kJ/molH2O(g)=H2O(l);△H2=-44.0kJ/mol
根据盖斯定律,则:
△H=△H1+△H2=-241.8kJ/mol+(-44.0kJ/mol)=-285.8kJ/mol
注意:
应用盖斯定律进行简单计算,关键在于设计反应过程。
(1)当反应式乘以或除以某数时,△H也应乘以或除以某数。
(2)反应式进行加减运算时,△H也同样要进行加减运算,且要带“+”、“-”符号。
(3)通过盖斯定律计算比较反应热的大小时,同样要把△H看作一个整体。
(4)在设计的反应过程中常会遇到同一物质固、液、气三态的相互转化,状态由固→液→气变化时,会吸热;反之会放热。
(5)当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
考点四使用化石燃料的利弊及新能源的开发
1.燃料充分燃烧的两个条件
①要有足够的空气
②燃料与空气要有足够大的接触面。
2.重要的化石燃料:
煤、石油、天然气
3.煤作燃料的利弊问题
①煤是重要的化工原料,把煤作燃料简单烧掉太可惜,应该综合利用。
②煤直接燃烧时产生S02等有毒气体和烟尘,对环境造成严重污染。
③煤作为固体燃料,燃烧反应速率小,热利用效率低,且运输不方便。
④可以通过清洁煤技术,如煤的液化和气化,以及实行烟气净化脱硫等,大大减少燃煤对环境造成的污染,提高煤燃烧的热利用率。
4.新能源的开发
①调整和优化能源结构,降低燃煤在能源结构中的比率,节约油气资源,加强科技投入,加快开发水电、核电和新能源等就显得尤为重要和迫切。
②最有希望的新能源是太阳能、燃料电池、风能和氢能等。
这些新能源的特点是资源丰富,且有些可以再生,为再生性能源,对环境没有污染或污染少。
题型探究
题型一考查反应热、燃烧热及中和热等基本概念
[例1](06·天津理综·13)已知反应:
①101kPa时,2C(s)+O2(g)=2CO(g);ΔH=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol
下列结论正确的是()
A.碳的燃烧热大于110.5kJ/mol
B.①的反应热为221kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
[解析]燃烧热要求“1mol物质燃烧生成稳定的氧化物”,CO还可继续燃烧生成CO2并放出热量,所以A正确;B中①的反应热应为-221kJ/mol,因为反应热有吸热和放热之分,必须注明“+”或“-”才能明确其表示的意义;C项中和热应为57.3kJ/mol,因为中和热和燃烧热都是放热的,所以不要注明“-”,但请注意,在热化学方程式中则是要注明的;D中稀醋酸是弱酸,电离时要吸收热量,放出的热量要小于57.3kJ。
[答案]A
方法探究:
本题考查反应热、燃烧热及中和热等基本概念,尤其是反应热、燃烧热及中和热的表示方法。
复习基本概念时要深刻理解其内涵和外延,对于相似概念和易混淆概念要认真作好对比、辨析,弄清它们之间的联系和区别,才能在解题过程中准确运用。
【一试身手】
1.(2004·全国理综Ⅰ·13)已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:
C(石墨)+O2(g)=CO2(g);△H=-393.51kJ·mol-1,C(金刚石)+O2(g)=CO2(g);△H=-395.41kJ·mol-1
据此判断,下列说法正确的是()
A.由石墨制备金刚石是吸热反应,等质量时,石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应,等质量时,石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应,等质量时,石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应,等质量时,石墨的能量比金刚石的高
题型二考查热化学方程式书写及正误判断
[例2](05全国理综Ⅰ)已知充分燃烧ag乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是
A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-4bkJ/mol
B.C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l);ΔH=2bkJ/mol
C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-2bkJ/mol
D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=bkJ/mol
[解析]以上各式中化学计量数及物质状态标注都正确;该反应放热,△H应为负值;生成1mol二氧化碳气体,放出热量bkJ,则生成4mol二氧化碳气体,放出热量4bkJ。
[答案]A
技巧点拨:
判断热化学方程式正误要四看:
看化学反应原理是否正确;
看状态是否标明;
看反应热△H符号是否正确;
看反应热数值是否与系数和状态相对应。
【一试身手】
2.(06·重庆理综·10)25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、
285.8kJ/mol、890.3kJ/mol、2800kJ/mol,则下列热化学方程式正确的是()
A.C(s)+
O2(g)=CO(g);△H=-393.5kJ/mol
B.2H2(g)+O2(g)=2H2O(g);△H=+571.6kJ/mol
C.CH4g)+2O2(g)=CO2(g)+2H2O(g);△H=-890.3kJ/mol
D.
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H=-1400kJ/mol
3.(05·高考北京卷·29)CO、CH4均为常见的可燃性气体。
(1)等体积的CO和CH4在相同条件下分别完全燃烧,转移的电子数之比是
(2)已知在101kPa时,CO的燃烧热为283kJ/mol。
相同条件下,若2molCH4完全燃烧生成液态水,所放出的热量为1molCO完全燃烧放出热量的6.30倍,CH4完全燃烧反应的热化学方程式是。
(3)120℃、101kPa下,amL由CO、CH4组成的混合气体在bmLO2中完全燃烧后,恢复到原温度和压强。
①若混合气体与O2恰好完全反应,产生bmLCO2,则混合气体中CH4的体积分数为(保留2倍小数)。
②若燃烧后气体体积缩小了a/4mL,则a与b关系的数学表示式是。
题型三考查反应热大小的比较
[例3](04·全国Ⅱ·8)已知:
1H2(g)+O2(g)=H2O(g);H1=akJ·mol1
22H2(g)+O2(g)=2H2O(g);H2=bkJ·mol1
3H2(g)+O2(g)=H2O(l);H3=ckJ·mol1
42H2(g)+O2(g)=2H2O(l);H4=dkJ·mol1
下列关系式中正确的是()
A.a<c<0B.b>d>0C.2a=b<0D.2c=d>0
[解析]首先分析同一物质不同聚集状态转化时的能量变化,其次分析不同聚集状态在反应物中和在生成物中对反应热的影响,最后得出比较结论。
由12知2a=b,由34知2c=d,由H2O(g)→H2O(l)会放热,所以放热3>1,4>2,但放热反应a、b、c、d都是负值,故a>c<0,b>d<0,2a=b<0,2c=d<0。
选C。
[答案]C
易错警示:
比较△H大小时:
①一定要记得带上符号(“+”“-”);②要对应聚集状态;③有时还要借助“盖斯定律”。
【一试身手】
4.(05·年江苏卷·4)氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)的热化学方程式分别为:
H2(g)+1/2O2(g)=H2O(l);△H=–285.8kJ/mol
CO(g)+1/2O2(g)=CO2(g);△H=–283.0kJ/mol
C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l);△H=–5518kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=–890.3kJ/mol
相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是
A.H2(g)B.CO(g)C.C8H18(l)D.CH4(g)
5.(06·江苏·8)下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O2(g)====CO2(g);△H1C(s)+
O2(g)====CO(g);△H2
②S(s)+O2(g)====SO2(g);△H3S(g)+O2(g)====SO2(g);△H4
③H2(g)+
O2(g)===H2O(l);△H52H2(g)+O2(g)====2H2O(l);△H6
④CaCO3(s)====CaO(s)+CO2(g);△H7CaO(s)+H2O(l)====Ca(OH)2(s);△H8
A.①B.④C.②③④D.①②③
题型四考查反应热的计算
[例4]由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式:
____________。
若1g水蒸气转化成液态水放热2.444kJ,则反应H2(g)+
O2(g)=H2O
(1)的△H=_______kJ/mol。
氢气的燃烧热为_________kJ/mol。
[解析]根据热化学方程式的书写规则可得
①H2(g)+
O2(g)=H2O(g);△H=-241.8kJ/mol
1g水蒸气转化成液态放热2.444kJ,由此可计算1mol(18g)水蒸气转化成液态水放热18g×2.444kJ/g=44.0kJ,此过程可表示为:
②H2O(g)=H2O
(1);△H=-44.0kJ/mol
由①+②,得热化学方程式:
(盖斯定律)H2(g)+
O2(g)=H2O
(1);△H=-285.8kJ/mo1
[答案]H2(g)+
O2(g)=H2O(g);△H=-241.8kJ/mol;285.8
思维点悟:
运用盖斯定律的关键在于分析总反应可由哪些中间过程构成,化简要细心,计算时△H(带“+”“-”)也要参与运算。
[例5](05·江苏化学卷·21)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能。
键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
化学键
Si-O
Si-Cl
H-H
H-Cl
Si-Si
Si-C
键能/kJ·mol1
460
360
436
431
176
347
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”、“<”或“=”)
SiC______Si;SiCl4_________SiO2
(2)右图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子。
(3)工业上用高纯硅可通过下列反应制取:
SiCl4(g)+2H2(g)
Si(s)+4HCl(g)
该反应的反应热△H=_____________kJ/mol
[解析]
(1)由原子晶体知识易知:
SiC>Si;由原子晶体和分子晶体知识易知:
SiCl4<SiO2。
(2)硅晶体与金刚石晶体结构一样,每个硅原子都与4个硅原子相连,形成正四面体,所以四面体的八个顶点上应以不相邻方式摆放4个硅原子。
(3)通常把拆开1mol某化学键所吸收的能量看成该化学键的键能。
键能常用E表示,单位是kJ/mol。
则ΔH=∑E(反应物)-∑E(生成物),即反应热等于反应物的键能总和跟生成物的键能总和之差。
ΔH=[4E(Si─Cl)+2E(H-H)]-[2E(Si-Si)+4E(H-Cl)]=[(4×360+2×436)-(2×176+4×431)]kJ/mol=+236kJ/mol
[答案]
(1)>;<
(2)
(3)+236
考题点评:
本题围绕热化学方程式反应热热△H的计算,热化学方程式的书写命题,加强了热化学与物质结构知识见的联系,是一道很好的考查基础与能力结合的试题,需要一定的空间想象能力,尤其对硅的结构必须熟悉。
【一试身手】
6.(05·天津高考·29)(14分)磷在氧气中燃烧,可能生成两种固态氧化物。
3.1g的单质磷(P)在3.2g氧气中燃烧,至反应物耗尽,并放出XkJ热量。
(1)通过计算确定反应产物的组成(用化学式表示)是,其相应的质量(g)为。
(2)已知单质磷的燃烧热为YkJ/mol,则1molP与O2反应生成固态P2O3的反应热ΔH=。
(3)写出1molP与O2反应生成固态P2O3的热化学方程式:
。
7.(05·广东化学卷·20)钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料。
制备TiO2和Ti的原料是钛铁矿,我国的钛铁矿储量居世界首位。
含有Fe2O3的钛铁矿(主要成分为FeTiO3)制取TiO2的流程如下:
(1)Ti的原子序数为22,Ti位于元素周期表中第_____________周期,第__________族。
(2)步骤①加Fe的目的是____________________________________________________;
步骤②冷却的目的是___________________________________________________。
(3)上述制备TiO2的过程中,可以利用的副产物是_____________;考虑成本和废物综合利用因素,
废液中应加入__________________处理。
(4)由金红石(TiO2)制取单质Ti,涉及到的步骤为:
己知:
①C(s)+O2(g)=CO2(g); △H=-393.5kJ·mol-1
②2CO(g)+O2(g)=2CO2(g); △H=-566kJ·mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g); △H=+141kJ·mol-1
则TiO2(g)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H=_____ __________。
反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由是_______________________。
题型五考查中和热的测定
[例6](04·河南)50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中
和反应。
通过测定反应过程中所放出的热量可计算中和热。
请回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是______________;
由图可知该装置有不妥之处,应如何改正?
____________。
(2)烧杯间填满碎塑料泡沫的作用是_____________________________。
(3)大烧杯上如不盖硬纸板,则求得的中和热数值_________(填“偏大”、“偏小’、“无影响”)
(4)实验中改用60mL0.50mol/L的盐酸跟50mL0.55mol/L的NaOH溶液进行反应,与上
述实验相比,所放出的热量________(填“相等”或“不相等”),理由是____________;所求中和热的数值会________(填“相等”或“不相等”),理由是___________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会_______(填“偏大”、
“偏小”、“无影响”)。
[解析]这是个有关中和热测定的题目,要求弄清实验仪器和操作要领,并要注意实验中必须有一种反应物过量才能保证生成水的量。
[答案]
(1)环形玻璃搅拌棒;在大小烧杯间填满碎塑料泡沫(或碎纸条)使小烧杯口与大烧杯口相平
(2)保温隔热,减少反应过程中的热量损失
(3)偏小(4)不相等;中和热是指酸跟碱发生中和反应生成1mol水所放出的热量,跟酸碱的用量无关;相等(5)偏小
方法点拨
1.热化学方程式的书写要注意物质的聚集状态和ΔH的“+”、“-”号,以及反应热的数值与方程式中
的计量数之间的关系;
2.热化学方程式的正误判断首先辨别“+”“—”,然后观察各物质聚集状态是否标注正确,最后去计算数值是否与反应物或生成物的物质的量相匹配;书写时也可根据这个顺序进行,避免有所遗漏。
3.反应热的计算通常不会太难,但要细心。
易错指津
①书写热化学方程式时遗漏聚集状态和ΔH的“+”、“-”号;
②书写热化学方程式时反应热的数值与方程式中的计量数不对应;
③比较反应热的大小时诸多因素考虑不周全,顾此失彼;
④对“盖斯定律”的实质理解不透彻,导致计算反应热时失误。
冲刺演练
一、选择题(本题包括10小题,每小5分,共50分。
每小题有1—2个选项符合题意)
第Ⅰ卷(共50分)
1.已知合成氨的反应为:
N2(g)+3H2(g)
2NH3(g);ΔH=-QkJ/mol(Q>0)。
在同温同压下向甲密闭容器中通入1molN2和3molH2,达平衡时,放出的热量为Q1kJ,向另一容积相同的密闭容器乙中通入0.5molN2和1.5molH2,反应达平衡时,放出的热量为Q2kJ。
则下列关系式正确的是()
A.2Q2=Q1=QB.2Q2=Q12.“能源分类相关图”如下图所示,四组能源选项中
全部符合图中阴影部分的能源是()
A.煤炭、石油、潮汐能
B.水能、生物能、天然气
C.太阳能、风能、沼气
D.地热能、海洋能、核
3.化学反应可视为旧键断裂和新键形成的过程。
化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。
已知白磷(P4)和P4O6的分子结构如下图所示;现提供以下化学键的键能:
P-P198kJ·mol—1、P-O360kJ·mol—1、氧气分子内氧原子间的键能为498kJ·mol—1。
则P4+3O2=P4O6的反应热∆H为()
A.+1638kJ·mol—1B.-1638kJ·mol—1
C.-126kJ·mol—1D.+126kJ·mol—1
4.“信息”、“材料”和“能源”被称为新科技革命的三大支柱。
下列有关资讯错误的是()
A.在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源
B.目前中美日等国掌握的陶瓷发动机技术,大大提高了发动机的能量转化效率
C.2005年10月12日发射成功的“神舟六号”载人飞船使用了大量的复合材料
D.合成高分子材料的广泛应用是有百利而无一害
5.下列说法或表示方法正确的是()
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(石墨)→C(金刚石);ΔH=+119kJ/mol可知,金刚石比石墨稳定
C.在稀溶液中:
H+(aq)+OH-(aq)=H2O(l);ΔH=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的稀溶液混合,放出的热量大于57.3kJ
D.在101kPa、25℃时,2gH2完全燃烧生成液态水,放出285.