化学晶体练习高二下学期.docx
《化学晶体练习高二下学期.docx》由会员分享,可在线阅读,更多相关《化学晶体练习高二下学期.docx(18页珍藏版)》请在冰豆网上搜索。
化学晶体练习高二下学期
晶体练习题
(20XX年)3.(5分)
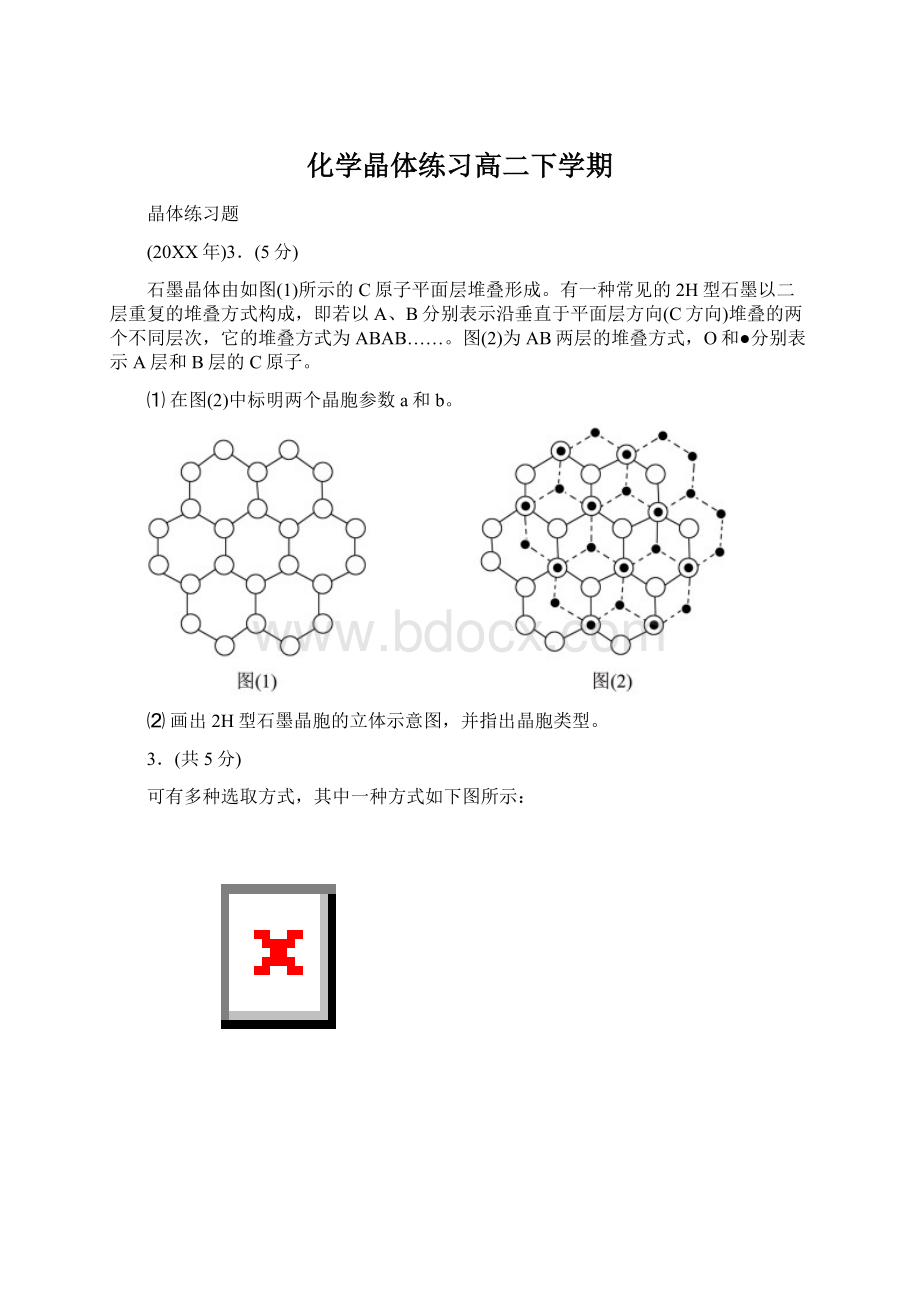
石墨晶体由如图
(1)所示的C原子平面层堆叠形成。
有一种常见的2H型石墨以二层重复的堆叠方式构成,即若以A、B分别表示沿垂直于平面层方向(C方向)堆叠的两个不同层次,它的堆叠方式为ABAB……。
图
(2)为AB两层的堆叠方式,O和●分别表示A层和B层的C原子。
⑴在图
(2)中标明两个晶胞参数a和b。
⑵画出2H型石墨晶胞的立体示意图,并指出晶胞类型。
3.(共5分)
可有多种选取方式,其中一种方式如下图所示:
(2)请自行设计两个实验(简单说明实验操作和实验现象)来验证Ba2+确实能使平衡向左移动。
(20XX年)8.(9分)
有一离子晶体经测定属立方晶系,晶胞参数a=4.00Å(1Å=10-8cm),晶胞的顶点位置为Mg2+,体心位置为K+,所有棱边中点为F-。
⑴该晶体的化学组成是;
⑵晶胞类型是;
⑶Mg2+的F-配位数是,K+的F-配位数是;
⑷该晶体的理论密度是g·cm-3。
⑸设晶体中正离子和负离子互相接触,已知F-的离子半径为1.33Å,试估计Mg2+的离子半径是Å,K+的离子半径是Å。
8.(共9分)
⑴MgKF3(2分)
⑵简单立方晶胞(1分)
⑶6(1分)12(1分)
⑷3.12g·cm-3(2分)
⑸0.67Å(1分)1.50Å(1分)
(20XX年)11.(4分)
NiO晶体为NaCl型结构,将它在氧气中加热,部分Ni2+被氧化为Ni3+,晶体结构产生镍离子缺位的缺陷,其组成成为NixO(x<1),但晶体仍保持电中性。
经测定NixO的立方晶胞参数a=4.157Å,密度为6.47g·cm-3。
⑴x的值(精确到两位有效数字)为;写出标明Ni的价态的NixO晶体的化学式。
⑵在NixO晶体中Ni占据空隙,占有率是。
11.(共4分)
⑴0.92(1分)
(1分)[或Ni(Ⅱ)0.76Ni(Ⅲ)0.16O]
⑵八面体(1分)92%(1分)
(20XX年)
第6题(共8分)
⑴两种铜溴配合物晶体中的一维聚合链结构的投影图(其中部分原子给出标记)如下。
①分别指出两种结构的结构基元由几个Cu原子和几个Br原子组成:
图⑴为个Cu原子,Br原子;
图⑵为个Cu原子,个Br原子。
②用笔在图中圈出相应的一结构基元。
⑵图⑶是由氯苯分子构成的平面点阵结构。
①在图中标出一个正当单位来,并标明两个基本向量
和
;
②指出正当单位的组成(内容);
③指出这种平面格子的正当单位的形式。
6.(共8分)
⑴①612…………………………(1分)
24…………………………(1分)
②结构基元如图中实线或虚线所围,也可另取。
(2分)
图1图2
⑵①此结构的正当单位和基本向量如下图所示。
(可有各种不同取法,但形式不变。
)……………(2分)
②图(3)所示结构的正当单位由两个取向相反的氯苯分子构成。
……………………(1分)
③矩形P格子……………………………………(1分)
(20XX年)第12题(共9分)
甲烷水合物(nCH4·46H2O)是一种具有重要经济价值的化合物,在海洋深处蕴藏量非常大,是未来的重要能源之一。
它的晶体结构可看作由五角十二面体[512]和十四面体[51262]共面连接堆积形成。
在立方晶胞中,[512]的中心处在顶角和体心位置;[51262]中心位置坐标为(0,1/4,1/2)、(0,3/4,1/2)、(1/2,0,1/4)、(1/2,0,3/4)、(1/4,1/2,0)、(3/4,1/2,0)共计6个。
它们彼此共用六角形面连成柱体,再和五角十二面体共面连接。
右图所示为甲烷水合物中水骨架的结构。
⑴CH4分子由于体积较小,可包合在这两种多面体中,若全部充满时,确定晶胞的组成(即n值)。
⑵已知该晶胞参数a=1180pm,计算1m3甲烷水合物晶体中可释放CH4的体积(标准状况下)。
⑶有的文献中报导开采1m3的甲烷水合物晶体可得到164m3的甲烷气体,请将此文献值与
(2)的计算结果比较,并给出合理的解释。
12.(共9分)
⑴8CH4·46H2O或n=8………………………(3分)
⑵按晶体的理想组成和晶胞参数,可算得晶胞体积V和晶胞中包含CH4的物质的量n(CH4):
V(晶胞)=a3=(1180pm)3=1.64×l09pm3=1.64×10
m3
n(CH4)=
=1.33×10
mol
1m3甲烷水合物晶体中含CH4的物质的量为:
n=
×1.33×10
mol=8.11×103mol
它相当于标准状态下的甲烷气体体积:
V=8.11×103×22.4×10
m3=182m3…………(4分)
⑶文献报导值比实际值小,说明甲烷分子在笼形多面体中并未完全充满,即由于它的晶体中CH4没有达到理想的全充满的结构。
(实际上甲烷水合物晶体结构形成时,并不要求[512]全部都充满CH4分子。
它的实际组成往往介于6CH4·46H2O和8CH4·46H2O之间。
)…(2分)
(20XX年)第5题(共10分)
长期以来人们一直认为金刚石是最硬的物质,但这种神话现在正在被打破。
1990年美国伯克利大学的A.Y.Liu和M.L.Cohen在国际著名期刊上发表论文,在理论上预言了一种自然界并不存在的物质β-C3N4,理论计算表明,这种C3N4物质比金刚石的硬度还大,不仅如此,这种物质还可用作蓝紫激光材料,并有可能是一种性能优异的非线性光学材料。
这篇论文发表以后,在世界科学领域引起了很大的轰动,并引发了材料界争相合成β-C3N4的热潮,虽然大块的β-C3N4晶体至今尚未合成出来,但含有β-C3N4晶粒的薄膜材料已经制备成功并验证了理论预测的正确性,这比材料本身更具重大意义。
其晶体结构见图1和图2。
⑴请分析β-C3N4晶体中,C原子和N原子的杂化类型以及它们在晶体中的成键情况:
;
⑵请在图1中画出β-C3N4的一个结构基元,该结构基元包括个碳原子和个氮原子;
⑶实验测试表明,β-C3N4晶体属于六方晶系,晶胞结构见图2(图示原子都包含在晶胞内),晶胞参数a=0.64nm,c=0.24nm,请列式计算其晶体密度。
ρ=;
⑷试简要分析β-C3N4比金刚石硬度大的原因(已知金刚石的密度为3.51g·cm-3)。
5.(共10分)
⑴β-C3N4晶体中,C原子采取sp3杂化,N原子采取sp2杂化;1个C原子与4个处于四面体顶点的N原子形成共价键,1个N原子与3个C原子在一个近似的平面上以共价键连接(2分)
⑵
⑶从图2可以看出,一个β-C3N4晶胞包括6个C原子和8个N原子,其晶体密度为:
(2分)
⑷β-C3N4比金刚石硬度大,主要是因为:
①在β-C3N4晶体中,C原子采取sp3杂化,N原子采取sp2杂化,C原子和N原子间形成很强的共价键;②C原子和N原子间通过共价键形成网状结构;③密度计算结果显示,β-C3N4的密度大于金刚石,即β-C3N4,晶体中原子采取更紧密的堆积方式,说明原子间的共价键长很短而有很强的键合力(3分)
(20XX年)第11题(共9分)
BaTiO3是一种重要的无机功能材料,工业上常用以下方法制得:
将BaCl2、TiCl4、H2O和H2C2O4混合反应后,经洗涤、干燥后得一组成为Ba30.50%、Ti10.70%、C10.66%、H1.81%的白色粉末A,进一步热分解A即可得BaTiO3。
用热分析仪测定A的热解过程,得下图所示的质量—温度关系曲线:
图中400K、600K和900K时对应的样品的质量分别为8.38mg、5.68mg和5.19mg
试回答:
⑴A的化学式为;
⑵在600K时样品的组成为;
⑶晶体结构分析表明,BaTiO3为立方晶体,晶胞参数a=7.031Å,一个晶胞中含有一个BaTiO3‘‘分子”。
画出BaTiO3的晶胞结构示意图,分别指出Ba2+、Ti(IV)、O2-三种离子所处的位置及其配位情况。
11.(共9分)
⑴BaTiO(C2O4)2·4H2O(2分)
⑵
BaTi2O5+
BaCO3(2分)
⑶
Ba2+:
12个O2-形成的多面体(1分)
Ti(Ⅳ):
6个O2-形成的八面体(1分),
O2-:
2个Ti(Ⅳ)和4个Ba2+形成的八面体(1分)
(20XX年)第6题(共4分)
铌酸锂(LiNbO3)是性能优异的非线性光学晶体材料,有多种性能,用途广泛,在滤波器、光波导、表面声波、传感器、Q-开关以及激光倍频等领域都有重要的应用价值,因而是一种重要的国防、工业、科研和民用晶体材料。
铌酸锂的优异性能与它的晶体结构是密不可分的,单晶X-射线衍射测试表明,铌酸锂属三方晶系,晶胞参数a=b=5.148Å,c=13.863Å;密度为4.64g/cm3沿着c轴方向的投影见下图,其中Li和Nb原子投影重合,它们处于氧原子投影的六边形中心。
⑴请在下图表示的二维晶体结构上画出一个结构基元。
⑵假设下图是某新型晶体材料LiNbA2沿c轴的投影图(A原子取代氧的位置),在这种晶体中,沿a方向两层Nb原子之间夹着两层A原子和一层Li原子。
请写出这种新型晶体材料的晶胞类型,并画出它的一个三维晶胞的透视图。
6.(共4分)
⑴
(2分)
⑵简单六方晶胞
(2分)
(20XX年)第12题(共11分)
20XX年1月美国科学家在Science上发表论文,宣布发现了Al的超原子结构,并预言其他金属原子也可能存在类似的结构,这是一项将对化学、物理以及材料领域产生重大影响的发现,引起了科学界的广泛关注。
这种超原子是在Al的碘化物中发现的,以13个Al原子或14个Al原子形成Al13或Al14超原子结构,量子化学计算结果表明,Al13形成12个Al在表面,1个Al在中心的三角二十面体结构,Al14可以看作是一个Al原子跟Al13面上的一个三角形的3个Al形成Al—Al键而获得的。
文章还指出,All3和All4超原子都是具有40个价电子时最稳定。
⑴根据以上信息可预测Al13和Al14的稳定化合价态分别为和。
A114应具有元素周期表中类化学元素的性质,理由是:
。
⑵对Al13和A114的Al—Al键长的测定十分困难,而理论计算表明,Al13,和Al14中的Al—Al键长与金属铝的Al—Al键长相当,已知金属铝的晶体结构采取面心立方最密堆积,密度约为2.7g/cm3,请估算Al13和Al14:
中Al—Al的键长。
。
⑶Al13三角二十面体中有多少个四面体空隙,假设为正四面体空隙,如果在其中搀杂其他原子,请通过计算估计可搀杂原子的半径最大为多少?
12.(共11分)
⑴-1+2(Al13-Al142+)(2分,各1分)
碱土金属因为Al14容易失去2个电子而呈现+2价(1分)
⑵根据晶体密度公式可得:
故晶胞参数α=405pm
因为金属铝形成面心立方晶胞,所以原子半径与晶胞参数之间的关系为:
所以估计Al-Al键长约为:
2r=2×143pm=286pm(3分)
⑶有20个四面体空隙(2分)
设Al的半径为R,正四面体空隙可以填充的内切球半径为r,
则正四面体边长b=2R,立方体边长
,
立方体对角线为:
所以
(3分)
(20XX年)第9题(7分)
1987年,研究者制出一种高温超导材料钆钡铜氧,其近似化学式为YBa2Cu3O7-(根据正负价平衡,实际上O的个数在6、7之间。
故写为7-或6+),其临界温度(Tc)达到92K。
20多年来,此类研究不断深入,20XX年5月,有研究者称制得了Tc达150K的氧化物超导材料,图A为该超导材料的一个晶胞,其中四方锥和四边形的元素组成如图B所示,且四方锥的顶点和四边形的中心均落在晶胞的棱上。
仔细观察图,回答下列问题:
9-1研究表明这类超导体中都有金属-氧层,即晶胞中在c轴几乎同一高度上排列着金属原子和氧原子。
此晶胞中有个Cu-O层,
在Cu-O层中Cu的配位数是,O的配位数是。
9-2除了Cu-O层以外,此晶体中还有的金属-氧层是。
9-3该晶体的近似化学式为。
9-4研究还发现
(1)当该晶体中金属-氧层完全对称排列时,其临界温度只有87K。
(2)高温超导材料YBa2Cu3O7-中也有Cu-O层。
请据此提出研制新的高温超导材料的一个建议:
第9题(7分)
9-16(1分)42(每空0.5分,共1分)
9-2Ba-O层,(In,Sn)-O层(2分)
9-3(In,Sn)Ba4Tm4Cu6O18+[(In,Sn)Ba4Tm4Cu6O18也算对。
In,Sn个数可用其他方式表达,之和为2即可](2分)
9-4改变金属-氧层的排列方式或用其他元素替换Y或In(1分)
(20XX年)第10题(9分)
锂离子电池、金属氢化物-镍电池(MH-Ni)、无水碱性锌-锰电池、燃料电池、太阳能电池等是21世纪理想的绿色环保电源。
其中液态锂离子电池是指Li+嵌入化合物为正负电极的二次电池。
正极采用锂化合物LiCoO2、LiNiO2或LiMn2O4,负极采用碳电极,充电后成为锂-碳层间化合物LixC6(010-1在电池放电时,Li+在两个电极之间往返嵌入和脱嵌。
写出该电池的充放电反应方程式:
10-2金属锂放电容量(3861mAh·g-1)最大。
其中mAh的意思是指用1毫安(mA)的电流放电1小时(h)。
则:
理论上LiMn2O4的放电容量是mAh·g-1。
10-31965年,Juza提出石墨层间化合物组成是LiC6,锂离子位于石墨层间,其投影位于石墨层面内碳六圆环的中央。
试在下图中用“·”画出Li的位置。
并在此二维图形上画出一个晶胞。
10-4LiC6的晶胞参数a=b=0.426nm。
锂插入后,石墨层间距为0.3706nm。
试以此计算LiC6的密度。
第10题(9分)
10-1LiCoO2+6C
Li1-xCoO2+LixC6(2分)
10-296500×1000÷3600÷181=148mAh·g-1(2分)
10-3位置正确(1分)晶胞(2分)
10-4V=abcsin60°=0.4262×0.3706sin60°=0.058244543nm3×10-23cm3
m=(6.941+12.01×6)/6.02×1023=1.31231×10-22g
ρ=m/V=2.25g·cm-3(2分)
(20XX年)第11题(8分)
C60的发现开创了国际科学的一个新领域,除C60分子本身具有诱人的性质外,人们发现它的金属掺杂体系也往往呈现出多种优良性质,所以掺杂C60成为当今的研究热门领域之一。
经测定C60晶体为面心立方结构,晶胞参数a=1420pm。
在C60中掺杂碱金属钾能生成盐,假设掺杂后的K+填充C60分子堆积形成的全部八面体空隙,在晶体中以K+和C60-存在,且C60-可近似看作与C60分子半径相同的球体。
已知C的范德华半径为170pm,K+的离子半径133pm。
11-1掺杂后晶体的化学式为;晶胞类型为;
如果为C60-顶点,那么K+所处的位置是;处于八面体空隙中心的K+到最邻近的C60-中心的距离是pm。
11-2实验表明C60掺杂K+后的晶胞参数几乎没有发生变化,试给出理由。
11-3计算预测C60球内可容纳的掺杂原子的半径。
第11题(8分)
11-1KC60面心立方晶胞体心和棱心710pm(各1分,共4分)
11-2C60分子形成面心立方最密堆积,由其晶胞参数可得C60分子的半径:
所以C60分子堆积形成的八面体空隙可容纳的球半径为:
r(容纳)=0.414×r(堆积)=0.414×502=208pm
这个半径远大于K+的离子半径133pm,所以对C60分子堆积形成的面心立方晶胞参数几乎没有影响(2分)
11-3因r(C60)=502pm,所以C60球心到C原子中心的距离为:
502-170=332pm
所以空腔半径,即C60球内可容纳原子最大半径为:
332-170=162pm
(20XX年)第10题(8分)
利用氢能离不开储氢材料。
利用合金储氢的研发,以获得重大进展。
研究发现LaNix是一种很好的储氢合金。
(相对原子质量:
La-138.9)
LaNix属六方晶系(图c),晶胞参数a0=511pm,c0=397pm。
储氢位置有两种,分别是八面体空隙(“■”)和四面体空隙(“▲”),见图a、b,这些就是氢原子存储处。
有氢时,设其化学式为LaNixHy。
10-1合金LaNix中x的值为________;晶胞中和“■”同类的八面体空隙有______个,并请在图a中标出;和“▲”同类的四面体空隙有______个,并请在图b中标出。
10-2若每个八面体空隙中均储有H,LaNixHy中y的值是_______。
10-3若H进入晶胞后,晶胞的体积不变,H的最大密度是____________g·cm-3
第10题(8分)
10-15(1分)3(1分)6(1分)
(1分)(1分)
10-23(1分)
10-30.1665(2分)
(20XX年)第11题(7分)
同时具备几种功能的多功能材料往往具有特殊的用途而成为材料领域的热点。
南京师大结构化学实验室最近设计合成了一种黄色对硝基苯酚水合物多功能晶体材料:
C6H5NO3·1.5H2O。
实验表明,加热至94℃时该晶体能由黄色变成鲜亮的红色,在空气中温度降低又变为黄色,即具有可逆热色性;同时实验还表明它具有使激光倍频的二阶非线性光学性质。
X-射线衍射结果表明该晶体属于单斜晶系,晶胞参数a=2119.8pm,b=367.5pm,c=1037.6pm,α=γ=90.0°,β=117.2°,密度1.535g·cm-3,在晶体中水分子通过氢键把对硝基酚分子连接起来而形成层状结构。
11-1在上述晶体中形成氢键的氧原子坐标为(0.87,0.88,0.40;0.49,0.91,0.34;0.50,0.42,0.50),请计算晶体中氢键的键长。
11-2预期上述晶体材料可以作为掺杂材料的主体,在层间嵌入某种金属离子而形成具有特殊功能的掺杂材料,嵌入离子的密度与材料性质密切相关。
假设在晶体中每个苯环通过静电与一个嵌入离子相互作用,试计算每立方厘米上述晶体能嵌入离子的数目。
11-3热分析试验表明,当温度升高到94℃时该晶体开始失重,到131℃重量不再变化,比原来轻了16.27%。
试给出该晶体完全变色后的化学式;并据此分析具有可逆热色性的原因;设计一个简单的实验来验证这种分析。
第11题(7分)
11-1
γ氢键=245.8pm(2分)
11-2晶胞体积V=2119.8*367.5*1037.6sin(180—117.2)=7.189
根据密度计算公式可得每个晶胞中含苯环数:
每立方厘米包含的嵌入离子数:
(2分)
11-3C6H5NO3·1.5H2O的相对分子质量是166,166的16.27%刚好是1.5个H2O的重量,
说明从变色开始到完全变色是因为该晶体失去全部结晶水,从而变色后的化学式为C6H5NO3。
具有可逆热色性的原因是:
晶体加热到某一温度失去结晶水,晶体结果发生变化;温度降低,晶体又可以吸收空气中的水而是晶体结果幅员从而颜色复原。
验证实验:
把加热变色后的晶体防入实验室的干燥器中,会发现在温度降低后颜色不能复原,而拿到空气下晶体颜色很快就能复原,说明吸收了空气中的水而使晶体结构得到了还原。
所以失水和吸水是该晶体呈现可逆热色性的根本原因(3分)
(20XX年)11.(共10分)
热电材料又称温差电材料,是一种利用材料本身温差发电和制冷的功能材料,在能源与环境危机加剧和提倡绿色环保的21世纪,具有体积小、重量轻、无传动部件和无噪声运行等优点的热电材料引起了材料研究学者的广泛重视。
近来,美国科学家在国际著名学术期刊Science上报道了一种高效低温的热电材料,下图是其沿某一方向的一维晶体结构。
图1
图2
11-1在上图中画出它们的结构基元;结构基元的化学式分别为图1_________,图2___________。
11-2现在,热材料的研究主要集中在金属晶体上,Ti就是制备热电材料的重要金属之一,已知Ti的原子半径为145pm,作A3型堆积,请计算金属晶体Ti的晶胞参数和密度。
11-3电热晶体NiTiSn是著名的Half-Heusler化合物结构,Sn作A1型堆积,Ti填充Sn的八面体空隙,Ni在Ti的周围形成四面体,并且相邻Ni-Ti和Ni-Sn距离相等,试画出一个NiTiSn的晶胞结构图,并用文字说明Ni的位置。
11-4纳米粒子的量子尺寸可以显著提高材料的热电性能,表面原子占总原子数的比例是其具有量子尺寸效应的重要影响因素,假设某NiTiSn颗粒形状为立方体,边长为NiTiSn晶胞边长的2倍,试计算表面原子占总原子数的百分比(保留一位小数)。
第11题(10分)
参考答案:
11-1
(1分)
(1分)
注:
实线或虚线部分画一个即可。
结构基元的化学式分别是图1CdBr3,图2Bi2Te3。
(各1分)
11-2晶胞参数:
Ti作A3型堆积,所以为如图所示六方晶胞。
在A3型堆积中取出六方晶胞,平行六面体的底是平行四边形,则晶胞参数:
a=b=2r=2⨯145=290pm
由晶胞可以看出,六方晶胞的边长c为四面体高的两倍,即:
晶体密度:
平行四边形的面积:
(2分)
11-3NiTiSn的晶胞结构图:
Ni处在Sn的一半四面体空隙中,(或Ni处在一半小立方体中)。
(2分)
11-4边长为NiTiSn晶胞边长2倍的纳米颗粒的总原子数=53+4×8=157
表面原子数=52×6-8×2-12×3=98或:
表面原子数=53-33=98
表面原子数/总原子数=98/157=62.4%(2分)