全国大联考陕西新课标Ⅱ陕西省咸阳市届高三模拟考试二理综化学试题解析版.docx
《全国大联考陕西新课标Ⅱ陕西省咸阳市届高三模拟考试二理综化学试题解析版.docx》由会员分享,可在线阅读,更多相关《全国大联考陕西新课标Ⅱ陕西省咸阳市届高三模拟考试二理综化学试题解析版.docx(18页珍藏版)》请在冰豆网上搜索。
全国大联考陕西新课标Ⅱ陕西省咸阳市届高三模拟考试二理综化学试题解析版
陕西省咸阳市2018届高三模拟考试
(二)
理综化学试题
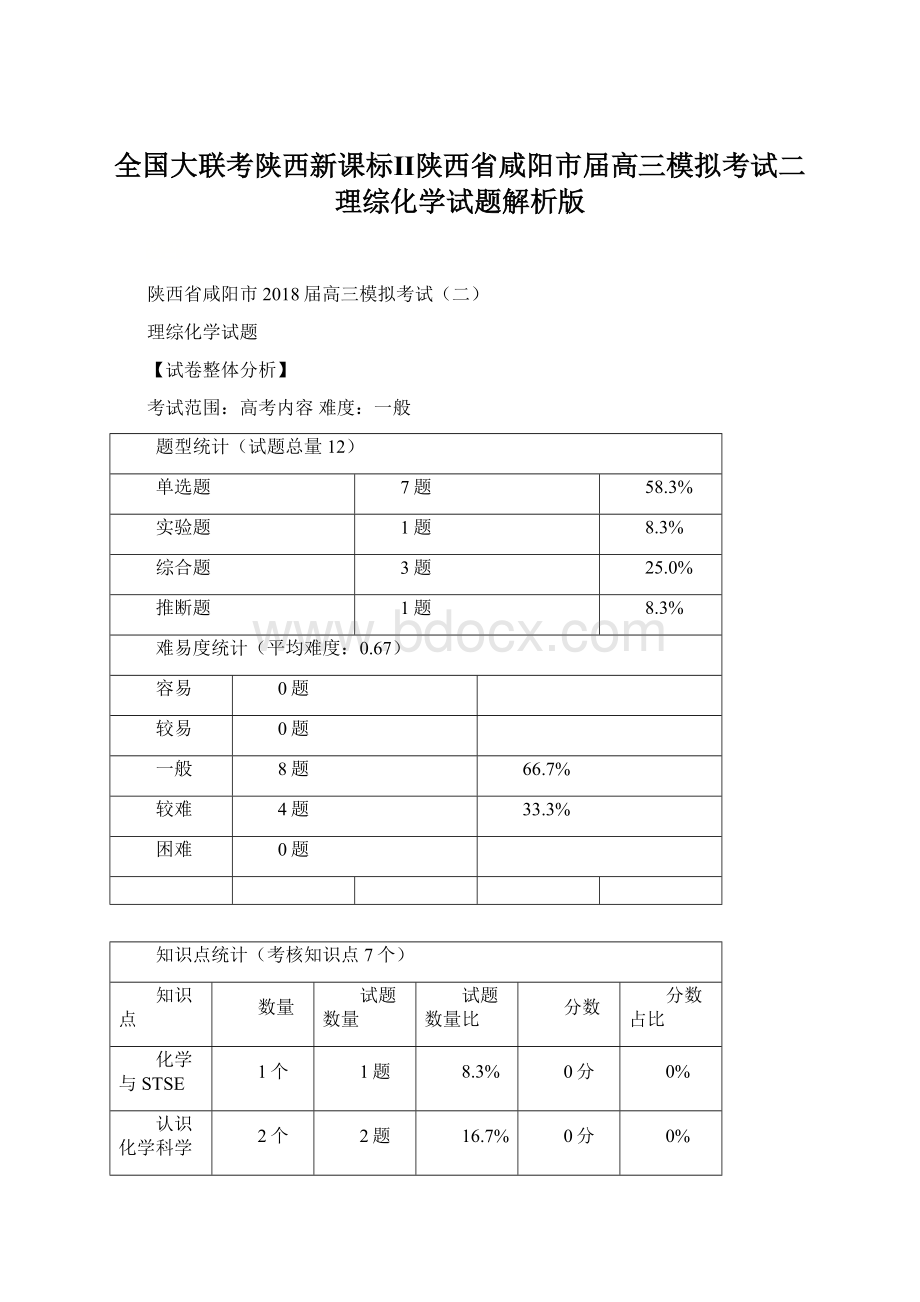
【试卷整体分析】
考试范围:
高考内容难度:
一般
题型统计(试题总量12)
单选题
7题
58.3%
实验题
1题
8.3%
综合题
3题
25.0%
推断题
1题
8.3%
难易度统计(平均难度:
0.67)
容易
0题
较易
0题
一般
8题
66.7%
较难
4题
33.3%
困难
0题
知识点统计(考核知识点7个)
知识点
数量
试题数量
试题数量比
分数
分数占比
化学与STSE
1个
1题
8.3%
0分
0%
认识化学科学
2个
2题
16.7%
0分
0%
常见无机物及其应用
1个
1题
8.3%
0分
0%
有机化学基础
2个
2题
16.7%
0分
0%
化学反应原理
4个
4题
33.3%
0分
0%
化学实验基础
1个
1题
8.3%
0分
0%
物质结构与性质
1个
1题
8.3%
0分
0%
【题型考点分析】
题号
题型
知识点
1
单选题
物质的转化
2
单选题
化学科学对人类文明发展的意义
3
推断题
有机物的合成
4
综合题
化学反应原理综合考查
5
单选题
原电池原理理解
6
实验题
化学实验探究
7
单选题
酸碱中和滴定的综合考查
8
单选题
硝酸的强氧化性
9
综合题
物质结构与性质综合考查
10
单选题
同分异构体的数目的确定
11
单选题
阿伏加德罗常数的求算
12
综合题
化学反应原理综合考查
陕西省咸阳市2018届高三模拟考试
(二)
理综化学试题
第I卷(选择题)
1.化学与人类的生活、生产息息相关,下列叙述正确的是
A.“青蒿一握,以水二升渍,绞取计”,提取青蒿素的过程属于化学变化
B.《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的碱是K2CO3
C.日常生活中常用汽油去除衣物上的油污,用热的纯碱溶液洗涤炊具上的油污,两者的原理完全相同
D.“84消毒液”的有效成分为NaClO,“洁厕灵”的有效成分为HC1,若将两者混合使用,其杀菌效果和去除厕所污溃的效果都将加强
【答案】B
【解析】提取青蒿素的过程属于物理变化,故A错误;草木灰中含有K2CO3,K2CO3溶液显碱性可以去污,故B正确;用汽油去除衣物上的油污,利用油污易溶于汽油的性质,用热的纯碱溶液洗涤炊具上的油污,利用油污在碱性条件下的水解的性质,故C错误;NaClO与HC1生成有毒的氯气,故D错误。
2.设NA为阿伏加德罗常数的值,下列叙述正确的是
A.所含共价键数均为0.2NA的白磷(P4)和甲烷的物质的量相等
B.1L1mol/LH2O2的水溶液中含有的氧原子数为2NA
C.将1molFe与一定量的稀硝酸充分反应,转移的电子数可能为2NA
D.1L0.1mol/LCH3COONa溶液中含有的Na+和CH3COO-的总数为0.2NA
【答案】C
【解析】白磷分子中含有6个共价键、甲烷分子中含有4个共价键,所含共价键数均为0.2NA的白磷(P4)和甲烷的物质的量不相等,故A错误;H2O2、H2O中都含有氧原子,故B错误;1molFe与一定量的稀硝酸充分反应恰好生成硝酸亚铁时转移的电子数为2NA,故C正确;CH3COO-水解,1L0.1mol/LCH3COONa溶液中含有的Na+和CH3COO-的总数小于0.2NA,故D错误。
3.下列实验操作能达到实验目的的是
选项
实验目的
实验操作
A
测定NaClO溶液的PH
用玻璃棒蘸取NaClO溶液点在PH试纸上,与标准比色卡对照
B
非金属性Cl>C
将稀盐酸滴入碳酸钠溶液中
C
稀硫酸有氧化性
向硝酸亚铁溶液中加入稀硫酸,充分反应后滴加KSCN溶液
D
比较乙醇中羟基氢原子与水
中氢原子的活泼性
分别将少量钠投入到盛有水和乙醇的烧杯中
【答案】D
【解析】NaClO溶液能漂白,不能用PH试纸测NaClO溶液的PH,故A错误;盐酸是无氧酸,不能根据盐酸的酸性大于碳酸得出非金属性Cl>C,故B错误;向硝酸亚铁溶液中加入稀硫酸,硝酸根离子在酸性条件下把Fe2+氧化为Fe3+,不能体现稀硫酸的氧化性,故C错误;钠与水反应比钠与乙醇反应剧烈,故D正确。
点睛:
向硝酸亚铁溶液中加入稀硫酸,发生反应是
,充分反应后滴加KSCN溶液,溶液变为血红色。
4.有机物M、N、Q的转化关系为
,下列说法不正确的是
A.M的名称为异丁烷
B.N的同分异构体有7种(不考虑立体异构,不包括本身)
C.M
N、N
Q的反应类型分别为取代反应和消去反应
D.M、N、Q均能使溴水层褪色,但原理不同
【答案】A
5.下列各选项中,物质之间通过一步反应就能实现如图所示变化的是
选项
甲
乙
丙
丁
A
Al
AlCl3
Al2O3
NaAlO2
B
S
H2S
SO2
SO3
C
Na
Na2O
NaOH
Na2O2
D
N2
NH3
NO
NO2
【答案】A
【解析】Al与氯气反应生成AlCl3,Al与反应生成Al2O3,Al与氢氧化钠溶液反应生成NaAlO2,Al2O3与氢氧化钠溶液反应生成NaAlO2,故A正确;S单质不能直接生成SO3,故B错误;NaOH不能直接生成Na2O2,故C错误;N2与氧气不能直接生成NO2,故D错误。
6.常温下,取浓度均为0.1mol/L的HX溶液和ROH溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol·L-1盐酸进行滴定。
滴定过程中溶液的pH随滴加溶液的体积变化关系如图所示。
下列说法正确的是
A.HX为强酸,ROH为弱碱x/*-+kw
B.滴定前,ROH溶液中存在c(ROH)>c(OH-)>c(R+)>c(H+)
C.曲线Ⅱ:
滴定至V=10mL时存在2c(OH-)-c(H+)=c(HX)-c(X-)
D.滴定至V=40mL的过程中,两种溶液中由水电离出的c(H+)·c(OH-)不变
【答案】B
【解析】常温下,0.1mol/L的HX溶液的PH=3,0.1mol/L的ROH溶液PH=11,所以HX为弱酸、ROH为弱碱,故A错误;根据电荷守恒,滴定前,ROH溶液中存在c(ROH)>c(OH-)>c(R+)>c(H+),故B正确;曲线Ⅱ是用氢氧化钠溶于滴定HX,滴定至V=10mL时,溶质是等浓度的HX、NaX,根据物料守恒和电荷守恒,存在2c(OH-)-2c(H+)=c(HX)-c(X-),故C错误;滴定至V=40mL的过程中盐酸、氢氧化钠均过量,两种溶液中由水电离出的c(H+)·c(OH-)先增大后减小,故D错误。
7.“软电池”采用一张薄层纸片作为传导体,一面为锌,另一面为二氧化锰,纸层中水和氧化锌组成电解液。
电池总反应为:
Zn+2MnO2+H2O=2MnO(OH)+ZnO。
下列说法正确的是
A.该电池的正极为氧化锌
B.锌电极附近溶液的PH不变
C.电池正极反应式:
2MnO2+2e-+2H2O=2MnO(OH)+2OH-
D.当0.1molZn完全溶解时,流经电解液的电子的物质的量为0.2mol
【答案】C
【解析】根据总反应,MnO2发生还原反应,MnO2是正极,故A错误;锌电极是负极,负极反应是Zn-2e-+2OH-=ZnO+H2O,溶液的PH减小,故B错误;根据总反应,正极反应式:
2MnO2+2e-+2H2O=2MnO(OH)+2OH-,故C正确;电解液中通过离子移动导电,没有电子流动,故D错误。
第II卷(非选择题)
8.某学习小组为探究镁及其化合物的性质,查阅资料知:
ⅰ
Mg3N2遇水发生水解反应
ⅱ
2NO2+2NaOH=NaNO2+NaNO3+H2O
NO2+NO+2NaOH=2NaNO2+H2O
ⅲ
常溫下,NH3·H2O、CH3COOH的电离常数均为1.8×10-5
I.探究镁的性质。
为探究镁与二氧化氮反应的产物,设计如图所示实验装置。
(1)简述检查该装置气密性的方法________;B装置的作用是___________.
(2)实验时,当A装置中充满红棕色气体时点燃酒精灯,这样操作的目的是_______。
(3)确定有N2生成的实验现象是__________。
(4)实验完毕,为确认产物中有Mg3N2,取少量A中固体于试管中,滴加蒸馏水,_______,则产物中有氮化镁。
(5)经测定,Mg与NO2反应生成MgO、Mg3N2和N2,其中Mg3N2和N2的物质的量相等。
请写出A中发生反应的化学方程式:
___________________
Ⅱ.探究Mg(OH)2在氯化铵溶液中溶解的原因。
供选试剂有:
氢氧化镁、蒸馏水、硝酸铵溶液、盐酸、醋酸铵溶液。
取少量氢氧化镁粉末于试管中,向其中加人足量饱和氯化氨溶液,振荡,白色粉末全部溶解。
为了探究其原因,他们依据Mg(OH)2(s)==Mg2+(aq)+2OH-(aq)提出两种假设。
假设1:
氯化铵溶液呈酸性,H++OH-=H2O,促进Mg(OH)2溶解;
假设2:
NH4++OH-=NH3·H2O,促进Mg(OH)2溶解。
(6)请你帮他们设计实验验证哪一种假设正确:
____________.
【答案】关闭止水夹K,用酒精灯微热硬质玻璃管,气球膨胀,冷却后,气球恢复原状,则装置气密性良好吸收C中挥发出来的水蒸气排尽装置内空气,避免O2、CO2、N2等与镁反应C中产生气泡,气球的体积变得更大若有刺激性气味的气体逸出,该气体能使湿润红色石蕊试纸变蓝色11Mg+4NO2
8MgO+Mg3N2+N2;(写成4Mg+2NO2
4MgO+N2、3Mg+N2
Mg3N2也给分)取少量氢氧化镁于试管中,加入足量CH3COONH4溶液,若白色固体溶解,则假设2正确;若白色固体不溶解,则假设1正确。
【解析】试题分析:
I.
(1)根据热胀冷缩原理检验装置气密性;P2O5是干燥剂,Mg3N2遇水发生水解反应,所以需要防止C中挥发出来的水蒸气进入A;
(2)镁是活泼金属,能与O2、CO2、N2等反应;(3)NO2、NO能溶于氢氧化钠溶液;氮气不溶于氢氧化钠溶液;(4)Mg3N2遇水发生水解反应生成氢氧化镁和氨气;(5)根据得失电子守恒配平方程式;Ⅱ.CH3COONH4溶液呈中性,若氢氧化镁能溶于CH3COONH4溶液,则证明假设2正确;
9.以方铅矿(主要成分是PbS,含少量ZnS、Fe、Ag)为原料提炼铅及其化合物的工艺流程如下:
请回答下列问题:
(1)流程中“趁热过滤”的目的是______,滤渣的主要成分是_________。
(2)该工艺流程中可循环利用的物质是____________。
(3)浊液1中通入适量氯气时,发生反应的离子方程式为____________。
(4)《药性论》中有关铅丹(Pb3O4)的描述是:
“治惊悸狂走,呕逆,消渴。
”向铅丹中滴加浓盐酸时,产生黄绿色气体,请写出发生反应的化学方程式_________。
(5)取一定量含有Pb2+、Cu2+的工业废水,向其中滴加Na2S溶液,当PbS开始沉淀时,溶液中c(Pb2+)/c(Cu2+)=_______。
[已知Kp(PbS)=3.4×10-28,Kp(CuS)=1.3×10-36]
(6)炼铅和用铅都会使水体因重金属铅的含量增大而造成严重污染。
水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-。
各形态的浓度分数x与溶液PH变化的关系如下图所示:
①探究Pb2+的性质:
向含Pb2+的溶液中逐滴滴加NaOH溶液,溶液变浑浊,继续滴加NaOH溶液又变澄清;pH>13时,溶液中发生的主要反应的离子方程式为________。
②除去溶液中的Pb2+:
科研小组用一种新型试剂可去除水中的铅和其他杂质离子,实验结果记录如下:
离子
Pb2+
Ca2+
Fe3+
Mn2+
处理前浓度(mg/L)
0.100
29.8
0.12
0.087
处理后浓度(mg/L)
0.004
22.6
0.04
0.053
由表可知该试剂去除Pb2+比Fe3+效果好,请用表中有关数据说明_________.
【答案】防止PbCl2结晶析出Ag和Fe(OH)3盐酸2Fe2++Cl2=2Fe3++2Cl-Pb3O4+8HCl(浓)=3PbCl2+Cl2↑+4H2O2.6×108Pb(OH)3-+OH-=Pb(OH)42-加入该试剂,Pb2+的浓度转化率为(0.1-0.004)÷0.1×100%=96%;Fe3+的浓度转化率为(0.12-0.04)÷0.12×100%=67%,所以该试剂去除Pb2+比Fe3+效果好
【解析】试题分析:
(1)PbCl2溶解度随温度升高而增大;根据流程图,滤液中含有Pb2+、Zn2+;
(2)根据流程图,开始需要加入盐酸,最后产物有盐酸;(3)浊液1中通入适量氯气,氯化亚铁被氧化为氯化铁;(4)Pb3O4与浓盐酸发生氧化还原反应生成氯气和PbCl2;(5)Kp(PbS)=3.4×10-28>Kp(CuS)=1.3×10-30,当PbS开始沉淀时,一定有CuS沉淀,c(Pb2+)/c(Cu2+)等于溶度积的比;(6)①根据图示,pH>13时,Pb(OH)3-与氢氧化钠反应生成Pb(OH)42-;②根据浓度转化率分析;
解析:
(1)PbCl2溶解度随温度升高而增大,流程中“趁热过滤”可以防止PbCl2结晶析出;根据流程图,滤液中含有Pb2+、Zn2+,所以滤渣中有Ag和Fe(OH)3;
(2)根据流程图,开始需要加入盐酸,最后产物有盐酸,可循环利用的物质是盐酸;(3)浊液1中通入适量氯气,氯化亚铁被氧化为氯化铁,反应离子方程式是2Fe2++Cl2=2Fe3++2Cl-;(4)Pb3O4与浓盐酸发生氧化还原反应生成氯气和PbCl2,反应化学方程式是Pb3O4+8HCl(浓)=3PbCl2+Cl2↑+4H2O;(5)Kp(PbS)=3.4×10-28>Kp(CuS)=1.3×10-36,当PbS开始沉淀时,一定有CuS沉淀,c(Pb2+)/c(Cu2+)=Kp(PbS)/Kp(CuS)=
2.6×108;(6)①pH>13时,Pb(OH)3-与氢氧化钠反应生成Pb(OH)42-,反应离子方程式是Pb(OH)3-+OH-=Pb(OH)42-;②加入该试剂,Pb2+的浓度转化率为(0.1-0.004)÷0.1×100%=96%;Fe3+的浓度转化率为(0.12-0.04)÷0.12×100%=67%,所以该试剂去除Pb2+比Fe3+效果好。
10.研究化学反应原理对于生产、生活及环境保护具有重要意义。
请回答下列问题:
(1)常温下,物质的量浓度均为0.1mol/L的四种溶液:
①NH4I;②CH3COONa;③(NH4)2SO4;④Na2CO3,pH从大到小排列顺序为__________(填序号)。
(2)苯乙烯是工业上合成树脂、离子交换树脂及合成橡胶等的重要单体,工业上可用乙苯催化脱氢方法制备苯乙烯:
。
①已知乙苯(g)、苯乙烯(g)的燃烧热分别为akJ/mol,bkJ/mol,则氢气的燃烧热为___kJ/mol(用含有Q、a、b的表达式表示,其中Q、a、b均大于0)。
②在实际生产中,在恒压条件下常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),此时乙苯的平衡转化率与水蒸气的用量、压强(p)的关系如下图所示。
Ⅰ.加入水蒸气稀释剂能提高乙苯转化率的原因是__________
Ⅱ.用平衡分压代替平衡浓度计算平衡常数(Kp),其中,分压=总压×物质的量分数,则900K时的平衡常数Kp=________.x^k*w
Ⅲ.改变下列条件,能使乙苯的反应速率和转化率一定增大的是_______(填字母)。
A.恒容时加入稀释剂水蒸气
B.压强不变下,温度升至1500K
C.在容积和温度不变下充入Ar
D.选用催化效果更好的催化剂
(3)利用“Na-CO2”电池将CO2变废为宝。
我国科研人员研制出的可充电“Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2
2Na2CO3+C。
放电时该电池“吸入”CO2,其工作原理如图所示:
①放电时,正极的电极反应式为___________。
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2mol电子时,两极的质量差为______g。
(假设放电前两电极质量相等)
【答案】④>②>①>③Q+a-b体系总压强不变时,充人水蒸气,相当于反应体系减压,故平衡向气体物质的量增大的方向移动,乙苯转化率增大2p/19B3CO2+4Na++4e-=2Na2CO3+C15.8
【解析】试题分析:
(1)NH4I、(NH4)2SO4都是强酸弱碱盐,溶液显酸性,铵根离子浓度越大,酸性越强;CH3COONa、Na2CO3都是强碱弱酸盐,溶液显碱性,碳酸根离子水解程度大于醋酸根离子;
(2)根据盖斯定律计算氢气的燃烧热;②Ⅰ.通入水蒸气相当于减压,平衡正向移动;Ⅱ.利用“三段式”计算Kp;Ⅲ.根据影响反应速率和影响平衡移动的因素分析;(3)①放电时,正极得电子发生还原反应;②根据总反应,转移0.2mol电子时,负极消耗0.2molNa,正极生成0.1nolNa2CO3和0.05molC;
解析:
(1)NH4I、(NH4)2SO4都是强酸弱碱盐,溶液显酸性,铵根离子浓度越大,酸性越强;CH3COONa、Na2CO3都是强碱弱酸盐,溶液显碱性,碳酸根离子水解程度大于醋酸根离子,所以同浓度的①NH4I;②CH3COONa;③(NH4)2SO4;④Na2CO3,pH从大到小排列顺序为④>②>①>③;
(2)
①
②C8H10(g)+
O2(g)
8CO2(g)+5H2O(l)
-akJ/mol
③C8H8(g)+10O2(g)
8CO2(g)+4H2O(l)
-bkJ/mol,根据盖斯定律②-①-③,得氢气的燃烧热为(Q+a-b)kJ/mol;②Ⅰ.通入水蒸气相当于减压,平衡正向移动,所以加入水蒸气稀释剂能提高乙苯转化率;水与乙苯的比为8,压强为2P,900K时,乙苯的转化率为50%,
;ⅢA.恒容时加入稀释剂水蒸气,体积增大,反应物浓度减小,速率速率降低,故A错误;B.正反应吸热,温度升至1500K,速率加快,平衡正向移动,故B正确;C.在容积和温度不变下充入Ar,反应物浓度不变,所以速率不变,平衡不移动,故C错误;D.选用催化效果更好的催化剂,平衡不移动,故D错误。
(3)①放电时,正极CO2得电子发生还原反应,电极反应式是3CO2+4Na++4e-=2Na2CO3+C;②根据总反应,转移0.2mol电子时,负极消耗0.2molNa,正极生成0.1nolNa2CO3和0.05molC,所以两极的质量差为
15.8g。
点睛:
燃烧热是1mol可燃物完全燃烧完成温度氧化物放出的热量,碳元素生成二氧化碳,氢元素生成液态水。
根据盖斯定律,化学反应的焓变只与反应的始态和终态有关,与反应途径无关,所以可以根据盖斯定律计算氢气的燃烧热;
11.根据要求回答下列问题:
(1)基态氮原子最高能级上电子的自旋方向有________种,硒原子的电子排布式为[Ar]_____。
(2)铁的一种配合物Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于________(填晶体类型)。
(3)与BF3互为等电子体的分子和离子分别为______(各举1例);已知分子中的大π键可用符号Ⅱnm表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Ⅱ66),则BF3中的大π键应表示为________。
(4)金属晶体的四种堆积如下图,金属钠的晶体堆积模型为_______(填字母)。
(5)砷化硼(BAs)晶体结构与金刚石相似,则:
①BAs晶体中,As的杂化形式为_________.
②已知B原子的电负性比As原子的电负性大,则As与B之间存在的化学键有______(填字母)。
A.离子键B.金属键C.极性键D.氢键E.配位键F.σ键G.π键
③BAs晶体的晶胞参数为bpm,则其晶体的密度为______(列出表达式,设NA为阿伏加德罗常数的数值)g/cm3。
【答案】13d104s24p4分子晶体SO3和CO32-(或其他合理答案)Ⅱ64Dsp3CEF
【解析】试题分析:
(1)基态氮原子最高能级是2p,2p能级上有3个自旋方向相同的电子;硒是34号元素;
(2)分子晶体的熔点低;(3)等电子体是原子数相同、价电子数也相同的分子或离子;每个氟原子有1个P轨道上的2个电子参与形成大π键;(4)金属钠的晶体堆积模型为体心立方最密堆积;(5)①金刚石中碳原子的杂化形式为sp3;②As与B都是非金属原子,存在极性共价键;B原子存在空的P轨道,As存在孤对电子,之间存在配位键;单键是σ键;③根据均摊原则计算BAs晶胞中As、B原子数;根据
计算密度;
解析:
(1)基态氮原子最高能级是2p,2p能级上有3个自旋方向相同的电子,所以基态氮原子最高能级上电子的自旋方向有1种;硒是34号元素,核外有34个电子,电子排布式为[Ar]3d104s24p4;
(2)Fe(CO)5熔点低,所以属于分子晶体;(3)BF3原子数是4、价电子数是24,BF3互为等电子体的分子和离子分别为SO3和CO32-;B原子提供1个未参与杂化的P轨道,每个氟原子有1个P轨道上的2个电子参与形成大π键,所以成键原子有4个,形成大π键的电子数为6,可表示为Ⅱ64;(4)金属钠的晶体堆积模型为体心立方最密堆积,故选D;(5)①金刚石中碳原子的杂化形式为sp3,砷化硼(BAs)晶体结构与金刚石相似,所以As的杂化形式为sp3;②As与B都是非金属原子,存在极性共价键;B原子存在空的P轨道,As存在孤对电子,之间存在配位键;单键是σ键,所以As与B之间存在极性键、配位键、σ键;③根据均摊原则计算BAs晶胞中As、B原子数分别是
、4,所以晶胞的摩尔质量是
,晶胞的体积是
,所以密度是
。
点睛:
根据均摊原则,立方晶胞顶点的原子被一个晶胞占用
、晶胞楞上的原子被一个晶胞占用
、晶胞面心的原子被一个晶胞占用
。
12.具有抗菌作用的白头翁素衍生物M的合成路线如下图所示:
已知:
ⅰ.RCH2Br
R—HC=CH—R'
ⅱ.R—HC=CH—R'
ⅲ.R—HC=CH—R'
(以上R、R'、R″代表氢、烷基或芳基等)
(1)D中官能团名称为_____,A的化学名称为_____。
(2)F的结构简式为_____,则与F具有相同官能团的同分异构体共_____种(考虑顺反异构,不包含F)。
(3)由G生成H的化学方程式为_____,反应类型为_____。
(4)下列说法不正确的是_____(选填字母序号)。
A.可用硝酸银溶液鉴别B、C两种物质
B.由H生成M的反应是加成反应
C.1molE最多可以与4molH2发生加成反应
d.1molM与足量NaOH溶液反应,消耗4molNaOH
(5)以乙烯为起始原料,结合已知信