高中化学专题复习尾气处理装置练习试题.docx
《高中化学专题复习尾气处理装置练习试题.docx》由会员分享,可在线阅读,更多相关《高中化学专题复习尾气处理装置练习试题.docx(17页珍藏版)》请在冰豆网上搜索。
高中化学专题复习尾气处理装置练习试题
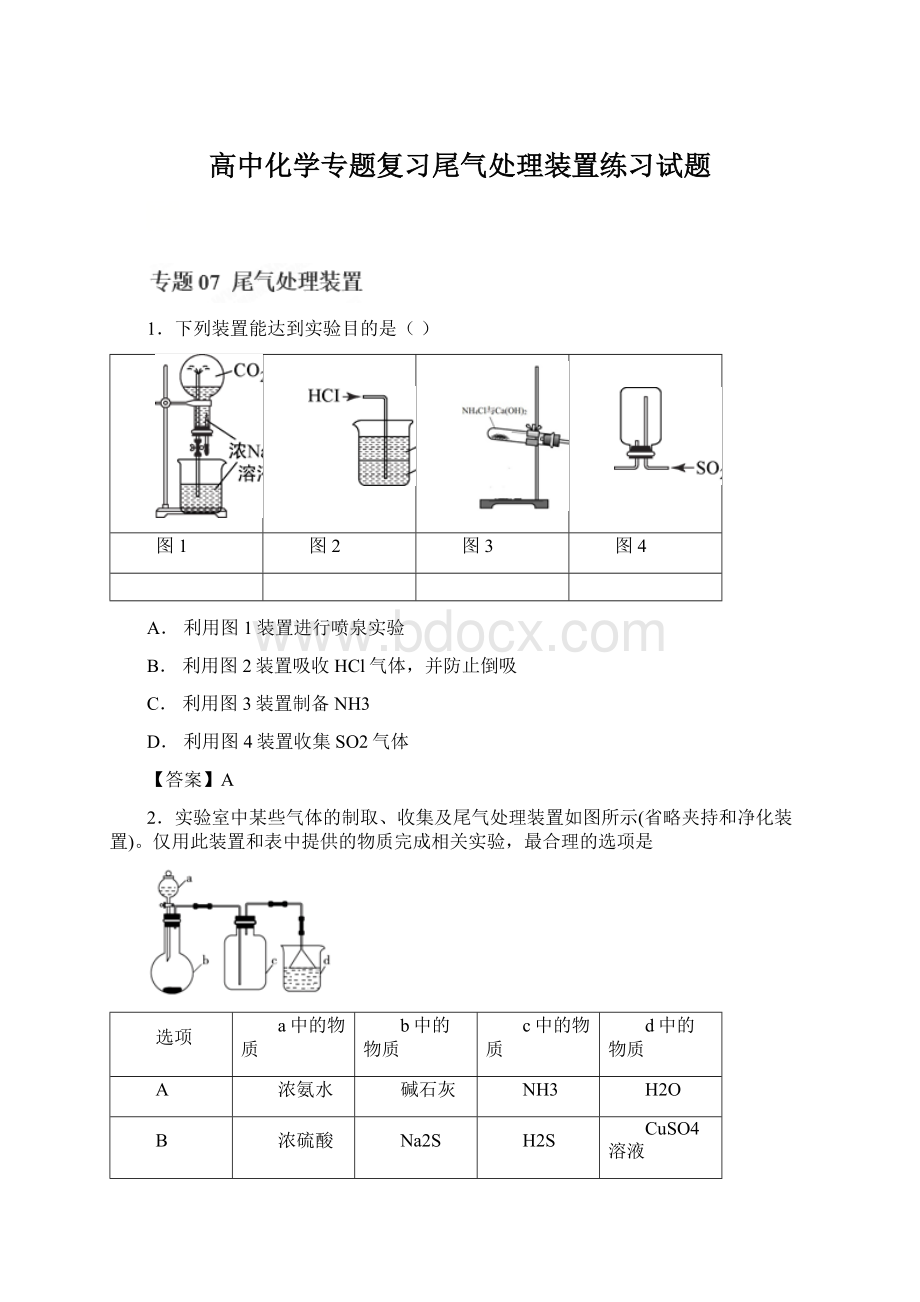
1.下列装置能达到实验目的是()
图1
图2
图3
图4
A.利用图1装置进行喷泉实验
B.利用图2装置吸收HCl气体,并防止倒吸
C.利用图3装置制备NH3
D.利用图4装置收集SO2气体
【答案】A
2.实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。
仅用此装置和表中提供的物质完成相关实验,最合理的选项是
选项
a中的物质
b中的物质
c中的物质
d中的物质
A
浓氨水
碱石灰
NH3
H2O
B
浓硫酸
Na2S
H2S
CuSO4溶液
C
稀盐酸
Na2CO3
CO2
NaOH溶液
D
浓盐酸
MnO2
Cl2
NaOH溶液
【答案】C
【解析】A、实验室可用浓氨水和碱石灰反应制氨气,但NH3的密度比空气小,不能用向上排空气的方法收集,应该用向下排空气的方法收集,故错误。
B、实验室制硫化氢,因硫化氢是酸性气体且有毒,应该用氢氧化钠溶液吸收,故B错误。
C、稀盐酸和碳酸钠反应制二氧化碳,二氧化碳密度
比空气大,可用向上排空气法收集,尾气可用氢氧化钠溶液吸收,故C正确。
D、浓盐酸和二氧化锰反应制氯气需要加热,此装置中无加热装置,故D错误。
学……&科网
3.在实验室里按如图所示的装置来干燥、收集气体R,多余的气体R可用水吸收,则R是
A.H2B.NH3C.Cl2D.HCl
【答案】B
4.有关下列各装置图的叙述,不正确的是( )
A.装置①可用于吸收实验中多余的Cl2
B.装置②可用于收集H2、NH3、Cl2、HCl、NO2等
C.装置③中X为煤油,可用于吸收氨气或氯化氢
D.装置④可用于收集氨气,并吸收多余的氨气
【答案】C
5.用下图所示装置进行实验,装置正确且设计合理的是( )
A.装置①可用于排空气法收集NO气体
B.可用图②所示装置及操作配制一定物质的量浓度的硫酸
C.装置③可用于吸收氨气
D.实验室可用装置④制取NH3
【答案】C
【解析】A.NO易与空气中氧气发生反应,所以不能使用排空气法收集NO气体,故A设计不合理;B.不可用容量瓶稀释浓硫酸,故B设计不合理;C.氨气不溶于CCl4,装置③用于吸收氨气,可防止倒吸,故C装置正确且设计合理;D.NH4Cl受热分解产生的NH3和HCl在温度较低的试管上部重新化合为NH4Cl,所以实验室不可用加热NH4Cl的方法制取NH3,故D设计不合理。
6.实验是化学研究的基础,关于下列各实验装置的叙述中正确的是
A.装置①常用于分离互不相溶液体混合物
B.装置②可用于吸收HCl气体,并防止倒吸
C.以NH4HCO3为原料,装置③可用于实验室制备少量NH3
D.装置④b口进气,用排空气法可收集CO2、NO等气体
【答案】C
【解析】A.装置①常用于分离互溶液体且沸点相差较大的混合物,A错误;B.因氯化氢极易溶于水,装置②中氯化氢直接通入水,易形成倒吸现象,B错误;C.用装置③加热NH4HCO3,产生的杂质气体(CO2、H2O)被碱石灰吸收,此装置可用于实验室制备少量NH3,C正确;D.NO易与空气中氧气反应,不能用装置④排空气法收集NO气体,D错误。
7.关于下列各装置图的叙述中,正确的是
A.若采用装置①铝件镀银,则c极为铝件,d极为纯银,电解质溶液为AgNO3溶液
B.装置②是原电池,能将化学能转化为电能,SO42-移向锌电极
C.装置③中X若为四氯化碳,用于吸收氨气或氯化氢,会引起倒吸
D.装置④可用于收集氨气,并吸收多余的氨气
【答案】B
8.下列实验装置中不能达到实验目的是()
A.装置①可用于制取H2、CO2或NH3
B.装置②可用于氯化氢气体溶于水
C.装置③可用于以NH4Cl和Ca(OH)2固体为原料,实验室制NH3
D.装置④可用于除去Cl2中的HCl
【答案】D
9.实验室可以按如图所示的装置干燥、贮存气体M,多余的气体可用水吸收,则M是( )
A.氨气B.一氧化碳C.二氧化氮D.氯化氢
【答案】A
【解析】收集装置,采用向下排空气法收集,收集的气体,其密度小于空气,有防倒吸装置,在水中溶解度非常大,故选项A正确。
10.实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。
仅用此装置和表中提供的物质完成相关实验,最合理的选项是
选项
a中的物质
b中的物质
c中收集的气体
d中的物质
A
浓氨水
CaO
NH3
H2O
B
浓硫酸
Na2SO3
SO2
NaOH溶液
C
稀硝酸
Cu
NO2
H2O
D
浓盐酸
MnO2
Cl2
NaOH溶液
【答案】B
11.下列实验方案能达到实验目的的是
A.用苯和饱和溴水制溴苯
B.用浓盐酸和铁粉制少量氯气
C.用NaOH溶液除去MgC12溶液中的AlC13杂质
D.用右图所示装置制备乙酸乙酯
【答案】D
【解析】A、苯与液溴在铁作催化剂下,发生取代反应,生成溴苯,故A错误;B、铁和盐酸反应生成氢气,不能制取氯气,故B错误;C、Mg2+和Al3+不与NaOH反应,故C错误;D、能够制备乙酸乙酯,故D正确。
学#¥科网
12.下列装置能达到实验目的是
A.利用图1装置进行喷泉实验B.利用图2装置吸收HCl气体,并防止倒吸
C.利用图3装置制备C12D.利用图4装置收集SO2气体
【答案】A
13.下列实验现象预测、实验设计、仪器使用能达到目的是( )
A.模拟工业制氨气并检验产物
B.实验室采用所示装置收集SO2
C.可用所示装置比较KMnO4、Cl2、S的氧化性强弱
D.可用所示装置验证铁发生析氢腐蚀
【答案】C
【解析】工业制氨气是在高温高压和催化剂的条件下进行的,此处无高压条件,A错误。
二氧化硫密度比空气大,应向上排空气法收集,多余的SO2可用氢氧化钠溶液吸收,B错误。
锥形瓶中有黄绿色气体生成,试管中淡黄色固体生成,说明生了Cl2和S,证明KMnO4、Cl2、S的氧化性依次减弱,C正确。
食盐水主要呈中性,含有溶解的氧气,形成原电池,铁生锈,发生吸氧腐蚀,D错误。
14.某中学化学研究性学习小组利用以下装置制取并探究氨气的性质。
A中试管内盛放的物质是Ca(OH)2、NH4Cl固体。
(实验探究)
(1)A中发生反应的化学方程式为________;
(2)B中盛放的干燥剂为_____,干燥氨气能否用浓硫酸_____(填“能”或“不能”);
(3)若有10.7gNH4Cl固体,最多可制取NH3(标准状况)的体积是_____L;
(4)实验室收集氨气的方法是________;
(5)C、D装置中颜色会发生变化的是_______(填“C”或“D”),红色石蕊试纸变成____色;
(6)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是_______;
(7)为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处理装置,合适的装置是_______(填“F”或“G”)。
学……&科网
【答案】2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O碱石灰不能4.48向下排空气法D蓝色产生大量白烟F
【解析】
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,标准状况下生成NH3的体积为0.2mol×22.4L·mol-1=4.48L。
(4)氨气比空气轻且极易溶于水,所以实验室收集氨气的方法是向下排空气法。
(5)干燥的氨气不会电离,所
15.某化学小组用下列装置抽取收集纯净的氯气,并研究其性质。
请回答下列问题。
(1)装置A中发生反应的离子方程式为___________。
(2)按照气流方向各仪器接口的连接顺序为a→_______→g。
(3)装罝B中浓硫酸的作用是___________。
装置C的试剂最好是___________。
(4)某同学认为上述方案缺少尾气吸收装置,请在下面的方框中画出该装置并注明试剂。
________________________。
(5)把制取的氯气通入下图所示装置中,甲装置溶液中具有氧化性的含氯粒子是______;如何证明乙装置中FeCl2溶液与Cl2发生了反应?
(只回答需要的试剂和现象)________。
【答案】MnO2+4H++2Cl-
Mn2++Cl2+2H2Obcedf吸收水蒸气,干燥氯气饱和食盐水
Cl2、HClO、ClO-KSCN溶液,溶液变成红色。
【解析】试题分析:
(1)实验室制取氯气使用MnO2和浓盐酸。
(2)制备纯净的氯气,先除去HCl杂质,再除去H2O杂质,最后收集。
(3)浓硫酸起到干燥的作用,除去HCl气体杂质使用饱和食盐水。
(4)尾气吸收使用NaOH溶液。
(5)Fe2+被氯气氧化为Fe3+,检验Fe3+使用KSCN溶液,溶液变成血红色;
解析:
(1)实验室制取氯气使用MnO2和浓盐酸,反应的离子方程式为MnO2+4H++2Cl-
Mn2++Cl2+2H2O。
16.甲烷与氯气取代反应的实验是高中化学中的一个重要实验。
某兴趣小组对该实验进行了改进。
回答下列问题:
(1)氯气的制备
①氯气的发生装置若选择上图中的B装置,则该反应的化学方程式为______________;
②欲收集一瓶纯净的氯气,选择上图中的装置,其连接顺序:
发生装置→____________________(按气流方向,用小写字母以箭头连接表示)。
(2)甲烷与氯气的反应将甲烷和上述收集到的氯气按体积比1:
3充入注射器并固定活塞,关闭夹子K,按下图装置(夹持仪器省略)进行实验。
学&……科网
操作步骤
实验现象
解释原因
打开高压汞灯,
光照2min
①注射器内___________,
筒内壁附有少量无色液滴。
②甲烷与氯气生成二氯甲烷的化学方程式为____________
关闭高压汞灯,
待装置恢复至
室温,打开K
液体倒吸进入注射器内,且溶液呈红色。
③___________,
_____________。
【答案】MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2Ok→l→i→j→e→f→g(或在后面加上→h也给分)黄绿色逐渐褪去CH4+2Cl2
CH2Cl2+2HCl反应有HCl生成且极易溶于水HCl溶于水呈酸性
17.硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。
其部分性质如下表:
物质
熔点/℃
沸点/℃
其它性质
SO2Cl2
-54.1
69.1
①易水解产生大量白雾
②易分解:
SO2Cl2=SO2↑+Cl2↑
回答下列问题:
I.实验室合成硫酰氯需要先制取干燥氯气,制备干燥纯净的氯气所用仪器如下图:
(1)上述仪器的连接顺序是:
e接__, 接 , 接 , 接 (按气流方向,用小写字母表示)。
II.催化合成硫酰氯的实验装置如下图(夹持仪器已省略):
(2)仪器B冷却水的进口为________(填“a””或“b”),活性炭的作用是________。
(3)装置D除干燥气体外,另一作用是_________。
若缺少D,则硫酰氯会水解,该反应的化学方程式为________________。
(4)某同学建议将收集器A放在冰水中冷却,你认为该同学的建议是否合理,为什么?
______________________________
(5)C处U形管中碱石灰的作用是__________________________________________。
III.在氯磺酸中加入四氯化锡加热煮沸,使氯磺酸分解,可用于制取少量硫酰氯。
化学方程式为:
2ClSO3H=H2SO4+SO2Cl2,此法得到的产品中混有硫酸。
(6)①从分解产物中分离出硫酰氯的方法是________。
②请设计实验方案检验产品中硫酸的存在(可选试剂:
稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液):
________。
【答案】e接d,c接a,b接i,h接ga催化剂通过观察气泡控制气流速度(或比例)SO2Cl2+2H2O=H2SO4+2HCl合理,防止硫酰氯分解吸收多余SO2、Cl2,防止污染;防止水蒸气进入收集器使产品水解。
蒸馏取适量产品充分加热后加水稀释,分成两份,一份滴加紫色石蕊试液变红,另一份加入BaCl2溶液产生白色沉淀,说明含有H2SO4
18.二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11℃,可用于处理含硫废水。
某小组在实验室中探究ClO2与Na2S的反应。
回答下列问题:
(1)ClO2的制备
已知:
SO2+2NaClO3+H2SO4=2ClO2↑+2NaHSO4
①装置A中反应的化学方程式为____________。
②欲收集干燥的ClO2,选择上图中的装置,其连接顺序为a→________________(按气流方向,用小写字母表示)
③装置D的作用是__________________。
(2)ClO2与Na2S的反应
将上述收集到的ClO2用N2稀释以增强其稳定性,并将适量的稀释后的ClO2通入上图所示装置中充分反应,得到无色澄清溶液。
一段时间后,通过下列实验探究I中反应的产物。
①_________。
②___________。
③___________。
④ClO2与Na2S反应的离子方程式为____________。
用于处理含硫废水时,ClO2相对于Cl2的优点是____________(任写一条)。
学&*科网
【答案】Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2Og→h(或h→g)→b→c→e→f→d冷凝并收集ClO2SO2(答HSO3-、SO32-、SO2和SO32-、SO2和HSO3-、HSO3-和SO32-、及SO2和SO32-、HSO3-均给分)生成白色沉淀(没有答“白色”不给分)加入足量稀硝酸酸化的硝酸银溶液8ClO2+5S2-+4H2O=8Cl-+5SO42-+8H+ClO2除硫效果彻底,氧化产物硫酸根稳定、ClO2在水中的溶解度大、剩余的ClO2不会产生二次污染。
均被还原为Cl-时,二氧化氯得到的电子数是氯气的2.5倍。
【解析】
(1)①装置 A 中反应Cu与浓硫酸制备二氧化硫,化学方程式为:
Cu+2H2SO4(浓)
CuSO4+SO2↑+H2O;故答案为:
Cu+2H2SO4(浓)
CuSO4+SO2↑+H2O;
②二氧化硫从a进入装置B中反应,为防止倒吸,故应在之前有安全瓶,则a→g→h,为反应充分,故再连接B装置中的b,二氧化氯沸点较低,故在D中冰水浴收集,为充分冷却,便于收集,故连接e,最后用氢
19.I、某化学兴趣小组利用以下装置模拟合成氨并制备少量氨水
已知:
加热(85℃)NH4Cl和NaNO2饱和溶液可以制取N2
B中仪器名称是___________________;
⑵为了完成实验,装置从左到右接口的连接顺序是_____
______;
⑶D中玻璃纤维的作用是_________________;
⑷小组中甲同学认为F装置不太合理,实验中会产生倒吸。
乙同学认真分析后认为该装置无需改进,他的理由是________________________;
II、实验探究
⑸该小组同学利用制备的氨水再进行银镜反应实验。
经查阅资料,配制的银氨溶液主要成分是[Ag(NH3)2]OH,小组同学对其组成进行了如下实验探究:
①在洁净的小试管中加入2mL2%的AgNO3溶液,然后边振荡试管边滴加2%的稀氨水溶液,至最初产生的沉淀恰好溶解为止,制得银氨溶液。
②在制得的银氨溶液中加入无水乙醇,溶液变浑浊,过滤,用__________洗涤,得到白色固体;
③将该白色固体用适量蒸馏水溶解,得到无色溶液,用广范pH试纸检验溶液近似呈中性;向溶液中逐滴加入稀盐酸至不再产生沉淀,静置,取上层清液于另一支放有一小片铜的小试管中并微热,发现铜片的表面有气泡产生,遇到空气变成红棕色;另取少量上层清液加过量的NaOH溶液并加热,得到无色刺激性气体。
由此确定通过上述方法制备的白色固体主要成分是___________________;
⑹请根据以上探究,设计实验来制备少量纯净的[Ag(NH3)2]OH溶液:
取2mL2%的AgNO3溶液于洁净的小试管中,_________________,即得到[Ag(NH3)2]OH溶液。
学&*科网
【答案】启普发生器bihfg(或gf)kjl增大气体与催化剂铁触媒的接触面积该反应为可逆反应,反应物的转化率低,NH3中混有较多难溶于水的气体,装置F中不会产生倒吸无水乙醇[Ag(NH3)2]NO3逐滴加入稀NaOH溶液至不再有沉淀生成,过滤,用适量蒸馏水洗涤,再将固体转移至小试管中,逐滴加入2%的稀氨水溶液至沉淀恰好溶解(其它合理答案均可)
[Ag(NH3)2]NO3;
⑹取2mL2%的AgNO3溶液于洁净的小试管中,逐滴加入稀NaOH溶液至不再有沉淀生成,过滤,用适量蒸馏水洗涤,再将固体转移至小试管中,逐滴加入2%的稀氨水溶液至沉淀恰好溶解,即得到[Ag(NH3)2]OH溶液。
20.保险粉(Na2S2O4)有极强的还原性,遇热水或潮湿空气会分解发热,但在碱性环境下较稳定。
回答下列问题:
(1)二氧化硫的制备
①二氧化硫的发生装置可以选择上图中的_____________(填大写字母),反应的化学方程式为______________________。
②欲收集一瓶干燥的二氧化硫,选择上图中的装置,其接口的连接顺序为发生装置→__________________→→______→______→____________。
(按气流方向,用小写字母表示)
(2)保险粉的制备
在35-45℃下,将SO2气体通入锌粉一水悬浮液中(如图),使之发生反应生成ZnS2O4;待反应完全后,移走恒温水浴装置并冷却至室温,向三颈烧瓶中加人18%的NaOH溶液,使之发生反应生成Na2S2O4和Zn(OH)2;经一系列操作后得到无水Na2S2O4样品。
①实验开始时,应先关闭止水夹K3、打开K1和K2,通入一段时间SO2,其原因是__________。
②通过观察_________________,调节止水夹K1来控制SO2的流速。
③由ZnS2O4生成Na2S2O4的化学方程式为_____________。
(3)称取2.0gNa2S2O4样品溶于冷水中,配成100mL吐溶液,取出10mL该溶液于试管中,用0.10mol/L的KMnO4溶液滴定(滴定至终点时产物为Na2SO4和MnSO4),重复上述操作2次,平均消耗溶液12.00mL。
则该样品中Na2S2O4的质量分数为_______(杂质不参与反应)。
【答案】ANa2SO3+H2SO4=Na2SO4+SO2↑+H2Og,h,e,f,i(e)排除装置中的氧气三颈烧瓶(或装置G)中通入二氧化硫导管中的气泡数ZnS2O4+2NaOH=Na2S2O4+Zn(OH)2↓87%
21.某同学类比镁在二氧化碳中的燃烧反应,认为钠和二氧化碳也可以发生反应,他在实验室中选择以下装置对该反应能否发生进行了实验探究。
依据要求回答问题:
(1)二氧化碳的发生装置应选用上述装置中的______(填装置下方对应宇母),反应的化学方程式为________________。
学……&科网
(2)为达到实脸目的,选择上图中的装置,其连接顺序为:
二氧化碳的发生装置→_____________。
(按气流方向,用小写字母表示)。
(3)检查装置气密性良好,装好药品后,打开弹簧夹,待装置中的空气排净后才能点燃酒精灯。
能说明装置中空气已经排净的现象是_____________。
(4)该同学在制取CO2的过程中,向装置B中加入某酸后,发现固体与酸没有接触,为使反应顺利进行,下列可再加入的试剂是_____________。
A.稀硝酸B.H2SO4溶液C.苯D.CCl4
(5)若反应过程中CO2足量,反应结束后,该同学对硬质玻璃管中生成的固体提出了以下猜想:
①生成的固体物质为Na2CO3②生成的固体物质为Na2CO3和C的混合物③生成的固体物质为Na2CO3和Na2O的混合物④生成的固体物质为Na2O和C的混合物。
报告给老师后,老师认为可以排除其中的3种情况,老师排除的理由是________;则钠与CO2反应的化学方程式为____________。
(6)该同学经过反思,认为上述实验设计中存在缺陷。
他查阅资料后得知,PdCl2溶液可以吸收CO,同时得到黑色的Pd。
于是他在装置后加装一个盛PdCl2溶液的吸收装置,该装置中发生反应的化学方程式为____________。
【答案】BCaCO3+2HCl=CaCl2+CO2↑+H2Of→g→d→e→a(b)→b(a)→h→iE中石灰水变浑浊AD在该实验条件下,二氧化碳与单质炭及氧化钠可以发生反应2Na+2CO2
Na2CO3+COCO+PdCl2+H2O=Pd↓+CO2+2HCl
22.氰化钠(化学式NaCN,C元素+2价,N元素-3价)是白色结晶颗粒、易潮解、剧毒、易溶于水、水溶液呈碱性。
氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻污染。
(1)氰化钠溶液呈碱性,其原因是(用离子方程式解释)。
(2)用双氧水处理NaCN产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,写出该反应的化学方程式:
________。
某化学兴趣小组在实验室制备硫代硫酸钠,并检测含氰化钠废水用硫代硫酸钠溶液处理后能否达标排放。
【实验一】实验室通过如下图所示装置制备Na2S2O3。
(3)装置a中盛装Na2S03固体的仪器名称是,装置b的作用是________。
(4)装置c中的产物有Na2S2O3和CO2气体等,实验结束后,装置d中的溶质有NaOH、Na2CO3,还可能有(填化学式)。
(5)实验结束后,在e处最好连接盛____(填“NaOH溶液”“水”或“CCl4”)的注射器,再关闭K2打开K1,防止拆除装置时污染空气。
【实验二】测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:
①废水中氰化钠的最高排放标准为0.50mg.L-l。
,AgI呈黄色,且CN-优先与Ag+反应,
实验如下:
取25.00mL处理后的氰化钠废水于锥形瓶中并滴加几滴KI溶液作指示剂,用1.000×10-4mol.L-l的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为2.50mL。
(6)滴定终点的判断方法是________。
(7)处理后的废水中氰化钠的含量为mg.L-l。
【答案】
(1)CN-+H2O
HCN+OH-;
(2)NaCN+H2O2+H2O=NH3↑+NaHCO3;(3)圆底烧瓶,安全瓶或防倒吸;(4)Na2SO4和Na2SO3;(5)NaOH溶液;(6)滴入最后一滴AgNO3溶液,出现黄色沉淀,且半分钟之内不消失;(7)0.98。
【解析】
(1)氰化钠溶液显碱性,,即CN-发生水解,CN-+H2O
HCN+OH-;
(2)酸式盐只能是NaHCO3,气体能使湿润的红色石蕊试纸变蓝,说明此气体为NH3