模型符号原子结构.docx
《模型符号原子结构.docx》由会员分享,可在线阅读,更多相关《模型符号原子结构.docx(16页珍藏版)》请在冰豆网上搜索。
模型符号原子结构
教师姓名
学生姓名
教材版本
浙教版
学科名称
科学
年级
八年级
上课时间
2月17日
18:
00---20:
00
课题名称
模型和符号
物质与微观粒子
原子结构
教学目标
1.模型,符号的含义、意义和作用
2.组成物质的微观粒子
3.原子模型
教学重点
原子结构模型
教学过程
备注
【知识梳理】
1.模型的含义、意义和作用
(1)含义:
人们通过一定的科学方法,建立一个适当的模型来反映和代替客观对象,并通过研究这个模型来揭示客观对象的形态、特征和本质,这种方法叫模型法。
构建模型常常可以帮助人们认识和理解一些不能直接观察到的事物。
它的类型有:
①某种物体的放大或缩小的复制品;②可以是一幅图、一张表或是一个计算机软件;③有的模型不是简单地表示一个具体事物,而是表示一个过程,如描述水的三态变化的示意图“水的三态变化模型”。
④有的模型是抽象的,如一些数学公式或某些特定的词。
(2)意义和作用:
帮助人们认识和理解一些不能直接观察到的事物。
2.符号的含义、意义和作用
(1)含义:
是指有一定意义的图形、文字等。
如数学运算符号、电路元件符号等。
(2)意义和作用:
用符号能简单明了地表示事物;用符号可避免由于外形不同引起的混乱;用符号可避免表达的文字语言不同而引起的混乱。
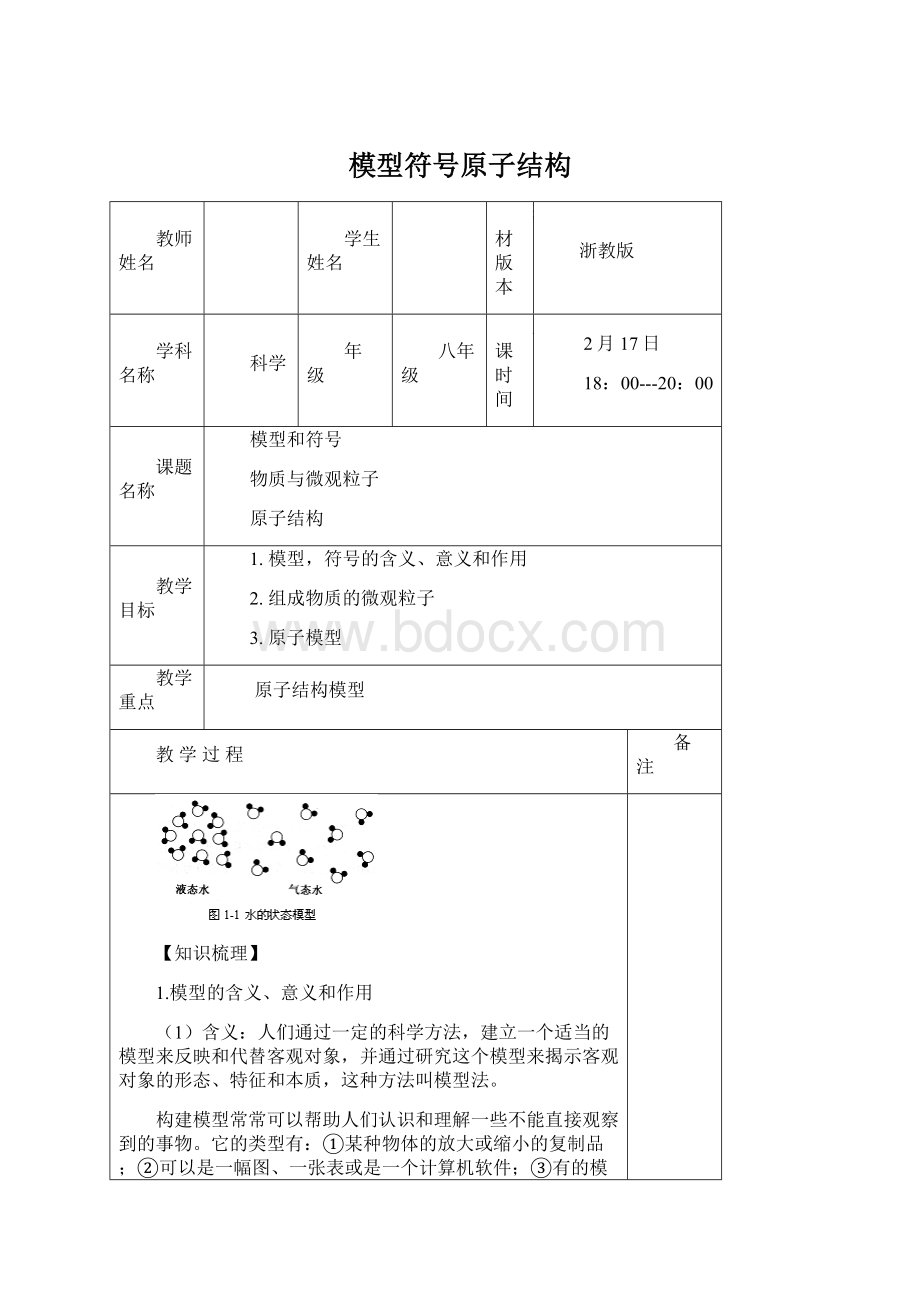
3.对液态水与气态水的状态模型(
表示水分子)的观察。
(1)液态水温度降低时会变成固态的冰,而温度升高时会变成气态的水蒸气。
(2)液态水变成气态水时,构成物质的分子没有发生变化,但是分子之间的距离发生了变化。
(3)在液态水变成气态水的过程中,没有新物质生成,因此,这是物理变化。
【疑难辨析】
例题:
仔细观察下列四幅图片,属于符号的正确选项是()
答案:
A
分析:
B、C属于依照实物的形状和结构按比例制成的物品,属于具体模型。
D是由符号S(路程)、V(速度)、t(时间)三个符号构建起来的抽象模型,是用来描述事物的运动规律的数学表达式。
【基础练习】
1.
请你写出图中的符号所表示的意义:
【提高练习】
1.下列关于模型的说法中,不正确的是……………………………………()
A.一个模型可以是一幅图、一张表或计算机图像
B.模型可以是一个复杂的对象或过程的示意图
C.模型可以表示很大或很小的事物
D.模型只有抽象的,没有具体形象的
2.科学家在1958年发现了C60分子是由60个碳原子构成的,它的形状像足球,因此又叫“足球烯”。
下列图形中,正确表示足球烯结构模型的是…………………()
第2节:
物质与微观粒子模型
(1)
【知识梳理】
1.分子的定义和性质
(1)分子的定义:
分子是构成物质的一种微粒。
在由分子构成的物质中,分子是保持物质化学性质的最小粒子。
(2)分子的性质:
分子很小(肉眼不能看见,需通过扫描隧道显微镜等显微设备来观察)、分子在不断地作无规则运动、分子间有间隔、同种分子化学性质相同。
2.用分子观点解释物理变化和化学变化
由分子构成的物质,发生物理变化时分子本身未变。
发生化学变化时,分子本身发生变化,变成其它物质的分子。
3.原子的定义:
原子是化学变化中的最小粒子。
即在化学变化中原子不能再分。
4.物质的构成与化学性质
(1)物质通常是由分子构成的,如水、氢气、氧气等分别由水分子、氢分子、氧分子等构成。
由分子构成的物质其化学性质由分子保持,如水的化学性质由水分子保持。
(2)有些物质是直接由原子构成的,如铝等金属物质是由铝原子等金属原子直接构成;石墨、硅等物质分别是由碳原子、硅原子等原子直接构成。
由原子直接构成的物质其化学性质由原子直接保持,如金属铝的化学性质由铝原子保持。
【思考解答】
问题1:
水电解生成氢气和氧气的这一实验结果说明了什么?
(1)水是由氢和氧组成的。
(2)水分子由两种不同的、更小的粒子构成的,它们分别是氢原子和氧原子。
问题2:
在电解水的反应中什么发生了变化?
什么没有变化?
水分子发生了变化,而氢原子和氧原子没有发生变化。
【疑难辨析】
例题:
下列关于分子、原子的叙述中,正确的是()
A.分子是保持物质物理性质的微粒
B.物质都是由分子构成的
C.物质的化学性质都是由分子保持的
D.分子是由原子构成的,在化学反应中分子可以再分而原子不能再分
答案:
D
分析:
分子是保持物质化学性质的微粒,物质的物理性质是通过大量分子的聚集体体现出来的。
物质的构成是较为复杂的,有些物质由分子构成的,该种物质的化学性质就由构成它的分子保持。
有些物质是由原子直接构成的,该种物质的化学性质就由构成它的原子直接保持。
有些物质是由离子构成的,该种物质的化学性质就由构成它的离子保持。
【提高练习】
1.为了形象展示水分解的微观过程,某同学制作了如下模型表示相应的微观粒子,其中表示水分解过程中不能再分的微粒的是……………………………………()
2.下面有关分子的正确说法是……( )
①分子由原子构成;
②分子是由一种原子构成的;
③分子是由不同的原子构成的;
④分子构成了所有物质;
⑤分子是构成物质的微粒之一。
A.①②⑤B.③④
C.①②④D.①⑤
11.氧化汞受热时的变化可用下图表示(○表示汞原子,○表示氧原子)。
据图得出的下列结论不正确的是………………()
A.氧化汞受热时能分解成汞和氧气
B.原子是化学变化中的最小的微粒
C.分子在化学变化中可以再分
D.所有的物质都是由分子构成的
12.1993年8月,我国科学家利用超真空扫描隧道显微镜,在一块晶体硅(Si)的表面通过探针的作用搬走原子,写下了“中国”两个字。
下列说法中正确的是………()
A.在上述操作中没有任何变化
B.该变化为化学变化
C.此项技术说明在化学变化中原子可以再分
D.这标志着我国科学家已进入了操纵原子的阶段
13.如下图电解水的过程中水分子分解示意图。
从水分解的过程示意图中你能得出什么样的规律或结论?
(1);
(2);
(3);
(4)。
14.碘是一种由碘分子构成的非金属,某同学利用碘进行了如下的实验:
把少量的固体碘放在湿润的馒头上,发现馒头会变蓝色,再取少量的碘溶解在水中,用馒头去沾取碘液,以现馒头也会变蓝色。
则:
(1)取少量的碘放入烧杯中,用酒精灯加热,碘升华变成碘蒸气,把湿润的馒头放在碘蒸气中,馒头变蓝色(“会”或“不会”)。
(2)把碘溶解在酒精中,可以得到用来消毒用的碘酒,用馒头去沾取少量的碘酒,馒头(“会”或“不会”)蓝色。
(3)请用分子的观点来解释实验中的现象。
(4)现在市场上买来的食盐都是加碘盐,用馒头沾取少量的食盐水,馒头不变蓝色,由此可知,食盐(存在或不存在)碘分子。
第2节:
物质与微观粒子模型
(2)
【知识梳理】
1.不同种类的物质是由构成这些物质分子的原子决定的。
分子的种类由构成分子的原子种类和数目决定的。
构成分子的原子可以是同种原子,也可以是不同种原子。
由于不种分子的分子结构不同,决定了具有不同的化学性质。
2.同种原子可以构成各种结构不同的物质。
如金刚石、石墨、足球烯(C60)都是由碳原子构成的,但结构是不一样的,性质也就不相同。
3.粒子的大小与质量
分子和原子都有一定的质量和体积。
原子的体积很小,原子半径一般在10-10米数量级;原子的质量也非常小,原子的质量数量级一般在10-26千克。
不同种类的原子质量不同,体积也不相同。
4.原子和分子区别和联系
相同点:
都具有微观粒子的共性,体积很小,质量也非常小,不断运动,粒子间有一定间隔;同种物质的分子(原子)化学性质相同,不同种物质的分子(原子)化学性质不同。
不同点:
在由分子构成物中,分子是保持物质化学性质的最小粒子,分子在化学变化中可以再分。
原子是化学变化中的最小粒子,原子在化学变化中不能再分。
联系:
分子是由原子构成的。
分子在化学变化中可以分成原子。
5.化学反应的微观解释
在化学反应中,分子可以分成原子,原子不能再分,分成的各种原子经重新组合形成新的分子,从而聚集成新物质。
有的原子可以直接聚集成新物质。
【疑难辨析】
例题:
下列关于分子和原子的叙述中正确的是()
A.分子比原子的体积大得多
B.分子比原子的质量大得多
C.海绵能吸水说明分子间有间隔
D.氧气分子(O2)和臭氧分子(O3)具有不同的性质
答案:
D
分析:
分子是由原子构成的,但不是意味着自然界中所有分子的体积和质量一定会比原子小;海绵能吸水,说明海绵物质间存在大量空隙,不能说明分子间有空隙;不同物质由于构成其分子的原子在种类、数目上的不同而导致分子结构上的不同会使物质有不同的性质,或由于原子的排列方式不同导致物质结构的不同会使物质有不同的性质。
【提高练习】
7.科学研究发现:
氮气不活泼,在3000℃时仅有0.1%的氮气分子分裂。
在0℃常压条件下,向密闭容器M中充入一定量氮气,而后升高温度(不超过300℃,压强不变),若该密闭容器的体积增大了一倍,则M内分子变化的示意图合理的是()
8.如图所示,
表示1个甲分子,
表示1个乙分子。
已知1个甲分子与3个乙分子在一定条件下反应生成2个丙分子,则1个丙分子可表示为…………………()
9.(2007年,南通)科学家发现在特殊条件下,水能表现出许多有趣的结构和性质。
一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”,下图为其计算机模拟图。
下列说法正确的是…()
A.水结成“热冰”的过程中原子个数发生变化
B.上述变化过程中分子间间隔没有发生变化
C.在弱电场下,水分子的分子结构发生变化
D.利用该性质,人们在常温常压下可建成溜冰场
9.(2007年,哈尔滨)下图是甲烷与氧气反应的微观示意图:
请通过比较、归纳,回答下列问题
(1)一个甲烷分子和一个二氧化碳分子的不同点是;
(2)氧分子、二氧化碳分子、水分子的相同点是;
(3)根据上述示意图,请从微观角度描述你获得的关于化学变化的一个信息
。
第3节:
原子结构的模型
(1)
【知识梳理】
1.对原子结构的认识是通过科学家不断地建立与修正原子结构模型而得到的。
2.原子结构
【思考解答】
1.氦原子核外有2个电子,你能建立一个氦原子的模型吗?
(用图表示)
2.分析下表(查课本附表):
在一个原子中哪些项目总是相等的?
同种原子:
核电荷数=质子数=核外电子数。
此外,还可得出:
(1)同种原子:
核电荷数和中子数不一定相等;
(2)不同种原子核电荷数一定不相等;
(3)有的原子的中子数可以为0。
【提高练习】
10.在分子、原子、质子、中子、电子、原子核这些粒子中:
(1)能直接构成物质的粒子有。
(2)能保持物质化学性质的粒子有。
(3)显示电中性的粒子有。
(4)带正电荷的粒子有。
(5)带负电荷的粒子有。
(6)质量最小的粒子有。
(7)参加化学反应时,一定发生变化的粒子有。
(8)在同一原子里数目相等的有。
11.1999年诺贝尔化学奖获得者艾哈迈德·泽维尔开创了“飞秒(10-10~10-15S)化学”的新领域,使运用激光技术观测化学反应时分子中原子的运动成为可能。
你认为该技术不能观察到的是…………()
A.氧分子分解成氧原子的过程
B.氧原子结合成氧分子的过程
C.氧分子的无规则运动
D.氧原子内部质子、中子、电子的运动
12.最新科技报道,夏威夷联合会天文中心的科学家在宇宙中发现了氢元素的一种新粒子,它的组成可用H3+表示。
1个H3+粒子中含有个质子,个电子。
13.人们为揭示原子结构的奥秘,经历了漫长的探究过程。
自1897年汤姆生发现电子并提出类似“西瓜”的原子模型(如图所示)后,1911年著名物理学家卢瑟福等人为探索原子的内部结构又进行了如图所示的实验。
他们在用一束带正电的、质量比电子大得多的高速运动的α粒子轰击金箔时发现:
①大多数α粒子能穿透金箔而不改变原来的运动方向;②一小部分α粒子改变了原子的运动方向;③有极少数α粒子被弹了回来。
请你根据对原子结构的认识,分析出现上述现象的原因:
(1)现象①:
。
(2)现象②:
。
(3)现象③:
。
第3节:
原子结构的模型
(2)
【知识梳理】
1.元素:
具有相同核电荷数(即质子数)的同一类原子总称为元素。
如氧元素就是所有氧原子的总称。
2.同位素:
原子中原子核内质子数相同,中子数不相同的同一类原子统称为同位素原子。
大多数元素都有同位素原子。
如氢有氕、氘、氚三种同位素原子,我们依次用符号写成
,表示它们的质子数均为1,中子数依次为0、1、2。
同位素原子在工业、农业、医疗、国防等方面有着广泛的应用,如化学分析、消除细菌、医学诊断、发电等。
3.离子
(1)离子的定义:
离子的带电的原子或原子团。
带正电的叫阳离子,如钠离子(符号Na+);带负电的叫阴离子,如氯离子(符号Cl-)。
(2)离子与原子的关系:
离子和原子间可通过得失电子实现相互转化。
(3)离子与分子、原子一样也是构成物质的基本粒子。
如氯化钠(俗称食盐)由钠离子(Na+)和氯离子(Cl-)构成;硫酸铜晶体由铜离子(Cu2+)和硫酸根离子(SO42-)构成。
【思考解答】
同种元素的不同种原子,它们的质子数、中子数、电子数都相吗?
同种元素的不同种原子,它们的质子数、电子数相同,中子数不相同。
【疑难辨析】
例题:
如图所示是金属钠在氯气中燃烧时的电子得失图,根据下述信息可得出哪些结论?
答案:
(1)原子得失电子会带上电荷显电性变成离子;
(2)失去电子的原子变成阳离子,得到电子的原子变成阴离子;(3)离子也是构成物质的一种微粒;(4)氯化钠本身不显电性。
分析:
从图中观察可以推断出:
钠原子、氯原子在自然界中属于不稳定结构,需通过得失电子来达到稳定结构。
钠原子失去一个电子变成带正电荷的阳离子,氯原子得到一个电子变成带负电的阴离子。
化学性质稳定的阴离子(氯离子)和阳离子(钠离子)通过静电作用相互吸引构成了稳定的化合物氯化钠。
从整个过程我们可以分析出以上信息。
【提高练习】
9.(2007年,台州)1934年,卢瑟福等科学家通过核反应发现氢的同位素原子——氚。
氚可用表示(其中“l”表示核电荷数),氚原子的模型如图所示,图中“●”表示的粒子是………………………()
A.原子核
B.质子
C.中子
D.核外电子
10.(2006年,南京)“2005年中国十大科技进展新闻”之一:
我国科学家成功实现首次单分子自旋态控制。
这是世界上首次实现单个分子内部的化学反应。
单个分子内部的化学反应中发生变化的是…()
A.原子个数B.原子种类
C.分子种类D.元素种类
11.(2005年,宿迁)科学家发现某些原子具有放射性,即原子能自动地放射出一些固定的粒子。
据此推断,当一种元素的原子经过放射变化后,结果变成了另一种元素的原子。
它一定是放射了…………()
A.电子B.中子
C.质子D.该原子的原子核
12.(2007年,长沙)关于分子、原子、离子的说法,其中正确的是…………()
A.原子是最小的粒子,不可再分
B.钠原子的质子数大于钠离子的质子数
C.当二氧化碳气体变成干冰时,二氧化碳分子间不存在间隔
D.分子、原子、离子都可以直接构成物质
13.下表是四种单原子核的微粒,请填写下列表格,并回答有关问题:
粒子序号
质子数
中子数
电子数
带电性
1
1
1
0
2
1
0
不带电
3
1
0
2
4
11
12
不带电
表中(填:
序号,下同)属于同种元素,互称同位素。
属于阳离子的是。
【小结】
课后小结
上课情况:
课后需再巩固的内容:
配合需求
家长
学管师
学科组长审批
教研主任审批