第八章 细胞通讯.docx
《第八章 细胞通讯.docx》由会员分享,可在线阅读,更多相关《第八章 细胞通讯.docx(21页珍藏版)》请在冰豆网上搜索。
第八章细胞通讯
第八章细胞通讯
第三节膜表面受体介导的信号转导
亲水性化学信号分子(包括神经递质、蛋白激素、生长因子等)不能直接进入细胞,只能通过膜表面的特异受体传递信号,使靶细胞产生效应。
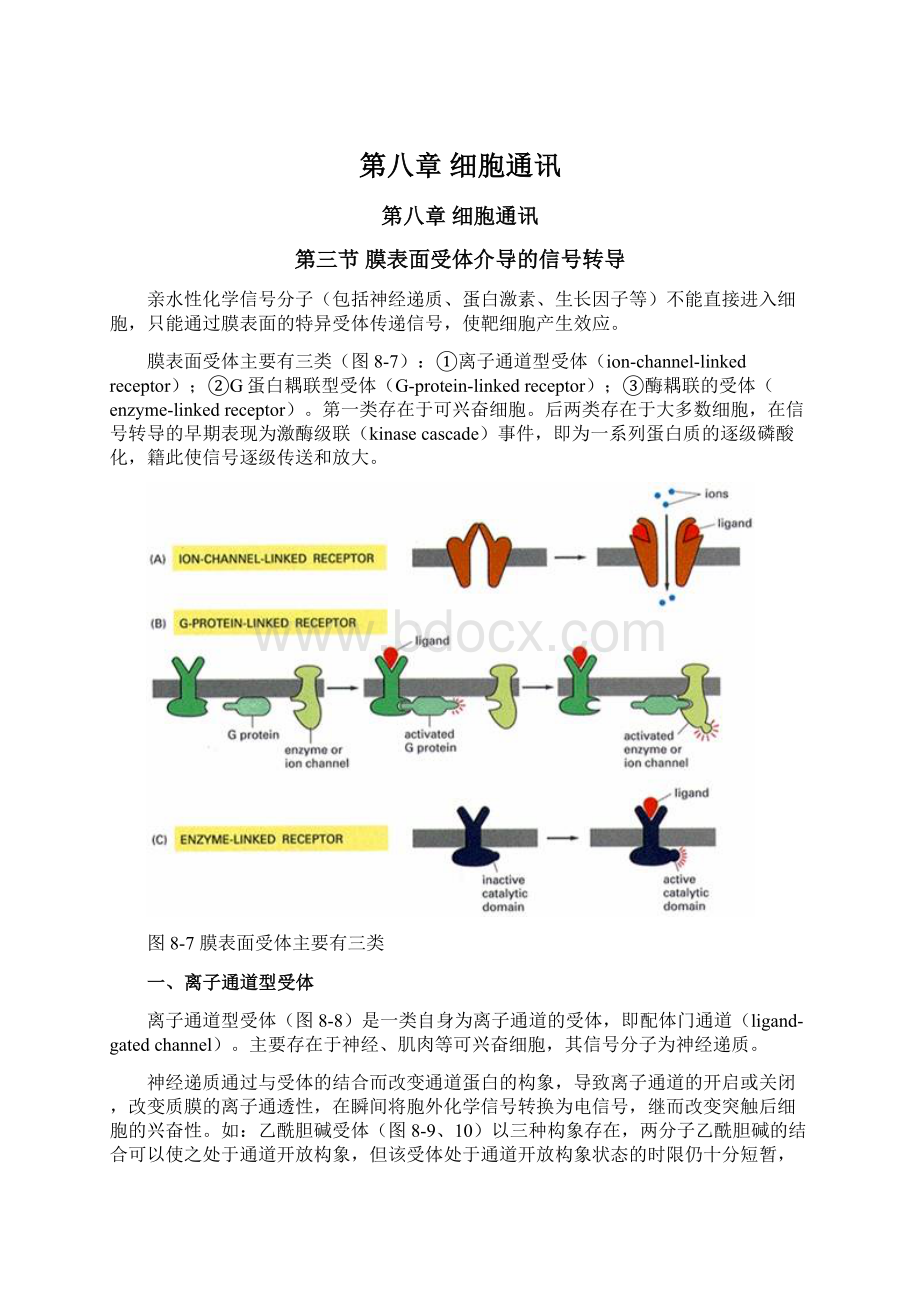
膜表面受体主要有三类(图8-7):
①离子通道型受体(ion-channel-linkedreceptor);②G蛋白耦联型受体(G-protein-linkedreceptor);③酶耦联的受体(enzyme-linkedreceptor)。
第一类存在于可兴奋细胞。
后两类存在于大多数细胞,在信号转导的早期表现为激酶级联(kinasecascade)事件,即为一系列蛋白质的逐级磷酸化,籍此使信号逐级传送和放大。
图8-7膜表面受体主要有三类
一、离子通道型受体
离子通道型受体(图8-8)是一类自身为离子通道的受体,即配体门通道(ligand-gatedchannel)。
主要存在于神经、肌肉等可兴奋细胞,其信号分子为神经递质。
神经递质通过与受体的结合而改变通道蛋白的构象,导致离子通道的开启或关闭,改变质膜的离子通透性,在瞬间将胞外化学信号转换为电信号,继而改变突触后细胞的兴奋性。
如:
乙酰胆碱受体(图8-9、10)以三种构象存在,两分子乙酰胆碱的结合可以使之处于通道开放构象,但该受体处于通道开放构象状态的时限仍十分短暂,在几十毫微秒内又回到关闭状态。
然后乙酰胆碱与之解离,受体则恢复到初始状态,做好重新接受配体的准备。
离子通道型受体分为阳离子通道,如乙酰胆碱、谷氨酸和五羟色胺的受体,和阴离子通道,如甘氨酸和γ-氨基丁酸的受体。
图8-8离子通道型受体
图8-9乙酰胆碱受体结构模型
图8-10乙酰胆碱受体的三种构象
图8-11神经肌肉接点处的离子通道型受体
二、G蛋白耦联型受体
三聚体GTP结合调节蛋白(trimericGTP-bindingregulatoryprotein)简称G蛋白,位于质膜胞质侧,由α、β、γ三个亚基组成,α和γ亚基通过共价结合的脂肪酸链尾结合在膜上,G蛋白在信号转导过程中起着分子开关的作用(图8-12),当α亚基与GDP结合时处于关闭状态,与GTP结合时处于开启状态,α亚基具有GTP酶活性,能催化所结合的ATP水解,恢复无活性的三聚体状态,其GTP酶的活性能被RGS(regulatorofGproteinsignaling)增强。
RGS也属于GAP(GTPaseactivatingprotein)。
G蛋白耦联型受体为7次跨膜蛋白(图8-13),受体胞外结构域识别胞外信号分子并与之结合,胞内结构域与G蛋白耦联。
通过与G蛋白耦联,调节相关酶活性,在细胞内产生第二信使,从而将胞外信号跨膜传递到胞内。
G蛋白耦联型受体包括多种神经递质、肽类激素和趋化因子的受体,在味觉、视觉和嗅觉中接受外源理化因素的受体亦属G蛋白耦联型受体。
图8-12G蛋白分子开关
图8-13G蛋白耦联型受体为7次跨膜蛋白
由G蛋白耦联受体所介导的细胞信号通路主要包括:
cAMP信号通路和磷脂酰肌醇信号通路。
(一)cAMP信号途径
在cAMP信号途径中,细胞外信号与相应受体结合,调节腺苷酸环化酶活性,通过第二信使cAMP水平的变化,将细胞外信号转变为细胞内信号。
1、cAMP信号的组分
①.激活型激素受体(Rs)或抑制型激素受体(Ri);
②.活化型调节蛋白(Gs)或抑制型调节蛋白(Gi);
③.腺苷酸环化酶(Adenylylcyclase):
是相对分子量为150KD的糖蛋白,跨膜12次。
在Mg2+或Mn2+的存在下,腺苷酸环化酶催化ATP生成cAMP(图8-14)。
图8-14腺苷酸环化酶
④.蛋白激酶A(ProteinKinaseA,PKA):
由两个催化亚基和两个调节亚基组成(图8-15),在没有cAMP时,以钝化复合体形式存在。
cAMP与调节亚基结合,改变调节亚基构象,使调节亚基和催化亚基解离,释放出催化亚基。
活化的蛋白激酶A催化亚基可使细胞内某些蛋白的丝氨酸或苏氨酸残基磷酸化,于是改变这些蛋白的活性,进一步影响到相关基因的表达。
图8-15蛋白激酶A
⑤.环腺苷酸磷酸二酯酶(cAMPphosphodiesterase):
可降解cAMP生成5’-AMP,起终止信号的作用(图8-16)。
图8-16cAMP的降解
2、Gs调节模型
当细胞没有受到激素刺激,Gs处于非活化态,α亚基与GDP结合,此时腺苷酸环化酶没有活性;当激素配体与Rs结合后,导致Rs构象改变,暴露出与Gs结合的位点,使激素-受体复合物与Gs结合,Gs的α亚基构象改变,从而排斥GDP,结合GTP而活化,使三聚体Gs蛋白解离出α亚基和βγ基复合物,并暴露出α亚基与腺苷酸环化酶的结合位点;结合GTP的α亚基与腺苷酸环化酶结合,使之活化,并将ATP转化为cAMP。
随着GTP的水解α亚基恢复原来的构象并导致与腺苷酸环化酶解离,终止腺苷酸环化酶的活化作用。
α亚基与βγ亚基重新结合,使细胞回复到静止状态。
活化的βγ亚基复合物也可直接激活胞内靶分子,具有传递信号的功能,如心肌细胞中G蛋白耦联受体在结合乙酰胆碱刺激下,活化的βγ亚基复合物能开启质膜上的K+通道,改变心肌细胞的膜电位。
此外βγ亚基复合物也能与膜上的效应酶结合,对结合GTP的α亚基起协同或拮抗作用。
霍乱毒素能催化ADP核糖基共价结合到Gs的α亚基上,致使α亚基丧失GTP酶的活性,结果GTP永久结合在Gs的α亚基上,使α亚基处于持续活化状态,腺苷酸环化酶永久性活化。
导致霍乱病患者细胞内Na+和水持续外流,产生严重腹泻而脱水。
该信号途径涉及的反应链可表示为:
激素→G蛋白耦联受体→G蛋白→腺苷酸环化酶→cAMP→依赖cAMP的蛋白激酶A→基因调控蛋白→基因转录(图8-17)。
图8-17Gs调节模型
不同细胞对cAMP信号途径的反应速度不同,在肌肉细胞1秒钟之内可启动糖原降解为葡糖1-磷酸(图8-18),而抑制糖原的合成。
在某些分泌细胞,需要几个小时,激活的PKA进入细胞核,将CRE结合蛋白磷酸化,调节相关基因的表达。
CRE(cAMPresponseelement)是DNA上的调节区域(图8-19)。
图8-18cAMP信号与糖原降解
图8-19cAMP信号与基因表达
3、Gi调节模型
Gi对腺苷酸环化酶的抑制作用可通过两个途径:
①通过α亚基与腺苷酸环化酶结合,直接抑制酶的活性;②通过βγ亚基复合物与游离Gs的α亚基结合,阻断Gs的α亚基对腺苷酸环化酶的活化(图8-20)。
百日咳毒素催化Gi的α亚基ADP-核糖基化,结果降低了GTP与Gi的α亚基结合的水平,使Gi的α亚基不能活化,从而阻断了Ri受体对腺苷酸环化酶的抑制作用,但尚不能解释百日咳症状与这种作用机理有关。
图8-20Gi调节模型
(二)磷脂酰肌醇途径
在磷脂酰肌醇信号通路中胞外信号分子与细胞表面G蛋白耦联型受体结合,激活质膜上的磷脂酶C(PLC-β),使质膜上4,5-二磷酸磷脂酰肌醇(PIP2)水解成1,4,5-三磷酸肌醇(IP3)和二酰基甘油(DG)两个第二信使,胞外信号转换为胞内信号(图8-21),这一信号系统又称为“双信使系统”(doublemessengersystem)。
图8-21磷脂酰肌醇途径
IP3与内质网上的IP3配体门钙通道结合,开启钙通道,使胞内Ca2+浓度升高。
激活各类依赖钙离子的蛋白。
用Ca2+载体离子霉素(ionomycin)处理细胞会产生类似的结果(图8-22)。
DG结合于质膜上,可活化与质膜结合的蛋白激酶C(ProteinKinaseC,PKC)。
PKC以非活性形式分布于细胞溶质中,当细胞接受刺激,产生IP3,使Ca2+浓度升高,PKC便转位到质膜内表面,被DG活化(图8-22),PKC可以使蛋白质的丝氨酸/苏氨酸残基磷酸化是不同的细胞产生不同的反应,如细胞分泌、肌肉收缩、细胞增殖和分化等。
DG的作用可用佛波醇酯(phorbolester)模拟。
图8-22IP3和DG的作用
Ca2+活化各种Ca2+结合蛋白引起细胞反应,钙调素(calmodulin,CaM)由单一肽链构成,具有四个钙离子结合部位。
结合钙离子发生构象改变,可激活钙调素依赖性激酶(CaM-Kinase)。
细胞对Ca2+的反应取决于细胞内钙结合蛋白和钙调素依赖性激酶的种类。
如:
在哺乳类脑神经元突触处钙调素依赖性激酶Ⅱ十分丰富,与记忆形成有关。
该蛋白发生点突变的小鼠表现出明显的记忆无能。
IP3信号的终止是通过去磷酸化形成IP2,或被磷酸化形成IP4。
Ca2+由质膜上的Ca2+泵和Na+-Ca2+交换器将抽出细胞,或由内质网膜上的钙泵抽进内质网(图8-23)。
图8-23Ca2+信号的消除
DG通过两种途径终止其信使作用:
一是被DG-激酶磷酸化成为磷脂酸,进入磷脂酰肌醇循环;二是被DG酯酶水解成单酯酰甘油。
由于DG代谢周期很短,不可能长期维持PKC活性,而细胞增殖或分化行为的变化又要求PKC长期活性所产生的效应。
现发现另一种DG生成途径,即由磷脂酶催化质膜上的磷脂酰胆碱断裂产生的DG,用来维持PKC的长期效应。
(三)其它G蛋白偶联型受体
1.化学感受器中的G蛋白
气味分子与化学感受器中的G蛋白偶联型受体结合,可激活腺苷酸环化酶,产生cAMP,开启cAMP门控阳离子通道(cAMP-gatedcationchannel),引起钠离子内流,膜去极化,产生神经冲动,最终形成嗅觉或味觉。
2.视觉感受器中的G蛋白
黑暗条件下视杆细胞(或视锥细胞)中cGMP浓度较高,cGMP门控钠离子通道开放,钠离子内流,引起膜去极化,突触持续向次级神经元释放递质。
视紫红质(rhodopsin,Rh)为7次跨膜蛋白,含一个11顺-视黄醛。
是视觉感受器中的G蛋白偶联型受体,光照使Rh视黄醛的构象变为反式,Rh分解为视黄醛和视蛋白(opsin),构象改变的视蛋白激活G蛋白(transducin,Gt),G蛋白激活cGMP磷酸二酯酶,将细胞中的cGMP水解。
从而关闭钠通道,引起细胞超极化,产生视觉。
可见胞内cGMP水平下降的负效应信号起传递光刺激的作用(图8-24)。
视觉感受器的换能反映可表述为:
光信号→Rh激活→Gt活化→cGMP磷酸二酯酶激活→胞内cGMP减少→Na+离子通道关闭→离子浓度下降→膜超极化→神经递质释放减少→视觉反应。
图8-24视觉感受器中的G蛋白
(四)小G蛋白
小G蛋白(SmallGProtein)因分子量只有20~30KD而得名,同样具有GTP酶活性,在多种细胞反应中具有开关作用。
第一个被发现的小G蛋白是Ras,它是ras基因[5]的产物。
其它的还有Rho,SEC4,YPT1等,微管蛋白β亚基也是一种小G蛋白。
小G蛋白的共同特点是,当结合了GTP时即成为活化形式,这时可作用于下游分子使之活化,而当GTP水解成为GDP时(自身为GTP酶)则回复到非活化状态。
这一点与Gα类似,但是小G蛋白的分子量明显低于Gα。
在细胞中存在着一些专门控制小G蛋白活性的小G蛋白调节因子,有的可以增强小G蛋白的活性,如鸟苷酸交换因子(guaninenucleotideexchangefactor,GEF)和鸟苷酸解离抑制因子(GuaninenucleotidedissociationInhibitor,GDI),有的可以降低小G蛋白活性,如GTP酶活化蛋白(GTPaseactivatingprotein,GAP)。
三、酶耦联型受体
酶偶联型受体(enzymelinkedreceptor)分为两类,其一是本身具有激酶活性,如肽类生长因子(EGF,PDGF,CSF等)受体;其二是本身没有酶活性,但可以连接非受体酪氨酸激酶,如细胞因子受体超家族。
这类受体的共同点是:
①通常为单次跨膜蛋白[6];②接受配体后发生二聚化而激活,起动其下游信号转导。
已知六类:
①受体酪氨酸激酶、②酪氨酸激酶连接的受体、③受体酪氨酸磷脂酶、④受体丝氨酸/苏氨酸激酶⑤受体鸟苷酸环化酶、⑥组氨酸激酶连接的受体(与细菌的趋化性有关)。
(一)受体酪氨酸激酶
1、酪氨酸激酶
酪氨酸激酶可分为三类:
①受体酪氨酸激酶,为单次跨膜蛋白,在脊椎动物中已发现50余种;②胞质酪氨酸激酶,如Src家族、Tec家族、ZAP70、家族、JAK家族等;③核内酪氨酸激酶如Abl和Wee。
受体酪氨酸激酶(receptorproteintyrosinekinases,RPTKs)的胞外区是结合配体结构域,配体是可溶性或膜结合的多肽或蛋白类激素,包括胰岛素和多种生长因子。
胞内段是酪氨酸蛋白激酶的催化部位,并具有自磷酸化位点(图8-25)。
配体(如EGF)在胞外与受体结合并引起构象变化,导致受体二聚化(dimerization)形成同源或异源二聚体,在二聚体内彼此相互磷酸化胞内段酪氨酸残基,激活受体本身的酪氨酸蛋白激酶活性。
这类受体主要有EGF、PDGF、FGF等(图8-26)。
图8-25受体酪氨酸激酶的二聚化和自磷酸化
图8-26各类受体酪氨酸激酶
2、信号分子间的识别结构域
信号转导分子中存在着一些大约由50~100个氨基酸构成的结构域,它们在不同的信号转导分子中具有很高的同源性。
这些结构域的作用是在细胞中介导信号介导分子的相互识别和连接,共同形成不同的信号转导途径(Signaltransductionpathway),如电脑的接口一样把不同的设备连接起来,形成信号转导网络(Signaltransductionnetwork)。
与细胞信号分子识别有关的结构域主要有:
SH2结构域(SrcHomology2结构域):
约100个氨基酸组成,介导信号分子与含磷酸酪氨酸的蛋白分子结合。
SH3结构域(SrcHomology3结构域):
约50~100个氨基酸组成,介导信号分子与富含脯氨酸的蛋白分子结合。
PH结构域(PleckstrinHomology结构域):
约100~120个氨基酸组成,可以与膜上磷脂类分子PIP2、PIP3、IP3等结合,使含PH结构域蛋白由细胞质中转位到细胞膜上。
3、RAS信号途径
受体酪氨酸激酶(RPTK)结合信号分子,形成二聚体,并发生自磷酸化而活化,活化的RPTK激活RAS,由活化的RAS引起蛋白激酶的磷酸化级联反应(图8-27)。
Ras蛋白要释放GDP,结合GTP的才能激活,GDP的释放需要鸟苷酸交换因子(GEF,如Sos)参与;Sos有SH3结构域,但没有SH2结构域,因此不能直接和受体结合,需要接头蛋白(如Grb2)的连接,接头蛋白通过SH2与受体的磷酸酪氨酸残基结合,再通过SH3与Sos结合,Sos与膜上的Ras接触,从而活化Ras。
Ras本身的GTP酶活性不强,需要GTP酶活化蛋白(GAP)的参与,使Ras结合的GTP水解而失活,GAP具有SH2结构域可直接与活化的受体结合。
Ras蛋白与Raf的N端结构域结合并使其激活,Raf是丝氨酸/苏氨酸(Ser/Thr)蛋白激酶(又称MAPKKK)
活化的Raf结合并磷酸化另一种蛋白激酶MAPKK,使其活化。
MAPKK又使MAPK的苏氨酸和酪氨酸残基使之激活。
MAPK为有丝分裂原活化蛋白激酶(mitogen-activatedproteinkinase,MAPK),属丝氨酸/苏氨酸残激酶。
活化的MAPK进入细胞核,可使许多转录因子活化,如将Elk-1激活,促进c-fos,c-jun的表达。
RPTK-Ras信号通路可概括如下:
配体→RPTK→adaptor→GEF→Ras→Raf(MAPKKK)→MAPKK
→MAPK→进入细胞核→转录因子→基因表达。
图8-27RAS信号途径
4.胰岛素受体介导的信号转导
胰岛素受体也属于受体酪氨酸激酶,是由α和β两种组成四聚体型受体,其中β亚基具有激酶活性,可将胰岛素受体底物(insulinreceptorsubstrates,IRSs)磷酸化(图8-28),IRS作为多种蛋白的停泊点,可以结合或激活具有SH2结构域的蛋白。
如磷脂酰肌醇3-激酶(phosphotidylinositol3-kinase,PI3K)。
图8-28IRS
PI3K催化PI形成PI(3,4)P2和PI(3,4,5)P3,这两种磷酸肌醇可作为胞内信号蛋白(含PH结构域)的停泊位点,激活这些蛋白。
其信号通路主要有:
①通过激活BTK(Bruton'styrosinekinase),再激活磷脂酶Cγ(PLCγ),引起磷脂酰肌醇途径。
②激活磷脂酰肌醇依赖性激酶PKD1(phosphoinositoldependentkinase),PKD1激活转位到膜上的蛋白激酶B(PKB,一种丝氨酸/苏氨酸激酶,如Akt)。
激活的PKB返回细胞质,将细胞调亡相关的BAD蛋白磷酸化,抑制BAD的活性,从而使细胞存活(图8-29)。
图8-29蛋白激酶B的活化
(二)受体丝氨酸/苏氨酸激酶
受体丝氨酸/苏氨酸激酶(receptorserine/threoninekinases)是单次跨膜蛋白受体,在胞内区具有丝氨酸/苏氨酸蛋白激酶活性,该受体以异二聚体行使功能。
主要配体是转化生长因子-βs。
(transforminggrowthfactor-βs,TGF-βs。
)家族成员,包括TGF-β1~TGF-β5,这些成员具有类似结构与功能,对细胞具有多方面的效应。
依细胞类型不同,可能抑制细胞增殖、刺激胞外基质合成、刺激骨骼的形成、通过趋化性吸引细胞和作为胚胎发育过程中的诱导信号等。
(三)受体酪氨酸磷酯酶
受体酪氨酸磷酯酶(receptortyrosinephosphatases)为单次跨膜蛋白受体,受体胞内区具有蛋白酪氨酸磷酯酶的活性,胞外配体与受体结合激发该酶活性,使特异的胞内信号蛋白的磷酸酪氨酸残基去磷酸化,其作用是控制磷酸酪氨酸残基的寿命,使静止细胞具有较低的磷酸酪氨酸残基的水平。
它的作用不是简单的与RPTK相反,可能与酪氨酸激酶一起协同工作,如参与细胞周期调控。
白细胞表面的CD45属这类受体,对具体配体的尚不了解。
和酪氨酸激酶一样存在胞质酪氨酸磷酯酶。
胞质酪氨酸磷酯酶胞内段具有两个SH结构域,称作SHP1和SHP2,通过SHP1可以与细胞因子受体连接,使Jak去磷酸化,SHP1结构域缺陷的老鼠,各类血细胞异常。
说明胞质酪氨酸磷酯酶与血细胞分化有关。
(四)受体鸟苷酸环化酶
受体鸟苷酸环化酶(receptorguanylatecyclase)是单次跨膜蛋白受体,胞外段是配体结合部位,胞内段为鸟苷酸环化酶催化结构域。
受体的配体心房排钠肽(atrialnatriureticpeptides,ANPs)和脑排钠肽(brainnatriureticpeptides,BNPs)。
当血压升高时,心房肌细胞分泌ANPs,促进肾细胞排水、排钠,同时导致血管平滑肌细胞松弛,结果使血压下降。
介导ANP反应的受体分布在肾和血管平滑肌细胞表面。
ANPs与受体结合直接激活胞内段鸟苷酸环化酶的活性,使GTP转化为cGMP,cGMP作为第二信使结合并激活依赖cGMP的蛋白激酶G(PKG),导致靶蛋白的丝氨酸/苏氨酸残基磷酸化而活化。
除了与质膜结合的鸟苷酸环化酶外,在细胞质基质中还存在可溶性的鸟苷酸环化酶,它们是NO作用的靶酶,催化产生cGMP。
(五)细胞因子受体超家族
属于酪氨酸激酶连接的受体(tyrosinekinaseassociatedreceptor)。
细胞因子(cytokine),如:
白介素(IL)、干扰素(IFN)、集落刺激因子(CSF)、生长激素(GH)等,在造血细胞和免疫细胞通讯上起作用,这类细胞因子的受体为单次跨膜蛋白,本身不具有酶活性,但与配体结合后发生二聚化而激活,罗织或连接胞内酪氨酸蛋白激酶(如,JAK),其信号途径为JAK-STAT或RAS途径。
JAK(justanotherkinase或januskinase)是一类非受体酪氨酸激酶家族,已发现四个成员,即JAK1、JAK2、JAK3和TYK1,其结构不含SH2、SH3,C段具有两个相连的激酶区。
JAK的底物为STAT,即信号转导子和转录激活子(signaltransducerandactivatoroftranscription,STAT),具有SH2和SH3两类结构域。
STAT被JAK磷酸化后发生二聚化,然后穿过核膜进入核内调节相关基因的表达,这条信号通路称为JAK-STAT途径(图8-30),可概括如下:
1、配体与受体结合导致受体二聚化;
2、二聚化受体激活JAK;
3、JAK将STAT磷酸化;
4、STAT形成二聚体,暴露出入核信号;
5、STAT进入核内,调节基因表达。
图8-30JAK-STAT信号途径