医疗器械工作程序文件.docx
《医疗器械工作程序文件.docx》由会员分享,可在线阅读,更多相关《医疗器械工作程序文件.docx(42页珍藏版)》请在冰豆网上搜索。
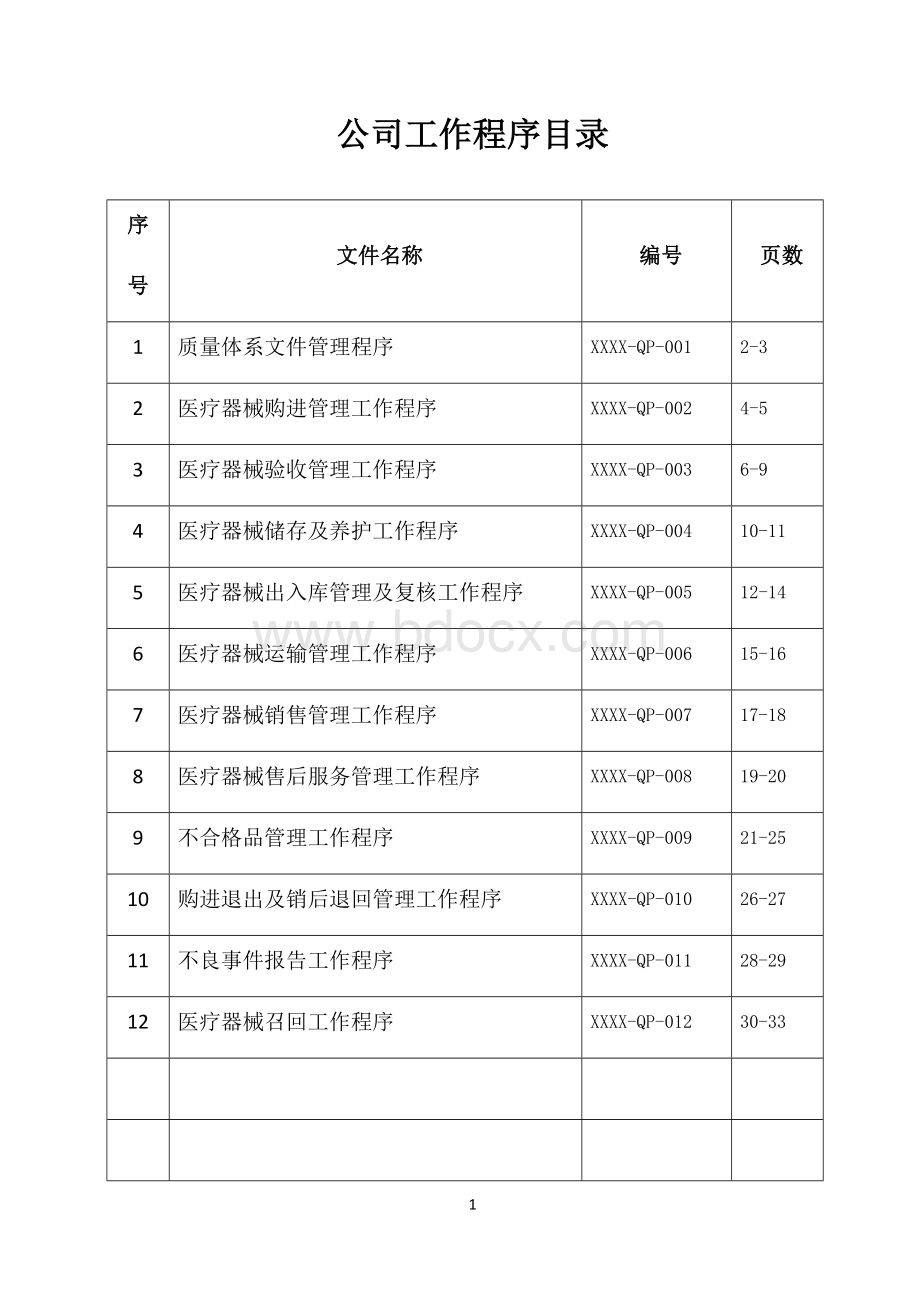
公司工作程序目录
序
号
文件名称
编号
页数
1
质量体系文件管理程序
XXXX-QP-001
2-3
2
医疗器械购进管理工作程序
XXXX-QP-002
4-5
3
医疗器械验收管理工作程序
XXXX-QP-003
6-9
4
医疗器械储存及养护工作程序
XXXX-QP-004
10-11
5
医疗器械出入库管理及复核工作程序
XXXX-QP-005
12-14
6
医疗器械运输管理工作程序
XXXX-QP-006
15-16
7
医疗器械销售管理工作程序
XXXX-QP-007
17-18
8
医疗器械售后服务管理工作程序
XXXX-QP-008
19-20
9
不合格品管理工作程序
XXXX-QP-009
21-25
10
购进退出及销后退回管理工作程序
XXXX-QP-010
26-27
11
不良事件报告工作程序
XXXX-QP-011
28-29
12
医疗器械召回工作程序
XXXX-QP-012
30-33
42
文件
文件名称:
质量体系文件管理程序
编号:
XXXX-QP-001
起草部门:
质量管理部
起草人:
XXXX
审阅人:
XXXX
批准人:
XXXX
起草日期:
2015-09-12
批准日期:
2015-09-12
执行日期:
2015-09-12
版本号:
第一版
变更记录:
变更原因:
1、目的:
建立医疗器械文件管理程序,确保从合法的企业购进合法和质量
可靠的医疗器械。
2、依据:
《医疗器械监督管理条例》《医疗器械经营企业检查验收标准通知》。
3、适用范围:
本企业质量文件的管理。
4、职责:
质量管理部人员对本程序的实施负责。
5、程序:
5-1、本制度管理内容为:
企业全部经营活动中的各种资料、文件、数据、报表、纪录等,其中包括质量监督、质量信息、意见反馈、产品质量、工作质量、规章制度、技术资料、培训纪录、人员档案等。
5-2、质管、销售二部门系企业信息中心,负担着企业所需要的各种信息反馈等情况的收集、汇总、分析、传递,等具体工作。
5-3、企业各部门要按时填报经营活动中的信息统计报表,于次月初3日内将上月资料交质管部门汇总。
5-4、各部门负责人主抓本科室的文件、资料、质量信息的收集、登记、整理、汇总工作。
5-5、全部文件、资料、纪录和信函,凭证等,一律实行借阅登记制度,规定任何人借阅资料必须签字借阅,归还核销,不得无故积压和丢失。
5—6、文件资料应与财务凭证一样注意妥善保管,一般保存10年,需销毁时,应由企业经理批准,并详细纪录文件编号、名称、发文时间等数据。
文件
文件名称:
医疗器械购进管理工作程序
编号:
XXXX-QP-002
起草部门:
质量管理部
起草人:
XXXX
审阅人:
XXXX
批准人:
XXXX
起草日期:
2015-09-12
批准日期:
2015-09-12
执行日期:
2015-09-12
版本号:
第一版
变更记录:
变更原因:
1、目的:
建立医疗器械购进程序,确保从合法的企业购进合法和质量可靠的产品。
2、依据:
《医疗器械监督管理条例》《医疗器械经营企业检查验收标准通知》。
3、职责:
医疗器械购进人员对本程序的实施负责。
4、程序:
5.1确定供货单位合法资格和质量信誉。
5.1.1对供货单位合法资格的确定。
5.1.1.1医疗器械购进人员向供货单位销售人员索取供货单位的《器械生产(经营)许可证》和《营业执照》的复印件。
5.1.1.2医疗器械购进人员对所索取的上述“证照”复印件进行以下审核。
5.1.1.2.1“证照”复印件是否加盖了供货单位的原印章。
5.1.1.2.2“证照”是否在其注明的有效期之内。
5.1.1.2.3“证”与“照”的相关内容是否一致。
5.1.1.2.4“证照”上的注册地址是否与供货单位实际的生产或经营地址相同。
5.1.1.2.5必要时,可索取“证照”的原件进行查验。
5.1.2对供货单位质量信誉的确定。
5.1.3验明首营企业医疗器械销售人员的合法身份,并索取下列资料。
5.1.3.1加盖有企业原印章盒有企业法人代表印章或签字的企业委托授权书原件,委托书应明确授权范围和委托期限。
5.1.3.2首营企业医疗器械销售人员的身份复印件(验证原件后复印)。
5.1.4填写“首营企业审批表”,附上述有关资料,并提出是否进行实地考察的意见,经本部门主管加具意见后,依次送质量管理部和企业主管负责人审批。
5.2质量管理部审查程序:
5.2.1资料审查:
5.2.1.1审查资料是否完备
5.2.1.2审查资料的合法性和有效性,即审查资料是否加盖有规定的原印章或签章、所购进医疗器械是否超出供货单位的生产或经营范围、有限期的证件是否在有效期内。
文件
文件名称:
医疗器械验收管理工作程序
编号:
XXXX-QP-003
起草部门:
质量管理部
起草人:
XXXX
审阅人:
XXXX
批准人:
XXXX
起草日期:
2015-09-12
批准日期:
2015-09-12
执行日期:
2015-09-12
版本号:
第一版
变更记录:
变更原因:
1、目的:
建立医疗器械验收工作程序,规范医疗器械验收工作,确保验收
医疗器械符合法定标准和有关规定的要求。
2、根据:
《医疗器械监督管理条例》《医疗器械经营企业检查验收标准通知》。
3、依据范围:
适用于企业购进和销后退回医疗器械的验收工作。
4、职责:
医疗器械质量验收员、保管员对本程序的实施负责。
5、程序:
5.1保管员收货:
5.1.1保管员依据采购员开出的医疗器械进库通知单和供货单位随货同行单对照实物进行核对后收货,并在供货单位收货单上签章。
所收货的医疗器械为进口产品时,应同时对照实物收取加盖有供货单位质量管理部门原印章的该批号器械的《进口医疗器械和检验报告书》和《进口医疗器械注册证》(或《生物制品进口批件》)的复印件。
5.1.2保管员根据销售部门所开具的医疗器械退回通知单对照实物对销后退回医疗器械进行核对后收货,并在退回单位的退回单上签章。
5.1.3医疗器械保管员应将所购进的医疗器械放置于待验区;将销后退回医疗器械放置于退货区,做好退回记录并通知验收员到场进行验收。
5.2医疗器械验收:
5.2.1验收的内容:
医疗器械质量验收包括医疗器械外观性状的检查和医疗器械包装、标签、说明书及标识的检查。
5.2.2验收的标准:
5.2.2.1验收员依据本公司《医疗器械质量验收制度》,抽取规定数量的医疗器械进行外观性状的检查和包装、标签、说明书及标识的检查。
5.2.2.2验收员依据医疗器械购进合同所规定的质量条款进行逐批验收。
5.2.3验收的场所、步骤与方法:
验收员在待验区内首先检查医疗器械外包装是否符合《医疗器械质量验收细则》的规定:
符合规定的,予以激励并开箱检查医疗器械内包装和说明书是否符合《医疗器械质量验收制度》的规定;符合规定的,予以激励并根据来货数量按抽取规定数量的样品刀验收养护室进行外观性状的检查并做好检查激励:
符合《医疗器械质量验收制度》的全部要求后,对已开箱医疗器械进行复原,并用本公司封签封箱;填写验收质量状况和验收结论和签章,将验收记录交验收员归档;同时通知保管员办理医疗器械入库手续。
凡发现有不符合规定情况时,应停止下一步骤的验收工作并填写商品拒收单交质量管理员处理。
5.2.4医疗器械包装,标识主要检查内容;
5.2.4.1医疗器械的每一件包装中,应有产品合格证。
5.2.4.2医疗器械包装的标签或说明书上,应有医疗器械的通用名称、成份、规格、生产企业、批准文号、生产日期、有限期、用法及注意事项以及贮藏条件。
5.2.4.3验收首营品种应有生产企业出具的该批号的医疗器械检验合格报告书。
5.2.4.4特殊管理医疗器械包装的标签或说明书上应有规定的标识和警示说明。
5.2.4.5进口医疗器械,其包装的标签应以中文注明医疗器械的名称、主要成份以及注册证号,并有中文说明书。
5.2.5抽样的原则与方法:
5.2.5.1验收抽样的原则:
验收所抽取的样品必须具有代表性
5.2.5.2验收抽样的方法:
5.2.5.2.1一般医疗器械的抽样方法:
参考药品的验收方法。
每批医疗器械在50件以下(含50件)抽样2件,50件以上每增加50件多抽取1件,不足50件以50件计;在每件包装中从上、中、下不同部位抽取3个以上小包装进行检查。
凡需进行医疗器械外观性状检查时,检查样品的具体数量应符合关于检验抽样数量的要求。
5.2.6验收的时限:
所购医疗器械和销后退回医疗器械均应 在一个工作日内验收完毕。
5.2.7特殊管理医疗器械的验收:
对特殊管理医疗器械必须由两位验收员在场进行验收;并验收至每一最小包装。
5.2.8验收记录:
5.2.8.1医疗器械验收记录的内容:
验收记录的内容应包括医疗器械通用名称、剂型、规格、批号、有效期、批准文号、生产企业、生产日期、供货单位、供货数量、到货日期、质量状况、验收结论和验收员签章。
5.2.8.2医疗器械验收记录的保存:
医疗器械验收记录由专职验收员按日或月顺序装订,保存至超过医疗器械有效期1年,但不得少于3年。
5.3医疗器械入库:
5.3.1验收完毕后,验收员在医疗器械进仓通知单上注明医疗器械质量状况、签章并交保管员;保管员根据验收合格结论和验收员的签章将医疗器械放置于相应的合格品库(区),并做好记录。
5.3.2保管员如发现医疗器械有货与单不符、包装不牢或破损、标志模糊等质量异常情况时,有权拒收并按规定上报质量管理员处理。
5.4有关问题的处理:
5.4.1验收员发现不合格医疗器械时,按《不合格医疗器械的确认和处理程序》报质量管理员处理。
5.4.2验收员发现本程序未明确的问题时,应立即报告质量管理员,由质量管理员联系采购员或销售员予以处理。
文件
文件名称:
医疗器械储存及养护工作程序
编号:
XXXX-QP-004
起草部门:
质量管理部
起草人:
XXXX
审阅人:
XXXX
批准人:
XXXX
起草日期:
2015-09-12
批准日期:
2015-09-12
执行日期:
2015-09-12
版本号:
第一版
变更记录:
变更原因:
1、目的:
建立医疗器械入库储存工作程序,明确医疗器械入库及储存的工
作要求,以保证医疗器械入库及储存工作的规范性。
2、依据:
《医疗器械监督管理条例》《医疗器械经营企业检查验收标准通知》。
3、范围:
本程序规定了医疗器械的入库手续、搬运及堆垛注意事项,明确
了医疗器械合理储存要求、医疗器械质量异常情况的处理方法。
适用于医疗器械入库储存的管理工作。
4、职责:
企业医疗器械保管员对本程序的实施负责。
5、程序:
5.1医疗器械入库:
5.1.1保管员依据该批号医疗器械的进仓通知单上的验收结论和验收员的签章办理入库,并在进仓通知单上签章确认。
5.1.1.1将验收合格的医疗器械从待验库(区)移至相应的合格品库(区),并做好相应记录。
5.1.1.2将已验收并经质量管理员确认的不合格医疗器械从待验库(区)移至相应的不合格品库(区),做好相应记录。
5.1.2保管员如发现医疗器械有货与单不符、包装不牢或破损、标志模糊等质量异常情