高考化学试题分析解析.docx
《高考化学试题分析解析.docx》由会员分享,可在线阅读,更多相关《高考化学试题分析解析.docx(38页珍藏版)》请在冰豆网上搜索。
高考化学试题分析解析
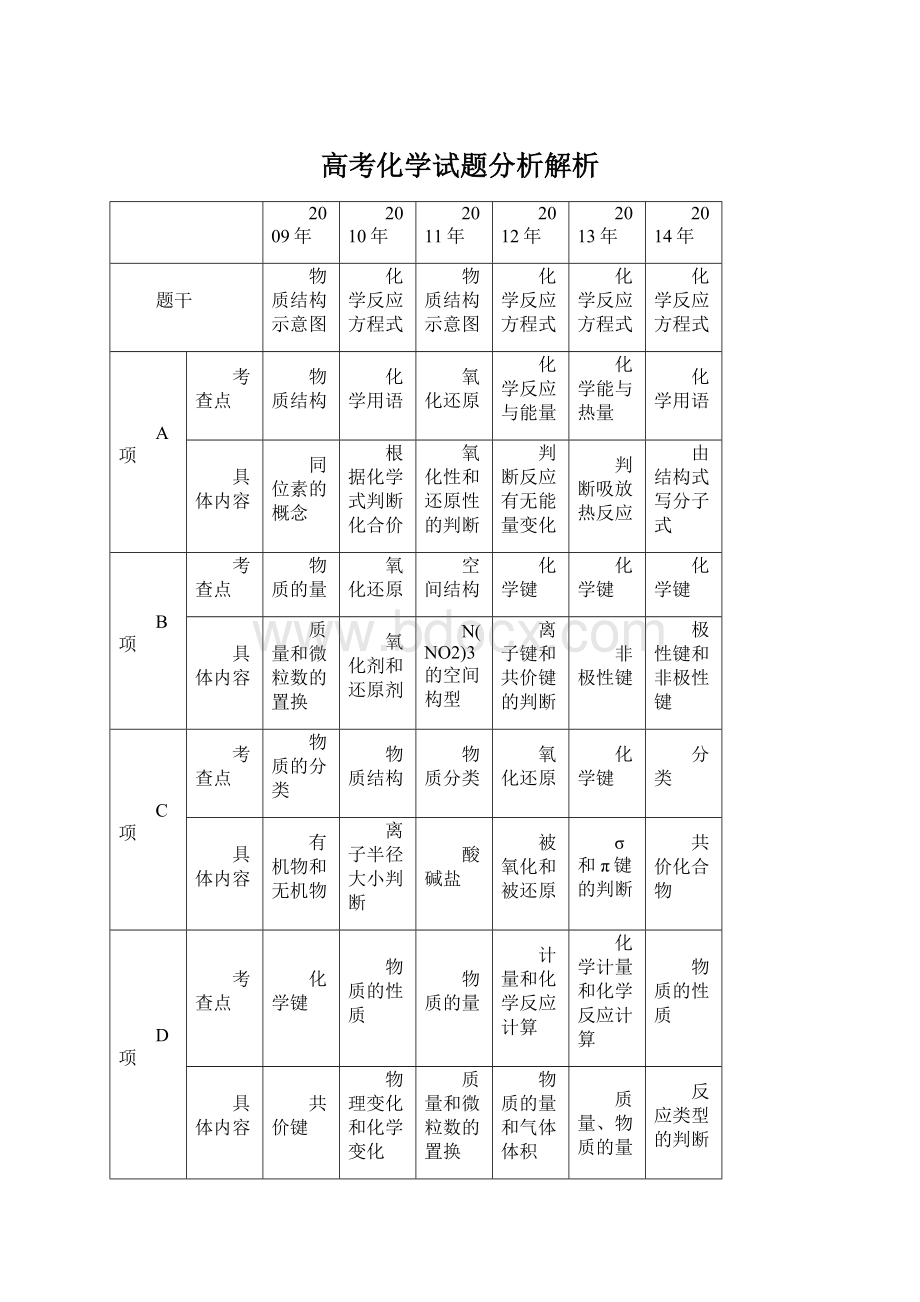
2009年
2010年
2011年
2012年
2013年
2014年
题干
物质结构示意图
化学反应方程式
物质结构示意图
化学反应方程式
化学反应方程式
化学反应方程式
A项
考查点
物质结构
化学用语
氧化还原
化学反应与能量
化学能与热量
化学用语
具体内容
同位素的概念
根据化学式判断化合价
氧化性和还原性的判断
判断反应有无能量变化
判断吸放热反应
由结构式写分子式
B项
考查点
物质的量
氧化还原
空间结构
化学键
化学键
化学键
具体内容
质量和微粒数的置换
氧化剂和还原剂
N(NO2)3的空间构型
离子键和共价键的判断
非极性键
极性键和非极性键
C项
考查点
物质的分类
物质结构
物质分类
氧化还原
化学键
分类
具体内容
有机物和无机物
离子半径大小判断
酸碱盐
被氧化和被还原
σ和π键的判断
共价化合物
D项
考查点
化学键
物质的性质
物质的量
计量和化学反应计算
化学计量和化学反应计算
物质的性质
具体内容
共价键
物理变化和化学变化
质量和微粒数的置换
物质的量和气体体积
质量、物质的量和气体体积
反应类型的判断
第一题
一、综合分析
1.知识考查的静态和动态分析
从题型结构来看,主要是给出新情境,然后由新情况结合出物质组成的式子(以结构式为主)和物质变化的式子(化学方程式),然后以该结构式或化学方程式中某物质为出发点,考查基本概念和基本理论方面的知识。
从考查点来看,本题的考查点主要涉及到高考大纲中化学基本概念和基本理论的部分内容,主要包括四方面知识:
一是物质的组成、性质和分类;二是化学用语和化学计量;三是物质结构;四是化学反应与能量。
具体分析如下:
(1)物质的组成、性质和分类方面
①物质的分类:
2009年7题C项对有机物和无机物的判断;2011年7题C项对盐的判断;2014年7题C项对共价化合物的判断。
②物质的性质:
2010年7题D项对物理变化和化学变化的判断,2014年D项对中和反应的判断。
(2)化学用语及常用计量方面
①化合价:
根据分子式判断元素化合价,如2010年7题A项对N元素化合价的判断。
②分子式:
根据结构式写出分子式,如2014年7题A项由三聚氰胺的结构简式写出分子式。
③利用化学方程式进行计算:
根据化学方程式进行简单的计算,如2012年7题D项和2013年7题D项,均是根据一种物质的量判断另一种物质的量。
④物质的量与微粒数目的转换:
质量、气体体积转换为物质的量,物质的量转换为微粒数,如2009年7题B项和2011年D项均是物质质量和微粒数的转换;2012年7题D项是物质的量与气体体积的转换;2014年7题D项是质量与物质的量,物质的量与气体体积的转换。
(3)物质结构方面
①概念:
2009年7题A项判断两种物质是否为同位素。
②微粒半径:
2010年C项判断两种离子半径大小。
③化学键:
2009年D项判断是否是共价键;2012年7题B项判断是否是离子键和共价键;2013年7题B项判断是否是非极性键;2014年7题B项判断极性键和非极性键。
④空间构型:
2011年7题B项判断氮原子是否共平面。
(4)化学反应与能量
①氧化还原反应:
一是氧化还原反应基本概念的判断,如2010年7题B项判断是否是氧化剂和还原剂;2011年7题A项判断物质是否既有氧化性又有还原性;2012年7题C项判断是否被氧化;
②化学反应中能量变化:
2012年7题A项判断反应是否有能量变化;2013年7题A项判断是否是吸热反应。
由以上分析可以看出,本题考查点主要集中在这四方面内容上,属于基础知识的判断题。
2.错误及错因剖析
对这些基本概念和基本理念理解的不到位,掌握不熟练,不能很好地把握这些概念的外延和内涵,加上不能灵活应用,所以在将这些概念和具体物质及化学反应联系起来时,无法进行准确判断。
二、预测
1.题干
会延续以往的风格,以新情境、新结构式(简式)和新的化学方程式的形式出现,以新的化学方程式为主,然后考查其中物质的某方面知识。
2.考查点
①物质的组成、性质和分类:
除以前出现过的考点外,还应着重关注混合物和纯净物,氧化物等知识点。
②化学用语及常用计量:
以化学计量为主,涉及到不同微粒之间的转换,除注意以往出现过的质量与气体,还要关注物质的量浓度与物质与量的转换,另外可能会出现由化合价书写化学式、原子结构示意图等知识点的内容。
③物质结构:
除分子结构和化学键外,可能会考查原子序数、核电荷数、质子数、中子数及核外电子数的关系,另外,有可能会出现《物质结构与性质》模块的知识点(类似于2013年),但应该比较简单。
④化学反应与能量:
以氧化还原反应知识为主,可能在判断氧化还原剂、被氧化还原的基础上考查氧化还原产物的判断;可能会涉及到能量转化的原因分析等,但一般不会出现热化学以及电化学方面的知识点,因为这些知识点将在后面的题目出现。
3.关注点
(1)化学计量中从阿伏加德罗常数角度进行考查。
(2)高考要求中化学基本概念和基本理念共有六部分内容,除上述四部分外,还有溶液、化学反应速率和化学平衡两部分,而以往每年本题中均没有涉及到这两部分知识,化学反应速率和化学平衡在相应题目会进行考查,所以要适当关注溶液的相关知识,比如溶解度、质量分数以及分散系等。
第2题
2009年
2010年
2011年
2012年
2013年
2014年
题干
大量共存的离子或分子
在PH=1,大量共存的离子或分子
指定溶液中大量共存
通入CO2后,大量共存离子或分子
在指定分散系中大量共存的离子或分子
有关硫酸铁溶液的叙述
不同共存的原因
A项
生成弱电解质:
H+和HCO3-
生成弱电解质:
H+和ClO-
发生氧化还原反应:
SO32―和Cl2
能共存
能共存
络合:
苯酚和Fe3+
B项
生成沉淀:
Al3+和NH3·H2O
能共存
能共存
生成沉淀:
CO2和SiO32-
发生氧化还原反应:
NO和O2
电荷不守恒
C项
氧化还原反应:
SO32―和Cl2
发生氧化还原反应:
Cr2O72―和CH3CHO
生成沉淀:
S2-和Cu2+
发生氧化还原反应:
Fe2+和Cl2
胶体溶解:
Fe(OH)3和H+
不符合物质组成
D项
能共存
生成沉淀:
H+和SiO32-
生成沉淀:
Al3+和OH-
络合:
Ag+和NH3·H2O
发生氧化还原反应:
MnO4-和葡萄糖
正确
一、综合分析:
1.知识考查的静态和动态分析
(1)每年的设问不完全相同:
2009年为最简形式,只有四组离子;2010年题干给出了PH=1的条件,相当于多了一种氢离子;2011年四个选项为四种指定的溶液,相比以前较为复杂;2012年类似于2011年,是向溶液中通入二氧化碳,相当于多了一种分子;2013年类似于2011年,四个选项为四种指定的环境;2014年和前几年又不完全相同,四个选项分别为1个离子共存,2个离子方程式正误判断,1个定量计算。
(2)除2014年外,其它各年均为判断离子是否共存,2009年、2010年不能共存有三种情况:
生成沉淀,发生氧化还原反应、生成弱电解质;2011年不能共存有两种情况:
生成沉淀(两个选项)、发生氧化还原反应;2012年不能共存有三种情况:
生成沉淀、发生氧化还原反应、发生络合反应;2013年不能共存有两种情况:
发生氧化还原反应(两个选项)、胶体溶解;2014年不能共存的原因是发生络合反应。
由此看来,从2009年-2013年的4年,离子不能共存的原因中,发生氧化还原反应的有4年,生成沉淀的有3年、生成弱电解质的有2年,生成络合物的有1年,另1种为胶体的溶解。
(3)发生氧化还原反应不能共存的分析:
出现过的氧化性微粒分别有Cl2(三次)、Cr2O72―、O2、MnO4-;出现过的还原性微粒分别有SO32―(两次)、CH3CHO、Fe2+、葡萄糖、NO。
(4)生成沉淀不能共存的分析:
分别出现过Al3+和NH3·H2O、H+和SiO32-、S2-和Cu2+、Al3+和OH-、CO2和SiO32-,其中Al3+出现过两次,SiO32-出现过两次。
(5)生成弱电解不能共存的分析:
分别出现过H+和HCO3-、H+和ClO-两种情况。
(6)生成络合物不能共存的分析:
包括2014年共出现过两次,分别为Ag+和NH3·H2O、苯酚和Fe3+。
(7)离子的分析:
离子有常见的离子,比如H+、Na+、K+、Cl―、SO42―、NO3―等,也有不常见的离子,比如Cr2O72―、C6H5O―等。
(8)分子的分析:
在此类型题中涉及到的分子是安徽高考的特色,除2013年9题A项中的NH3·H2O外,其他各年只要涉及到分子的选项,均因所给分子参与反应而不能大量共存,使安徽高考的此特色更为明显。
2.错误及错因分析
(1)对基本知识点掌握不牢,主要体现在物质的溶解性、氧化还原反应等方面的知识等。
(2)因为本题所给的离子种类较多,容易造成视角和心理上的混乱,加上部分考生做题时没有“划拉”重点离子的习惯而造成失误。
(3)有时只关注选项中的微粒,而忽视了题干所给的条件,特别是一些隐含条件等。
二、预测
1.命题思路、基本题型结构一般还会延续以往思路,稳中有变,但考查微粒性质的能力要求不变。
2.离子不能共存的原因一般还是因为生成沉淀、生成弱电解质、发生氧化还原反应以及相络合反应等情况。
3.常见微粒还会继续出现,这些微粒一般还会包括离子和分子,以离子为主。
4.还可能会出现离子共存的判断和离子方程式正误的判断组合的题目。
5.关注点
(1)带有一定限定条件离子共存的判断。
除可能会出现溶液的酸碱性外,还可能会出现如无色等情况。
(2)同一主题下,不同选项的组合。
有可能还会出现2014年的题型结构,如四个选项分别为不同角度的考查,这样会加大考查力度和难度。
(3)关注部分离子。
除上述强调的离子,还要关注I―和S2-的还原性,HClO、ClO-、NO3-(H+)等的氧化性,SCN-离子的络合性。
(4)关注因相互促进水解而不能大量共存的情况,因为这种情况在安徽的高考中还没有出现过,如Al3+和CO32―等。
钡离子、偏铝酸根离子等,因为硫离子、亚硫酸根离子这两种离子既有还原性,又可以和氢离子生成弱电解质,还可以和大部分阳离子生成沉淀,同时又能和铝离子等发生相互促进水解的作用。
钡离子可以和硫酸根离子和碳酸根离子等形成沉淀,而偏铝酸根离子可以和氢离子反应以及能和水解呈酸性的离子相互促进水解程度,而醋酸根离子能和氢离子生成弱电解质等。
第3题元素化合物基本性质的考查
2009年
2010年
2011年
2012年
2013年
2014年
钠
知识点
过氧化钠、氧化钠与水的反应
过氧化钠与二氧化碳的反应
考查点
生成氢氧化钠量的关系;消耗水的量
过氧化钠失电子的数目
铝
知识点
铝离子与氨水的反应
铝与稀硝酸反应
氢氧化铝与氢氧化钠反应
铝与浓、稀硝酸反应
考查点
是否能大量共存
是否钝化,与浓硝酸的区别
氢氧化钠和氢氧化铝量的关系图像
铝在浓硝酸中钝化
铜
知识点
铜与浓硫酸反应
硫化亚铜与氧气反应
铜与稀硝酸反应
考查点
反应方程式的书写
化学方程式的书写
生成产物的判断
铁
知识点
亚铁离子的还原性
铁与稀硝酸反应
过量铁与稀硝酸的反应
亚铁离子的还原性
三价铁离子的性质
考查点
写出被重铬酸根离子氧化的方程式
生成物的判断
生成物的判断
和氯气是否可以大量共存
(1)络合反应;
(2)氧化碘离子的方程式正误的判断;(3)生成氢氧化铁沉淀方程式的书写;(4)与锌反应产物的判断和计算
卤素
知识点
氯气的氧化性
次氯酸根离子
氯气的氧化性;碘离子的还原性;次氧酸根离子
氯气的氧化性:
溴与碘氧化性的比较
浓盐酸;氯气的物理性质和化学性质;氯离子性质
碘离子的还原性;溴的溶解性
考查点
判断与亚硫酸根离子是否共存
判断与氢离子是否共存
(1)判断与亚硫酸是否共存;
(2)碘离子能被硝酸根离子氧化;(3)二氧化碳和次氯酸钠的反应
判断与亚铁离子是否共存;判断所仪器的准确性
(1)浓盐酸与二氧化锰反应制取氯气;
(2)氯气的收集和尾气处理;(3)氯离子的检验
(1)判断碘离子被氧化的离子方程式正误;
(2)溴在四氯化碳和水中溶解度比较
氧族元素
知识点
亚硫酸根离子的还原性;浓硫酸的氧化性
亚硫酸根离子的还原性;硫离子的性质
二氧化硫的还原性
二氧化硫的性质
考查点
(1)判断与氯气分子是否共存;
(2)铜与浓硫酸反应的方程式
(1)判断与氯气分子是否共存;
(2)判断硫离子和铜离子是否共存
写出二氧化硫被双氧水氧化的离子方程式
二氧化硫的制取、收集和吸收
氮族元素
知识点
氨水的性质
稀硝酸的性质
硝酸根离子的氧化性;稀硝酸的性质;氨水的性质
氨水的性质;氨气的制取和性质;稀硝酸的性质
一氧化氮的性质
稀硝酸的性质;浓硝酸的性质
考查点
氨水和铝离子是否共存
稀硝酸与铁反应生成物的判断
(1)硝酸根离子与碘离子在酸性条件下是否共存;
(2)铝与稀硝酸不钝化;(3)过量铁与稀硝酸反应的产物;(4)氨水遇感到石蕊试纸变色
(1)氨水与银离子在溶液中是否共存;
(2)制取氨气所需要的仪器;(3)制取氨气的药品、收集装置的判断;(4)铜与稀硝酸反应产物的判断
一氧化氮与氧气是否共存
(1)稀硝酸与锌反应生成产物的判断;
(2)铝与浓硝酸的钝化
碳族元素
知识点
碳酸氢根离子的性质
硅酸根离子的性质
二氧化碳的性质;
二氧化碳和硅酸根离子的性质
硅的性质
考查点
碳酸氢根离子与氢离子是否共存
硅酸根离子与氢离子是否共存
二氧化碳和次氯酸钠的反应
二氧化碳与硅酸根离子的反应
硅与氢氟酸反应方程式的书写
一、综合分析
1.知识考查的静态和动态分析
(1)分值
每年涉及到元素及其化合物性质的考查基本能占到20分左右,这是一个不小的比例。
(2)涉及到的具体知识点
①钠及其化合物:
主要考查的是过氧化钠的性质,分别考查过与水的反应和与二氧化碳的反应。
②铝及其化合物:
考查过铝单质与稀、浓硝酸的反应(2次),铝离子与氨水的反应和氢氧化铝与氢氧化钠的反应。
③铜及其化合物:
考查过铜与浓硫酸、稀硝酸的反应,硫化亚铜与氧气的反应。
④铁及其化合物:
考查过铁与稀硝酸的反应(2次),亚铁离子的还原性(2次),三价铁离子的性质。
⑤卤素及其化合物:
考查过氯气的氧化性(3次),氯气的制备和收集,次氯酸根离子的性质(2次),碘离子的还原性(2次),溴的氧化性和物理性质等。
⑥氧族元素及其化合物:
考查过二氧化硫的性质(2次),亚硫酸根离子的还㥳性(2次),浓硫酸的性质,硫离子的性质。
⑦氮族元素及其化合物:
氨水的性质(2次),硝酸根离子的氧化性,稀硝酸和浓硝酸的性质(4次)和一氧化氮的性质。
涉及到稀浓硝酸性质的考查点均是两者的比较,如浓硝酸与铝钝化而稀硝酸不能;浓硝酸与金属反应生成二氧化氮而稀硝酸生成一氧化氮等。
⑧碳族元素及其化合物的性质:
考查过二氧化碳的性质(2次),碳酸氢根离子的性质,硅单质的性质,硅酸根离子的性质(2次)。
(3)考查的形式
①选择题中:
主要是利用性质判断微粒是否能大量共存,判断反应产物是否正确,判断性质的应用是否合理等。
②填空题中:
主要是化学方程式和离子方程式的书写。
(4)考查的侧重点
每年所考查的均为元素及其化合物的基本性质,属于基本性质的识记和应用,均属于比较基础层面的内容和要求。
(5)考查点的分配
整体来看,非金属元素比金属元素考查点要多,所以考查的机率也大。
①金属元素部分:
出现机率最多的是铁,只有2013年没有涉及到,2014年以一个完整的题目出现;其次是铝,比铁少一年;再者是铜,最后是钠。
②非金属元素部分:
出现机率最多的是卤素和氮族,每年都有考查;其次是碳族元素,再者是氧族元素。
2.错误及错因分析
(1)对元素及其化合物基础知识掌握不牢,历年考查的能力要求并不高,造成失分的原因主要是对物质性质没有很好地识记。
(2)受其他因素的干扰。
因为本部分知识分散到各个题目中,而题目的情境和其他条件分散了我们的注意力,同时也增大的难度,导致判断的失误。
(3)不能将元素及其化合物性质与基本概念和基本理念进行有机的联系,不能用相关理论来解析元素及其化合物的性质,这种“失联”的情况往往导致解题时的错误。
二、预测
(1)出现的形式基本不会发生变化,还是分散到各个题目中。
(2)考查侧重点基本不会发生变化,主要体现在具体物质的基本性质及应用方面。
(3)常考元素及其化合物还会出现,特别是卤素、氮族元素和铁元素及其化合物的题目还会出现。
(4)和其他要求结合的会更加紧密。
特别是和实验、方程式的书写和判断、离子共存的判断、规律的分析等方面的要求和题型相结合,体现出物质性质的应用。
(5)关注:
①关注2014年8题的形式,围绕一种物质从不同微粒、不同角度和侧面进行分析。
②关注利用理论来解释和分析物质的性质,即因果关系的判断。
③关注元素及其化合物知识在生活、生产、科技领域的应用等。
④关注涉及到元素及其化合物知识简单的定量计算。
⑤关注以分类思想和同族元素性质的递变规律分析未知元素及其化合物的性质。
⑥关注非常见元素及其化合物的性质,即上述这些元素之外的元素,如锰、铬、钛等。
第4题
2009年
2010年
2011年
2012年
2013年
2014年
题目背景
尾气净化
低温脱硝
电镀废液处理
烟气中硫的回收
MgO的制备
烟气脱硝
题干特征
新情境
新情境
新情境
新情境
新情境
新情境
热化学反应方程式
热化学反应方程式
热化学反应方程式
热化学反应方程式
热化学反应方程式
热化学反应方程式
有图像
无图像
有图像
无图像
有图像
有图像
反应环境
恒容密闭容器
恒容密闭容器
恒容密闭容器
恒容密闭容器
恒容密闭容器
反应体系物质状态
气态
气态
液态
气态+液态
气+固
气态
反应热
放热
放热
放热
放热
吸热
放热
图像特点
4个平衡移动的图像
无图像
3个图像+1个反应速率的图像
无图像
1个图像
1个能量图像+2个速率图像+1个平衡图像
已知纵横坐标含义
已知纵横坐标含义
未知纵横坐标含义
已知纵横坐标含义
改变条件,判断示意图的正误
改变条件,判断示意图的正误
根据图像作出判断
根据图像作出判断
条件改变
温度
升温
升温
升温
升温
升温
升温
浓度
增大反应物和生成物的物质的量
增大反应物浓度
增大生成物浓度和反应物浓度
增大反应物物质的量、生成物浓度、反应物固体质量
改变反应物和生成物浓度
压强
催化剂
使用催化剂
使用催化剂
使用催化剂
平衡移动结果的判断
物质的量
1个选项
1个选项(比值大小)
密度
1个选项
压强
1个选项
浓度
反应速率
1个选项
1个选项
1个选项
平衡常数
2个选项
1个选项
1个选项
1个选项
1个选项
1个选项
转化率
2个选项
2个选项
1个选项
1个选项
1个选项
1个选项
其他考查点
平衡状态的判断
能量图像的分析、反应速率的计算
一、综合分析:
1.知识考查的静态和动态分析
(1)题目特点:
题干主要分为四部分:
一是新情境,每年均给出了一定的新的情境,体现了在生产生活中研究化学的思想;二是热化学方程式,需要根据热化学方程式判断反应前后气体计量数的大小、吸放热(除2013年为吸热反应,其余每年均为放热反应;三是过渡语,基本都是“若在恒容的密闭容器中,反应达到平衡后”;四是选项。
(2)平衡体系中各种物质的状态:
每年也在不断地变化中,由纯气态→纯液态→气态+液态→气态+固态→气态的循环变化。
所以解题时要关注各物质的状态,防止受习惯思维的影响。
(3)反应环境:
除2011年在溶液中建立平衡体系外,只要涉及到气体的反应,均在恒容密闭容器中。
(4)图像的特点:
虽然图像经常有,但每年图像的形式也在不断变化中。
先是已知坐标轴含义的四个平衡移动的图像→无图像→3个平衡移动图像+1个反应速率图像→无图像→未知坐标轴含义的图像→1个能量图像+2个速率图像+1个平衡图像。
图像的种类逐渐呈现多样化的特点。
另外,前几年是改变条件,判断所给图像是否正确过渡到根据图像作出判断,相比较而言,难度逐渐加大,思维容量也逐渐加大。
(5)条件的改变:
本题主要是分析条件改变后各个量的变化情况。
其中升温出现的机率最大,其次是改变物质的量或浓度,再次是催化剂的使用。
从未出现过压强的变化,因为所用的容器均为恒容的情况。
(6)结果的判断:
出现机率最大的是平衡常数和转化率大小的判断,每年必考;其次是反应速率大小的判断;再次是物质的量大小的判断。
另外,还涉及到密度和压强,从未涉及到浓度。
还有一点变化,虽不明显,但也要引起我们的注意,即由定性分析到定量计算的转变。
(7)其他考点:
其他的考点出现的比较少,主要涉及到平衡状态的判断、能量图像的分析和反应速率的计算等。
2.错误及错因分析
(1)不用从所给热化学方程式中分析出正确的、有用的信息,比如该反应是吸热还是放热反应。
(2)受习惯思维的影响所造成的失误。
如当看到平衡向右移动,则反应物的转化率一定增大,生成物的浓度一定增大,平衡常数一定增大错误认识。
尤其是判断平衡常数大小时,和平衡移动无关,只与浓度有关。
(3)不能有效地从图像中提取有效的信息用于解题。
(4)受新情境的影响,受试题陌生度和题给不同形式信息的干扰,在一定程度上存在未答先怯的情况。
二、预测:
(1)题目特点依旧:
还会是新情境+热化学反应方程式+过渡语+选项的形式。
(2)图像稳中有变:
一般还会有图像,图像的类型也会多样化,可能涉及到能量、平衡、速率的图像,有可能出现一个图像中两个条件改变对结果变化的判断,有可能还会出现未知坐标轴含义的图像。
一般会延续前两年的根据图像进行分析判断的题型。
(3)所研究的对象一般还会以气态物质为主,注意固态和液态的情况。
(4)条件改变一般还会集中在温度、浓度和物质的量、催化剂的改变方面。
(5)结果的分析一般还会集中在平衡常数、转化率两方面,兼顾反应速率、浓度、密度等情况。
(6)关注
①关注由定性分析到定量过渡,注意涉及到反应速率、转化率、浓度变化等的简单计算。
②可能会涉及到“恒压”情况下的分析和判断。
③关注平衡状态判断的标准。
第5题
2009年
2010年
2011年
2012年
2013年
2014年
研究对象
弱酸和强碱