高考化学易错题精选化学反应的速率与限度练习题含答案解析.docx
《高考化学易错题精选化学反应的速率与限度练习题含答案解析.docx》由会员分享,可在线阅读,更多相关《高考化学易错题精选化学反应的速率与限度练习题含答案解析.docx(38页珍藏版)》请在冰豆网上搜索。
高考化学易错题精选化学反应的速率与限度练习题含答案解析
高考化学易错题精选-化学反应的速率与限度练习题含答案解析
一、化学反应的速率与限度练习题(含详细答案解析)
1.超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。
科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式:
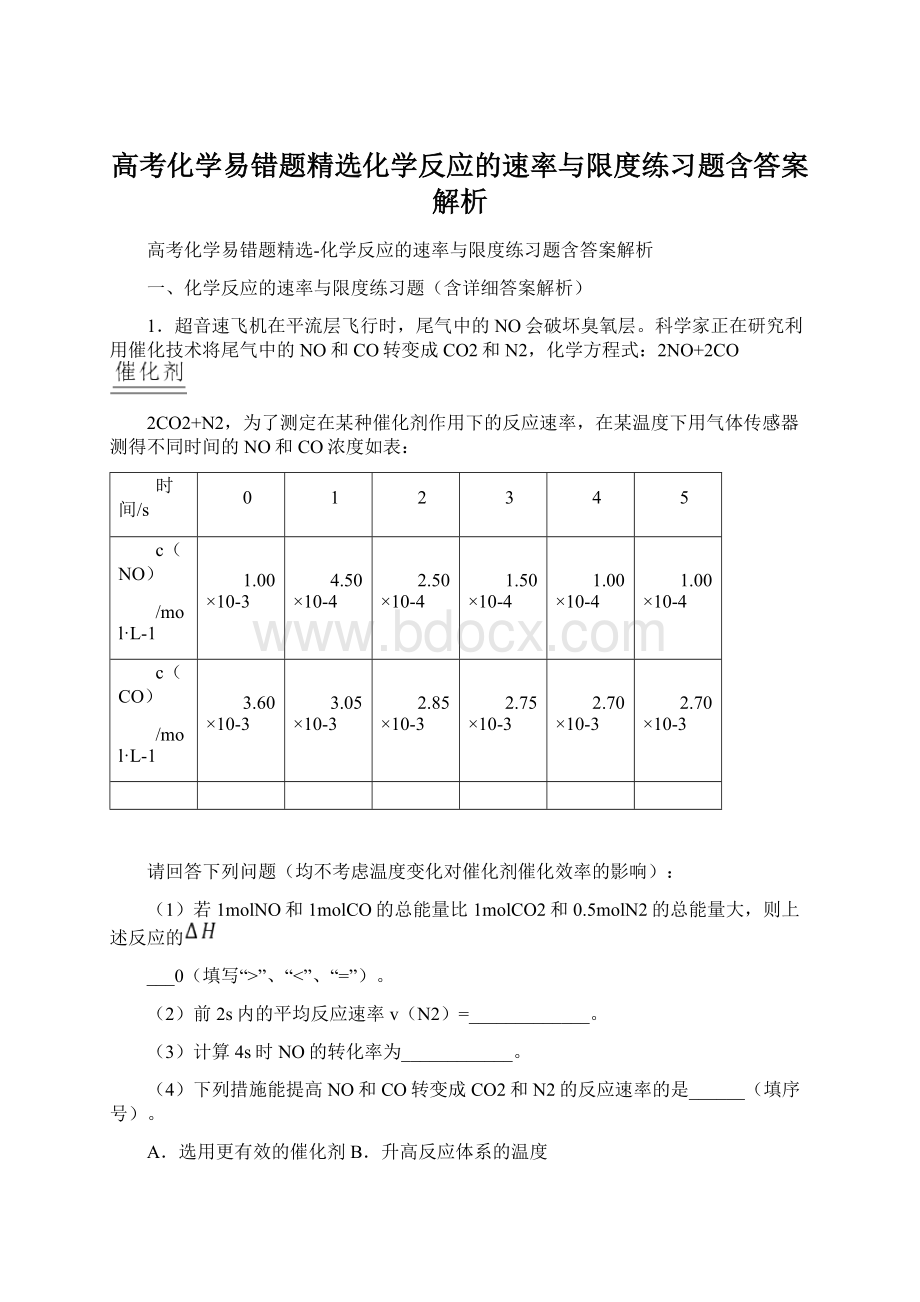
2NO+2CO
2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间/s
0
1
2
3
4
5
c(NO)
/mol·L-1
1.00×10-3
4.50×10-4
2.50×10-4
1.50×10-4
1.00×10-4
1.00×10-4
c(CO)
/mol·L-1
3.60×10-3
3.05×10-3
2.85×10-3
2.75×10-3
2.70×10-3
2.70×10-3
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)若1molNO和1molCO的总能量比1molCO2和0.5molN2的总能量大,则上述反应的
___0(填写“>”、“<”、“=”)。
(2)前2s内的平均反应速率v(N2)=_____________。
(3)计算4s时NO的转化率为____________。
(4)下列措施能提高NO和CO转变成CO2和N2的反应速率的是______(填序号)。
A.选用更有效的催化剂B.升高反应体系的温度
C.降低反应体系的温度D.缩小容器的体积
(5)由上表数据可知,该反应在第______s达到化学平衡状态。
假如上述反应在密闭恒容容器中进行,判断该反应是否达到平衡的依据为________(填序号)。
A.压强不随时间改变B.气体的密度不随时间改变
C.c(NO)不随时间改变D.单位时间里消耗NO和CO的物质的量相等
(6)研究表明:
在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。
为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验编号
T/℃
NO初始浓度/mol·L-1
CO初始浓度/mol·L-1
催化剂的比表面积/m2·g-1
Ⅰ
280
1.20×10-3
82
Ⅱ
5.80×10-3
124
Ⅲ
350
124
①请在上表格中填入剩余的实验条件数据_____、_____、______、______、______。
②请在给出的坐标图中,画出上表中的Ⅰ、Ⅱ两个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号________。
【答案】<1.875
10-4mol·L-1·s-190%ABD4AC5.80
10-32801.20
10-31.20
10-35.80
10-3
【解析】
【分析】
反应热的正负可根据反应物和生成物的总能量的大小比较;能提高反应速率的因素主要有增大浓度、使用催化剂、升高温度、增大表面积、构成原电池等,压强能否改变反应速率要看是否改变了浓度;反应是否达到平衡可以从速率(正逆反应速率是否相等)、量(是否保持不变)、压强、气体平均密度,气体平均摩尔质量、颜色等方面判断;验证多个因素对化学反应速率的影响规律,要控制变量做对比实验,每组对比实验只能有一个变量。
【详解】
(1)反应物比生成物的总能量大,说明是放热反应,
<0;
(2)V(N2)=0.5V(NO)=
=1.875
10-4mol·L-1·s-1。
(3)NO的转化率等于反应掉的NO除以原有总的NO,可列式
=90%。
(4)催化剂可以加快反应速率,A正确;温度越高,反应速率越快,B正确,C错误;缩小容器体积,会增大各组分的浓度,浓度越高,反应速率越快,D正确。
故答案选ABD;
(5)由表中数据可知,第4s后,反应物的浓度不再变化,达到平衡;
A.恒温恒压下,压强不变意味着气体的总物质的量不变,而该反应两边的气体计量数之和不同,气体的总物质的量不变说明达到平衡,A正确;
B.气体的密度等于气体的质量除以体积,因为所有组分都是气体,气体的质量不变,因为恒容容器,所以气体不变,所以气体的密度永远不变,与平衡没有关系,B错误;
C.c(NO)不变,意味着达到平衡,C正确;
D.因为NO和CO的化学计量数之比为1:
1,且都是反应物,所以单位时间里消耗NO和CO的物质的量一定相等,不能说明达到平衡,D错误;
故答案:
4;AC;
(6)①验证多个因素对化学反应速率的影响规律,要控制变量做对比实验。
I和II因为催化剂的比表面积不同,所以其他条件应该是一样的,研究的是催化剂比表面积对化学反应速率的影响规律;II和III因为温度不一样,所以其他条件应该是一样的,研究的是温度对化学反应速率的影响规律;
故答案是:
5.80
10-3,280,1.20
10-3,1.20
10-3,5.80
10-3;
②I和II的区别是催化剂的比表面积,催化剂加快反应速率,所以II更快的达到平衡,但催化剂不影响平衡,所以I和II平衡时NO的浓度一样,c(NO)变化曲线如图:
。
【点睛】
验证多个因素对某物质或某性质的影响规律,要控制变量做对比实验,每组对比实验只能有一个变量。
2.化学反应速率与限度与生产、生活密切相关
(1)A学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min)
1
2
3
4
5
氢气体积(mL)(标准状况)
100
240
688
810
860
①反应速率最大的时间段是____________(填0~1、1~2、2~3、3~4、4~5)min,原因是____________。
②在2~3min时间段以盐酸的浓度变化来表示的反应速率为____________。
(设溶液体积不变)
(2)B学生也做同样的实验,但由于反应太快,测不准氢气体积,故想办法降低反应速率,请你帮他选择在盐酸中加入下列____________以减慢反应速率。
(填写代号)
A.冰块B.HNO3溶液C.CuSO4溶液
(3)C同学为了探究Fe3+和Cu2+对H2O2分解的催化效果,设计了如图所示的实验。
可通过观察___________________________现象,定性比较得出结论。
有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是__________________________,
【答案】2~3因该反应放热,随着反应,溶液温度升高,故反应速率加快0.2mol·L-1·min-1A反应产生气泡的快慢控制阴离子相同,排除阴离子的干扰
【解析】
【分析】
(1)单位时间内生成氢气的体积越大反应速率越快;锌与盐酸反应放热;
②2~3min生成氢气的体积是448mL(标准状况),物质的量是
,消耗盐酸的物质的量0.4mol;
(2)根据影响反应速率的因素分析;
(3)双氧水分解有气泡产生;根据控制变量法,探究Fe3+和Cu2+对H2O2分解,控制阴离子相同;
【详解】
(1)根据表格数据,2min~3min收集的氢气最多,反应速率最大的时间段是2~3min;锌与盐酸反应放热,随着反应,溶液温度升高,故反应速率加快;
②2~3min生成氢气的体积是448mL(标准状况),物质的量是
,消耗盐酸的物质的量0.04mol,
=0.2mol·L-1·min-1;
(2)A.加入冰块,温度降低,反应速率减慢,故选A;
B.加入HNO3溶液,硝酸与锌反应不能生成氢气,故不选B;
C.加入CuSO4溶液,锌置换出铜,构成原电池,反应速率加快,故不选C;
(3)双氧水分解有气泡产生,可通过观察反应产生气泡的快慢,定性比较催化效果;根据控制变量法,探究Fe3+和Cu2+对H2O2分解,控制阴离子相同,排除阴离子的干扰,所以FeCl3改为Fe2(SO4)3更为合理。
【点睛】
本题主要考查化学反应速率的影响因素,明确影响反应速率的因素是解题关键,注意控制变量法在探究影响化学反应速率因素实验中的应用,理解原电池原理对化学反应速率的影响。
3.能源与材料、信息一起被称为现代社会发展的三大支柱。
面对能源枯竭的危机,提高能源利用率和开辟新能源是解决这一问题的两个主要方向。
(1)化学反应速率和限度与生产、生活密切相关,这是化学学科关注的方面之一。
某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水法收集反应放出的氢气,实验记录如下(累计值):
时间/min
1
2
3
4
5
氢气体积/mL(标况)
100
240
464
576
620
①哪一段时间内反应速率最大:
__________min(填“0~1”“1~2”“2~3”“3~4”或“4~5”)。
②另一学生为控制反应速率防止反应过快难以测量氢气体积。
他事先在盐酸中加入等体积的下列溶液以减慢反应速率但不影响生成氢气的量。
你认为可行的是____________(填字母序号)。
A.KCl溶液B.浓盐酸C.蒸馏水D.CuSO4溶液
(2)如图为原电池装置示意图:
①将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是_______(填字母)。
A.铝片、铜片B.铜片、铝片
C.铝片、铝片D.铜片、铜片
写出插入浓硝酸溶液中形成的原电池的负极反应式:
_______________。
②若A为Cu,B为石墨,电解质为FeCl3溶液,工作时的总反应为2FeCl3+Cu=2FeCl2+CuCl2。
写出B电极反应式:
________;该电池在工作时,A电极的质量将_____(填“增加”“减小”或“不变”)。
若该电池反应消耗了0.1molFeCl3,则转移电子的数目为_______。
【答案】2~3ACBCu-2e−=Cu2+Fe3++e−=Fe2+减小0.1NA
【解析】
【分析】
(1)①先分析各个时间段生成氢气的体积,然后确定反应速率最大的时间段。
②A.加入KCl溶液,相当于加水稀释;
B.加入浓盐酸,增大c(H+);
C.加入蒸馏水,稀释盐酸;
D.加入CuSO4溶液,先与Zn反应生成Cu,形成原电池。
(2)①将铝片和铜片用导线相连,一组插入浓硝酸中,铝发生钝化,铜失电子发生反应;一组插入烧碱溶液中,铜不反应,铝与电解质发生反应,由此确定两个原电池中的负极。
由此可写出插入浓硝酸溶液中形成的原电池的负极反应式。
②若A为Cu,B为石墨,电解质为FeCl3溶液,工作时A作负极,B作正极,则B电极,Fe3+得电子生成Fe2+;该电池在工作时,A电极上Cu失电子生成Cu2+进入溶液。
若该电池反应消耗了0.1molFeCl3,则Fe3+转化为Fe2+,可确定转移电子的数目。
【详解】
(1)①在1min的时间间隔内,生成氢气的体积分别为140mL、224mL、112mL、44mL,从而确定反应速率最大的时间段为2~3min。
答案为:
2~3;
②A.加入KCl溶液,相当于加水稀释,反应速率减慢但不影响生成氢气的体积,A符合题意;
B.加入浓盐酸,增大c(H+),反应速率加快且生成氢气的体积增多,B不合题意;
C.加入蒸馏水,稀释盐酸,反应速率减慢但不影响生成氢气的体积,C符合题意;
D.加入CuSO4溶液,先与Zn反应生成Cu,形成原电池,反应速率加快但不影响氢气的总量;
故选AC。
答案为:
AC;
(2)①将铝片和铜片用导线相连,一组插入浓硝酸中,铝发生钝化,铜失电子发生反应;一组插入烧碱溶液中,铜不反应,铝与电解质发生反应,由此确定两个原电池中的负极分别为铜片、铝片,故选B。
由此可写出插入浓硝酸溶液中形成的原电池的负极反应式为Cu-2e−=Cu2+。
答案为:
B;Cu-2e−=Cu2+;
②若A为Cu,B为石墨,电解质为FeCl3溶液,工作时A作负极,B作正极,则B电极上Fe3+得电子生成Fe2+,电极反应式为Fe3++e−=Fe2+;该电池在工作时,A电极上Cu失电子生成Cu2+进入溶液,A电极的质量将减小。
若该电池反应消耗了0.1molFeCl3,则Fe3+转化为Fe2+,可确定转移电子的数目为0.1NA。
答案为:
减小;0.1NA。
【点睛】
虽然铝的金属活动性比铜强,但由于在常温下,铝表面形成钝化膜,阻止了铝与浓硝酸的进一步反应,所以铝与浓硝酸的反应不能持续进行,铝作正极,铜作负极。
4.合成氨工业是贵州省开磷集团的重要支柱产业之一。
氨是一种重要的化工原料,在工农业生产中有广泛的应用。
(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:
N2(g)+3H2(g)
2NH3(g)。
该可逆反应达到平衡的标志是___。
a.3v正(H2)=2v逆(NH3)
b.单位时间生成mmolN2的同时生成3mmolH2
c.容器内的总压强不再随时间而变化
d.混合气体的密度不再随时间变化
(2)工业上可用天然气原料来制取合成氨的原料气氢气。
某研究性学习小组的同学模拟工业制取氢气的
原理,在一定温度下,体积为2L的恒容密闭容器中测得如下表所示数据。
请回答下列问题:
时间/min
CH4(mol)
H2O(mol)
CO(mol)
H2(mol)
0
0.40
1.00
0
0
5
a
0.80
c
0.60
7
0.20
b
0.20
d
10
0.21
0.81
0.19
0.64
①写出工业用天然气原料制取氢气的化学方程式:
___。
②分析表中数据,判断5min时反应是否处于平衡状态?
___(填“是”或“否”),前5min反应的平均反应速率v(CH4)=___。
③反应在7~10min内,CO的物质的量减少的原因可能是___(填字母)。
a.减少CH4的物质的量b.降低温度c.升高温度d.充入H2
【答案】cCH4(g)+H2O(g)
CO(g)+3H2(g)是0.020mol·L-1·min-1d
【解析】
【分析】
(1)可逆反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的物理量不变,据此分析,注意不同物质的反应速率之比等于计量系数之比;
(2)①结合表中数据,根据化学计量数与物质的量呈正比进行分析解答;
②根据平衡时物质的浓度不再发生变化分析;根据反应速率=△c/△t计算;
③反应在7~10min内,CO的物质的量减少,而氢气的物质的量增大,据此分析。
【详解】
(1)a.达到平衡状态时,v正(H2):
v逆(NH3)=3:
2,即2v正(H2)=3v逆(NH3),故a错误;
b.氮气和氢气都是反应物,单位时间内生产mmol氮气的同时,必然生成3mmol氢气,反应不一定达到平衡状态,故b错误;
c.该反应正反应是体积减小的反应,在恒容条件下,反应正向进行,气体的总压强减小,反应逆向进行,气体的总压强增大,容器内的总压强不变时,反应达到平衡状态,故c正确;
d.根据质量守恒、容器的体积不变得知,无论反应是否达到平衡状态,混合气体的密度始终不变,所以不能作为判断平衡状态的依据,故d错误;
故答案为:
c;
(2)①由表中数据可知,反应5min,消耗0.2molH2O,生成0.3molH2,因此H2O和H2的化学计量数之比为1:
3,反应7min时,消耗0.2molCH4,生成0.2molCO,因此CH4和CO的化学计量数之比为1:
1,则用天然气原料制取氢气的化学方程式为CH4(g)+H2O(g)
CO(g)+3H2(g),故答案为:
CH4(g)+H2O(g)
CO(g)+3H2(g);
②根据方程式CH4+H2O=CO+3H2结合表中数据可知c=0.2,所以5min时反应已经处于平衡状态;前5min内消耗甲烷是0.2mol,浓度是0.1mol/L,则反应的平均反应速率v(CH4)=0.1mol/L÷5min=0.02mol·L-1·min-1,故答案为:
是;0.020mol·L-1·min-1;
③反应在7~10min内,CO的物质的量减少,而氢气的物质的量增大,可能是充入氢气,使平衡逆向移动引起的,d选项正确,故答案为:
d。
5.某反应在体积为5L的恒容密闭的绝热容器中进行,各物质的量随时间的变化情况如图所示
已知A、B、C均为气体
。
(1)该反应的化学方程式为_______________。
(2)反应开始至2分钟时,B的平均反应速率为_______________。
(3)能说明该反应已达到平衡状态的是_______________。
A.v(A)=2v(B)
B.容器内气体密度不变
C.v逆(A)=v正(C)
D.各组分的物质的量相等
E.混合气体的平均相对分子质量不再改变的状态
(4)由图求得平衡时A的转化率为_______________。
(5)下表是该小组研究影响过氧化氢H2O2分解速率的因素时采集的一组数据:
用
制取
所需的时间
秒
30%H2O2
15%H2O2
10%H2O2
5%H2O2
无催化剂、不加热
几乎不反应
几乎不反应
几乎不反应
几乎不反应
无催化剂、加热
360s
480s
540s
720s
MnO2催化剂、加热
10s
25s
60s
120s
①该研究小组在设计方案时。
考虑了浓度、_______________、_______________等因素对过氧化氢分解速率的影响。
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?
_______________。
(6)将质量相同但聚集状态不同的
分别加入到5mL5%的双氧水中,并用带火星的木条测试。
测定结果如下:
催化剂
操作情况
观察结果
反应完成所需的时间
粉末状
混合不振荡
剧烈反应,带火星的木条复燃
3.5分钟
块状
反应较慢,火星红亮但木条未复燃
30分钟
①写出
发生分解的化学反应方程式_______________。
②实验结果说明催化剂作用的大小与_______________有关。
【答案】2A(g)+B(g)⇌2C(g)0.1mol/(L∙min)CE40%温度催化剂增大反应物浓度越大,可以加快反应速率;升高温度,可以加快化学反应速率;使用合适的催化剂,可以加快化学反应速率;(答其中一条即可)2H2O2
2H2O+O2↑固体的接触面积
【解析】
【分析】
通过各物质的物质的量变化与计量系数呈正比,可得反应式为2A(g)+B(g)⇌2C(g),同时通过变化量可以就算化学反应速率以及反应物的转化率;平衡状态的判定:
A.v(A)=2v(B),没有体现正逆方向,不能判定是否达到平衡,错误;B.容器内气体密度不变,该体系从开始反应到平衡,密度是定值没有变化,不能判定是否达到平衡状态,错误;C.v逆(A)=v正(C),不同物质正逆反应速率呈计量系数比,可以判定达到平衡,正确;D.各组分的物质的量相等,不能作判定,错误,可以改成各物质的量保持不变,可判定平衡;E.混合气体的平均相对分子质量在数值上等于摩尔质量M,由于前后气体粒子数目可变,则混合气体的相对分子质量和M是变量可以作平衡的判定依据,正确;根据表格,探究双氧水的浓度、反应的温度、催化剂对过氧化氢H2O2分解速率的影响,在探究不同的因素时才用控制变量法来探究可得结果。
【详解】
(1)由图像可得,A、B逐渐减小是反应物,C逐渐增多是产物,当反应到达2min,Δn(A)=2mol,Δn(B)=1mol,Δn(C)=2mol,各物质的物质的量变化与计量系数呈正比,故反应式为2A(g)+B(g)⇌2C(g);
(2)反应开始至2分钟时,B的平均反应速率v(B)=
=
=0.1mol/(L∙min);
(3)由分析可得,答案选CE;
(4)由图求得平衡时A的转化率α=
×100%=
=40%;
(5)①根据表中的数据,没有催化剂不加热,不同浓度的双氧水几乎不反应,在无催化剂但是加热的情况下,双氧水发生分解,且双氧水浓度越大分解速率越快,说明反应物浓度和温度对分解速率有影响。
对比无催化剂加热状态,有催化剂加热的情况下,分解速率也明显加快,故答案为温度和催化剂;②分析表中的数据,增大反应物浓度越大,可以加快反应速率;升高温度,可以加快化学反应速率;使用合适的催化剂,可以加快化学反应速率;
(6)①双氧水在二氧化锰的作用下发生反应:
2H2O2
2H2O+O2↑;②其他条件不变,粉末状的二氧化锰比块状二氧化锰反应所需时间段,说明固体的接触面积对反应速率有影响。
【点睛】
平衡状态的判定的核心在于物理量是否是个变量,若为变量当保持不变可以作判定平衡的依据,若为定值,则不能作为依据。
6.从能量的变化和反应的快慢等角度研究反应:
。
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同)。
A.使用催化剂B.适当提高氧气的浓度
C.适当提高反应的温度D.适当降低反应的温度
(2)已知该反应为放热反应,下图能正确表示该反应中能量变化的是________。
(3)从断键和成键的角度分析上述反应中能量的变化。
(资料)①键能:
拆开1mol化学键需要吸收的能量,或是形成1mol化学键所放出的能量称为键能。
②化学键的键能:
化学键
H—H
O=O
H—O
键能
436
496
463
请填写表:
化学键
填“吸收热量”或“放出热量”
能量变化
拆开化学键
中的化学键
______
____
中的化学键
______
____
形成化学键
键
______
____
总能量变化
______
____
(4)氢氧燃料电池的总反应方程式为
。
其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。
电路中每转移0.2mol电子,标准状况下消耗H2的体积是__________________L。
【答案】ABCA吸收热量872吸收热量496放出热量1852放出热量484负氧化2.24
【解析】
【分析】
【详解】
(1)常用的加快化学反应速率的方法是:
升高温度,加入正催化剂,增大反应物浓度,增大压强(浓度也增大)等,故选ABC;
(2)反应物的总能量高于生成物的总能量,称为放热反应。
氢气的燃烧反应属于典型的放热反应,所以能正确表示反应能量变化的是A;
(3)拆开1mol化学键需要吸收的能量,或是形成1mol化学键所放出的能量称为键能。
反应物化学键断裂,吸收能量,生成物形成化学键,释放能量,吸收的总能量减去释放的总能量为该反应的能量变化,若为负值,则为放热反应,反之为吸热反应。
则拆开
中的化学键436×2=872
,拆开
中的化学键496
,共吸收1368
,形成
键,放出463×4=1852
,反应的总能量变化为放出484
;
(4)氢氧燃料电池中,氢气作负极反应物发生氧化反应,氧气作正极反应物发生还原反应,根据反应式,每有2mol