化学参考资料复习资料134单元.docx
《化学参考资料复习资料134单元.docx》由会员分享,可在线阅读,更多相关《化学参考资料复习资料134单元.docx(29页珍藏版)》请在冰豆网上搜索。
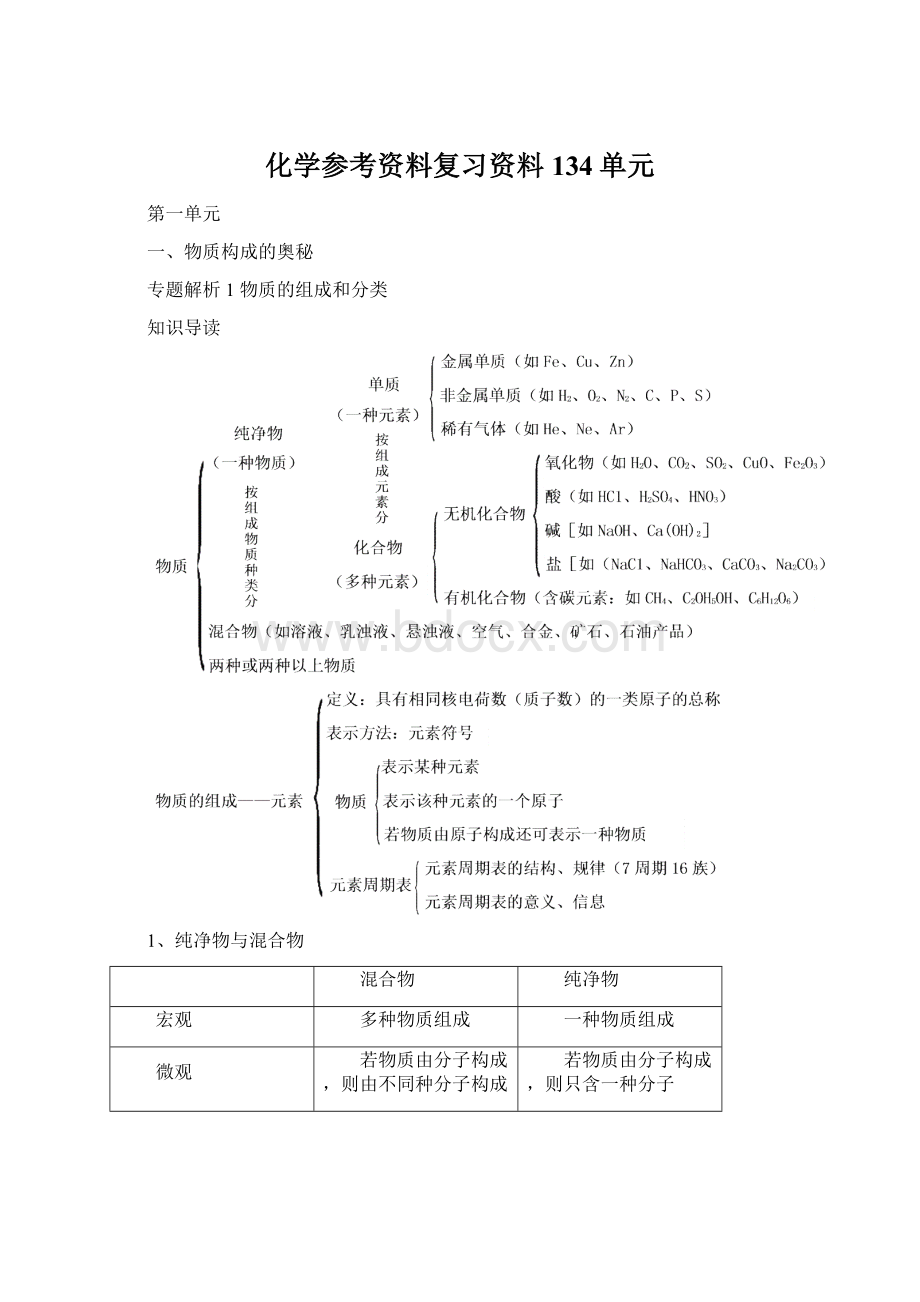
化学参考资料复习资料134单元
第一单元
一、物质构成的奥秘
专题解析1物质的组成和分类
知识导读
1、纯净物与混合物
混合物
纯净物
宏观
多种物质组成
一种物质组成
微观
若物质由分子构成,则由不同种分子构成
若物质由分子构成,则只含一种分子
性质
没有固定的组成(不能写化学式),各成分相互间不发生反应,保持原有的化学性质
有固定的组成(固定的化学式),具有固定的化学性质
举例
空气、食盐水、矿泉水、自来水
O2、CO2、P2O5
注意:
混合物可能只含一种元素,如O2和O3组成的混合气体。
2、单质、化合物、氧化物
单质:
由同种元素组成的纯情净物
化合物:
由不同种元素组成的纯情净物。
氧化物:
由两种元素组成的化合物,其中一种元素是氧元素。
3、酸、碱、盐
酸:
是由氢元素和酸根组成的化合物(水溶液中能解离出唯一的阳离子H+的化合物)。
如:
硫酸(H2SO4)、盐酸(HC1)、硝酸(HNO3)。
碱:
是由金属元素和氢氧根组成的化合物(水溶液中能解离出唯一的阴离子是OH-的化合物)。
如:
氢氧化钠、氢氧化钙、氨水(NH3·H2O)。
盐:
是由金属元素(或铵根)和酸根组成的化合物。
如:
氯化钠、碳酸钠。
酸、碱、盐的水溶液可以导电。
原因:
溶于水时离解形成自由的阴、阳离子。
4、无机化合牧有机化合物(关键差异:
组成中是否含碳元素)
通常把含碳元素的化合物统称有机化合物(CO、CO2及含碳酸根化合物除外)。
5、元素
(1)定义:
具有相同核电荷数(质子数)的一类原子的总称。
注意:
一种元素与另一种元素的本质区别是质子数不同。
由同种元素组成的物质不一定是单质(如由O2、O3组成的混舍物或金刚石与石墨的混合物),更不可能是化合物。
(2)表示方法:
元素符号
①书写方法拉丁文名称的第一个字母大写。
②意义表示某种元素如O:
氧元素
表示该种元素的一个原子如O:
一个氧原子
注意:
有些元素符号还可表示一种单质。
如He等稀有气体、金属、固体非金属三类单质,这些物质通常由原子直接构成。
在元素符号前加上数字后只能有微观意义,没有宏观意义,如3H:
只表示3个氢原子。
③元素周期表发现者:
门捷列夫(俄国化学家)。
排列依据
7横行(7个周期)各周期电子层数相同,核电荷数逐渐增加。
18纵行(16族)各族最外层电子数相同,电子层数逐渐增加(化学性质相似)。
注:
原子序数=质子数
④元素的简单分类
金属元素:
如Mg、A1,最外层电子数特点:
<4。
非金属元素:
如N、C,最外层电子数特点:
≥4。
稀有气体元素:
如He、Ne,最外层电子数特点:
He为2,其余元素最外层为8。
⑤元素之最
地壳:
O、Si、A1、Fe、Ca,动植物细胞:
O、C、H、N、Ca。
⑥元素周期表中每一方格提供的信息
1H
氢
1.008
表示元素的原子序数————表示元素符号
——表示元素名称
表示元素的相对原子质量——
⑦元素周期表的规律
a.每一周期开头的都是金属元素(除第一周期),接近尾部的都是非金属元素,结尾的都是稀有气体元素;
b.同一周期的元素电子层数相同,原子序数、核电荷数、质子数、最外层电子数等依次递增。
c.同一族元素最外层电子数相同,化学性质相似;从上往下,电子层数依次递增。
专题解析2微粒构成物质
知识导读
1、分子和原子
(1)基本性质
1质量、体积都很小。
例:
1滴水(约0.05mL)中大约有1.67×1021个水分子。
2在不停地运动且与温度有关。
温度越高,运动速率越快。
例:
水的挥发、品红的扩散。
3分子间存在间隔。
同一物质气态时分子间隔最大,固态时分子间隔最小;物体的热胀冷
缩现象就是分子间的间隔受热时增大,遇冷时变小的缘故。
④分子都是由原子构成的,同种物质间分子的性质相同,不同物质间分子的性质不同。
(2)分子与原子的比较
分子
原子
定义
由分子构成的物质,分子是保持其化学性质的最小粒子
原子是化学变化中的最小微粒
性质
体积小、质量小;不断运动
联系
分子是由原子构成的,分子、原子都是构成物质的微粒
区别
化学变化中,分子可分,原子不可分
(3)从分子和原子角度来区别下列几组概念
①物理变化与化学变化
由分子构成的物质,发生物理变化时,分子种类不变。
化学变化的实质:
在化学反应中分子破裂为原子,原子重新组合成新的分子。
②纯净物与混合物
由分子构成的物质,纯净物由同种分子构成,混舍物由不同种分子构成。
③单质与化合物
单质的分子由同种原子构成;化合物的分子由不同种原子构成。
(4)分子、原子、物质之间的关系
物质、元素表示宏观只讲种类,不讲个数,用词谈组成(例:
水是由氢元素和氧元素组成的)。
分子、原子表示微观既讲种类,又讲个数,用词谈(例:
H2O,一个水分子是由两个氢原子和一个氧原子构成的)。
2、原子的构成
(1)原子的构成
注:
原子中不一定有中子,如氢原子的原子核内无中子。
(2)在原子中:
原子序数=核电荷数=质子数=核外电子数
(3)原子的质量主要集中在原子核上
(4)三决定
决定元素种类质子数(核电荷数)
决定元素化学性质最外层电子数
决定原子的质量原子核(核内质子数和中子数)
说明:
最外层电子数相同其化学性质不一定相同(特殊情况如He,其最外层电子数虽然为2,但第一个电子层最多容纳2个电子,因此其化学性质稳定,不活泼)。
最外层电子数不同其化学性质有可能相似(He、Ne均为稳定结构)。
(5)原子核外电子的排布
结构示意图的基本含义
最外层电子数与元素化学性质的关系
最外层电子数
是否稳定
化学性质
元素种类
最外层电子数<4
不稳定
易失去最外层电子
通常为金属元素
4≤最外层电子数<8
不稳定
易得电子,使最外层达到稳定结构
通常为非金属元素
最外层电子数=8
稳定
不易得也不易失电子
稀有气体
特例
1.氢元素最外层电子数为1,硼元素最外层电子数为3,但属于非金属元素。
2.氦元素最外层电子数为2(第一层最多容纳2个电子),排满,已达稳定结构,属于稀有气体元素。
(6)相对原子质量
两种公式
相对原子质量≈质子数+中子数
相对原子质量=
概念:
以一种碳原子质量的1/12为标准,其他原子的质量跟它相比较所得到的比,作为这种原子的相对原子质量(符号为Ar)。
碳-12原子是含有6个质子和6个中子的碳原子。
3、离子(带电的原子或原子团)
(1)离子的表示法——离子符号
阳离子:
H+、Na+、Mg2+、A13+()
阴离子:
C1-、F-、S2-(OH、、、)
说明:
括号中为常见原子团的离子符号
(2)离子符号的意义(数字2的意义)
2Mg2+左2表示两个镁离子,离子符号前边的化学计算数表示离子个数;右上2表示每个镁离子带两个单位的正电荷。
(3)离子与原子的区别
粒子的种类
原子
离子
阳离子
阴离子
区别
粒子结构
质子数=电子数
质子数>电子数
质子数<电子数
粒子电性
不显电性
显正电
显负电
符号
用元素符号表示:
Na、C1
用阳离子符号表示:
Na+、
用阴离子符号表示:
C1-、
专题解析3化学式和化合价
知识导读
写对化学式你可能需要的知识:
化学式
物质命名的规律
两种元素组成的物质命名(氧化物的命名)、含酸根物质的命名、物质名称中的化合价特征
化合价
核外电子排布(最外层电子的得与失)、离子符号所带电荷、化合价顺口溜、化合价的简单计算
元素符号
元素周期表前20号元素的名称和符号、九年级常见元素的名称及符号
符号和数字的意义
化学式的意义、元素符号的意义、数字出现在符号正前方、正上方、右上角、左下角的意义
1、物质命名的规律(读懂物质名称,知道物质组成中应该写出的元素种类、原子团等)
两种元素组成的通常读为“某化某”,如氯化钠NaC1、氧化铜CuO、氧化镁MgO、氧化铝A12O3(氧化物“几氧化几某”,如五氧化二磷P2O3、四氧化三铁Fe3O4)。
三种元素组成的含、、等酸根的化合物命名通常读作“某酸某”,如硫酸铜(CuSO4)、碳酸钙(CaCO3)、硝酸根(AgNO3)等;含OH—的化合物通常读作“氢氧化某”,如氢氧化钠(NaOH)、氢氧化钙[Ca(OH)2]等。
如某元素显多化合价中较低正价的命名,可能读为“某化亚某”,如氧化亚铁(FeO)、氯化亚铁(FeC12);“某酸亚某”,如硫酸亚铁(FeSO4);“氢氧化亚某”,如氢氧化亚铁[Fe(OH)2]。
酸类物质命名时,氢元素不读,如硫酸(HC1)。
2、化合价(重运用,轻概念)
(1)表示方法
表示化合价时,用正负号和数字组合的形式标注在元素符号或原子团符号的正上方,正负号在前、数字在后,标化合价时,数字1不省略。
注意:
表示离子符号时,数字在前、符号在后,数字1省略。
(2)化合价规则
①有正负
所有元素在单质中的化合价均为零;化合物中正负化合价的代数和为零(原子团的化合价代数和不为零)。
②同种元素在不同化合物中可显不同的化合价
在同一物质里,同种元素的化合价可能相同,也可能不同。
例如:
NH4NO3中的氮元素分别为-3价和+5价。
(3)常见化合价的判断记忆方法
①根据原子最外层电子数得失判断常见元素的最高正价或最低负价。
例:
11号元素钠,其最外层电子数为1,容易失去1个电子达到相对稳定结构,带1个单位正电荷,所以其化合价为+1价
17号元素氯,其最外层电子数为7,容易得以1个电子达到相对稳定结构,带1个单位负电荷,所以其常见化合价为-1价。
②离子符号:
离子符号右上角所带正负电荷的数值,与最外层电子的得失紧密相连,因此,通过已知离子符号,也能知道该元素在此化合物中的化合价。
例:
带2个单位负电荷,说明硫酸根的化合价为-2价;Mg2+带2个单位正电荷,说明镁元素在该化合物中显+2价。
③口诀法(能记住大多数元素常见的化合价)
一价氢氯钾钠银,二价氧钙钡镁锌
三铝四硅五价磷,二三铁,二四碳
二四六硫都齐全,铜汞二价最常见
单质零价永不变,负一氢氧硝酸根
负二碳酸硫酸根,正一价的是铵根
(其中加点的元素和数字表示负价)
④利用化合价原则展开计算(化合物中正负化合价的代数和为零)
①②③三种方法能让我们判断或记住许多常见化合价,但实际运用中会遇到某些元素存在多种化合价,或遇到了一种陌生的元素(或原子团),要想知道它们的化合价,可通过化合价原则进行计算。
①②③三种方法所掌握的化合价是展开计算的基础。
KC1O3:
通过前三种方法,我们可判断钾元素的化合价为+1价,氧元素的化合价为-2价,则1+氢元素化合价+(-2)×3=0氢元素化合价=+5价。
(4)化合价的应用
①根据化合价书写化学式
一般正价元素符号写在前,负价元素符号写在后(正先负后)
注意:
只有确实知道某种化合物存在,才能根据元素化合价写出化学式,切不可胡编乱造。
②检验化学式的正误
一个写正确的化学式,正负化合价的代数和为零,如果正负化合价代数和不为零,说明化学式有误。
3、常见符号及数字的含义
符号
含义
总结
数字的含义
正前方
2H、2H2、3Fe2+
2个氢原子、2个氢原子分子、3个亚铁离子
1.符号前方的数字,表示对应微粒的个数,谈论个数,只能表示微观,没有宏观意义
2.右上角数字表示离子所带电荷的数量
3.右下角数字表示某分子中原子构成的数量
4、正上方数字表示某元素或某原子团在化合物中呈现的正负化合价
右上角
Fe2+
每个亚铁离子带两个单位正电荷
右下角
H2、
CO2
每个氢分子含有2个氢原子
每个二氧化碳分子含有2个氧原子
正上方
-2
S
-2
SO4
表示硫元素在某化合物中显-2价
表示硫酸根在某化合物中显-2价
符号的含义
元素
符号
O
氧元素
1.表示1种元素
2.表示该元素的一个原子
3.金属、稀有气体、固态非金属三类元素符号除表示元素和原子外,还可表示物质
一个氧原子
Fe
铁元素、1个铁原子、单质铁
离子
符号
Mg2+
镁离子,镁离子带2个单位的正电荷
只能表示微观,表示离子所带电荷的数量
化学式
H2O
宏观
物质:
表示水这种物质
1.表示一种物质
2.表示某物质的元素
3.表示某物质的一个分子
4.表示某物质一个分子的原子构成
元素:
水是由氢元素和氧元素组成的
微观
分子:
表示一个水分子
原子:
表示一个分子是由2个氢原子和1个氧原子构成的
注意:
金属中、稀有气体及大多数固态非金属通常用元素符号表示它们的化学式;而氧气、氢气、氮气、氯气等非金属气体的分子由两个原子构成,其化学式表示为O2、H2、N2、C12。
4、有关相对分子质量的计算
(1)计算相对分子质量
相对分子质量=化学式中各原子的相对原子质量与各原子的个数乘积的总和。
例:
H2O的相对分子质量=1×2+16=18
(2)计算物质组成元素间的质量比(个体:
个体)
各元素在化合物中所占相对质量之比(通常要求化简为最简整数比)
例:
C6H12O6中各元素间的质量比为(12×6)∶(1×12)∶(16×6)=72∶12∶96=6∶1∶8
(3)计算化合物中某元素与整个化学式的相对原子质量之经(个体:
整体)
某元素在化合物中所占相对质量:
化合物的相对分子质量
H2O中氧元素占整个分子的质量比=16∶(1×2+16)=8∶9
(4)计算物质中某元素的质量分数(个体在整体中所占的百伊始比)
某元素的质量分数==100%
例:
计算硝酸铵(NH4NO3)氮元素的质量分数先根据化学式计算:
NH4NO3的相对分子质量=14+1×4+14+16×3=80
再计算氮元素的质量分数:
×100%=
×100%=35%
注意:
质量分数用百分数表示,计算时,在形式上要乘以100%。
(5)物质中某元素的质量
已知物质的质量和元素的质量分数,求物质中某元素的质量。
物质中某元素的质量=物质的质量×化学式中该元素的质量分数(或质量比)
(该公式可变形,求物质的质量)
第三单元
三、物质的化学变化
专题解析10物质的变化和性质
知识导读
1、物理变化、化学变化的区别与联系
物理变化
化学变化
概念
没有生成其他物质的变化
有其他物质生成的变化
伴随现象
物质的形状、状态等发生变化
常伴随有放热、发光、变色、放出气体、生成沉淀等现象
本质区别
变化时是否有其他物质生成
实例
石蜡熔化、水结成冰、汽油挥发
煤燃烧、铁生锈、食物腐败、呼吸作用
相互关系
物质在发生化学变化中一定伴随物理变化,如石蜡燃烧时发生石熔化。
在发生物理变化时不一定伴随化学变化
化学变化中不一定发光、放热、变色、放出气体、产生沉淀等全部现象发生,有这些现象发生的变化也不一定是化学变化,这些现象只能作为判断化学变化的参考,而不能作为判断的依据。
判断某变化是否为化学变化,依据是看有没有其他物质生成,如电灯通电后有发光、放热现象,但该变化是物理变化。
2、物理性质、化学性质之间的区别与联系
物理性质
化学性质
概念
物质不需要发生化学变化就能表现出来的性质
物质在化学变化中表现出来的性质
实质
物质的微粒组成结构不变所呈现出的性质
物质的微粒组成结构改变时所呈现出的性质
实例
颜色、状态、气味、熔点、沸点、硬度、密度、溶解性、挥发性、吸附性、导电性、导热性、延展性
可燃性、氧化性、稳定性、助燃性、还原性、酸性、碱性等
确定
由感官直接感知或由仪器测定
通过化学变化可知
区别
是否需要通过化学反应表现出来
3、变化与性质之间的区别与联系
在变化语句中加“能”或“可以”或“易”“会”“难于”等词语,变成了相应的性质。
例:
纸张燃烧,是化学变化;纸张能燃烧则是代表纸张的一种化学性质。
专题解析11化学变化的分类
知识导读
1、四种基本反应类型
(1)化合反应
由两种或两种以上物质生成另一种物质的反应,“多变一”;
(2)分解反应
由一种反应物生成两种或两种以上其他物质的反应,“一变多”;
(3)置换反应(单质+化合物→新单质+新化合物)
一种单质和一种化合物反应,生成另一种单质和化合物的反应
(4)复分解反应(化合物+化合物→两种新化合物)
两种化合物相互交换成分,生成另外两种化合物的反应。
复分解反应发生的条件:
当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
反应实质:
生成气体:
H+与;与OH-。
生成水:
H+与OH-。
生成沉淀:
Ca2+与;Ba2+与或;Ag+与C1-;Mg2+和OH-等。
能结合形成H2O、沉淀、气体的离子间,通常不能同时存在于同一溶液中,即不能共存,同理可解释物质不能共存。
2、其他反应类型
(1)氧化还原反应
氧化反应:
物质得到氧的反应;
还原反应:
物质失去氧的反应;
氧化剂:
提供氧的物质;
还原剂:
夺取氧的物质(常见还原剂:
H2、C、CO)。
(高中知识中常用反应前后元素化合价升降来判断氧化还原反应,反应前后元素化合价升高的,失电子,被氧化;反应前后元素化合价降低的,得电子,被还原)
(2)中和反应
酸与碱作用生成盐水和水的反应(属于分解反应中的一种)
注:
常见化学反应方程式分类总结参见附录Ⅱ
专题解析12质量守恒定律
知识导读
1、质量守恒定律
(1)含义:
参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
说明:
质量守恒定律只适用于化学变化,不适用于物理变化;没有参加反应的物质质量及不是反应生成的物质质量不能计入“总和中”;要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏。
(2)微观解释:
在化学反应前后,原子的种类、数目、质量均保持不变(原子的“三不变”)。
(3)化学反应前后
①一定不变
宏观:
反应物、生成物总质量不变;元素种类、质量不变
微观:
原子的种类、数目、质量不变
②一定改变
宏观:
物质的种类一定变
微观:
分子种类一定变
③可能改变:
分子总数可能变
化学方程式的含义
2H2+O2点燃2H2O
宏观意义
表明反应物、生成物、反应条件
氢气和氧气在点燃的条件下生成水
微观意义
表示反应物和生成物之间分子(或原子)个数比(对气体而言,分子个数比等于体积之比)
每2个氢分子与1个氧分子化合生成2个水分子(氢分子、氧分子与水分子的个数比为2∶1∶2)
各物质间质量比
化学计算数×相对分子质量之比
每4份质量的氢气与32份质量的氧气完全化合生成36份质量的水(氢气、氧气与水的质量比为4∶32∶36;质量比是利用化学方程式计算的基础)
2、如何正确书写化学方程式
化学方程式
(1)含义:
用化学式表示化学反应的式子。
能直接反映质量守恒定律。
(2)遵循原则:
①以客观事实为依据;②遵守质量守恒定律。
(3)书写的步骤
①写写出反应物、生成物的化学式
②配配平方程式(配平:
在化学式前配上适当的化学计量数,使左右两边各种原子数目相等)。
③注注明反应条件和生成物的状态(反应前无固体,生成物是固体↓;反应前无气体,生成物是气体标↑)。
④等将横线改为“”
3、利用化学方程式的简单计算
(1)依据:
利用化学方程式能反映物质的质量比,且质量呈正比例关系。
(2)步骤:
①设未知数;②根据题意写出方程式;③根据化学方程式找出已知量与未知量的质量比;④列出比例式,并求出未知数;⑤依题意答。
(3)根据化学方程式计算应注意些什么
①写出与题目有关的化学方程式,是解这类问题的关键一步。
②化学方程式所表示的是纯物质之间的反应,因此不纯物质的质量必须换算成纯物质的质量后,才能代入化学方程式,列出比例式进行计算。
纯物质与不纯物质的质量的换算关系是:
纯净物质的质量=不纯物质的质量×纯物质的质量分数
不纯物质的质量=纯净物质的质量÷纯物质的质量分数
③一般用质量单位计算,如果要求气体或液体的体积,应先求出质量,然后再根据密度换算成何积。
④如果是多步反应,可根据几个化学方程式找出有关物质间的关系式,并计算出有关物质的关系量来求解,这样可以简化计算步骤(关系式法解题)。
⑤已知两反应物的量,如果有一反应物过量,则应根据量少的反应物来进行计算。
⑥各物质单位必须统一。
第四单元化学与社会发展
专题解析13能源利用与环境保护
知识导读
1、燃烧和灭火
(1)燃烧和灭火
燃烧的
定义
可燃物与空气中氧气发生的一种发光、放热的剧烈的氧化反应
注意:
发光、放热的现象不一定是燃烧,如电灯发光、放热
燃烧的
条件
1.可燃物2.氧气(或空气)
3.达到燃烧所需的最低温度
三者缺一不可,否则不能燃烧
灭火的
原理
1清除可燃物或使可燃物与其他物质隔离
2.隔绝氧气(或空气)
3.使温度降到着火点以下(燃烧的条件决定着灭火的原理,只要破坏燃烧的任何一个条件,就可以达到灭火的目的)
(1)油锅着火,可用锅盖盖灭,使可燃物与空气隔离
(2)纸箱着火,可用水浇灭,隆温,使可燃物与空气隔离
(3)森林着火,可将大火蔓延前方的树木砍掉,制造隔离带(隔离可燃物)
(4)图书档案着火,用干冰(固体CO2)灭火,隔绝空气(CO2密度比空气大,覆盖在可燃物表面),降低温度(干冰升华吸热)
模拟泡沫
灭火器
Na2CO3+2HC12NaC1+H2O+CO2↑(该反应只是实验室中的模拟实验,不是真正的泡沫灭火器反应)
浓盐酸与饱和碳酸钠溶液迅速反应,短时间内产生大量二氧化碳气体,装置内气压增大,使二氧化碳气体、水等物质一同喷在可燃物表面,水降低了环境的温度,二氧化碳隔绝了空气,从而实现灭火
几种常用灭火器的灭火原理和使用范围见教材。
(2)易燃物和易爆物的安全知识
爆炸
有限空间内气压急剧增大,超过空间的承受能力就会发生爆炸
物理
爆炸
特点:
无新物质产生,仅由气压超负荷而引起
热水瓶爆炸,锅炉爆炸,气球爆炸,夏天轮胎爆炸(提示我们,热水瓶不要塞得太紧;锅炉要定期检查并清除水垢;夏天轮胎充气不要太胀)
化学
爆炸
可燃物在有限的空间内急剧地燃烧,短时间内聚积大量的热,使气体的体积迅速膨胀而引起爆炸
都有新
物质产生
瓦斯爆炸
CH4+2O2为点燃CO2+2H2O
物质受撞击引起快速的化学反应,迅速产生大量气体,气压迅速增大引起爆炸
氯酸钾爆炸
2KC1O3为撞击2KC1+3O2↑
碳酸氢铵爆炸
NH4HCO3为撞击NH3↑+H2O↑+CO2↑
注意:
可燃性气体(氢气、一氧化碳、甲烷)或粉尘(面粉、煤粉)与空气或氧气混合,遇到明火可能会发生爆炸,因此,可燃性气体在点燃或加热前都要检验纯度,以防止发生爆炸的危险
油库、面粉加工厂门口贴有“严禁烟火”的标志:
空气中常混有可燃性体或粉尘,接触到明火,就有发生爆炸的危险可燃物与氧气的接触面积越大,燃烧越剧烈,越可能发生爆炸。
2.燃料和热量
(1)化石燃料
化石
燃料
煤
主要含C元素,是混合物形成:
古代植物经复杂