陌生氧化还原反应方程式的书写.docx
《陌生氧化还原反应方程式的书写.docx》由会员分享,可在线阅读,更多相关《陌生氧化还原反应方程式的书写.docx(9页珍藏版)》请在冰豆网上搜索。
陌生氧化还原反应方程式的书写
陌生氧化还原反应化学方程式书写
1、将20mL0.5molJK2SO3溶液逐滴加入到20mL0.2molL-1KMnO4溶液(硫酸酸化)中,
溶液恰好褪为无色。
写出反应的离子方程式:
o
2、已知CO是工业上常用的还原剂,500C时,11.2L(标准状况)SO2在催化剂作用下与CO
发生化学反应。
若有2X6.02X1023个电子转移时,写出该反应的化学方程式
3、在氢氧化钠的环境中,氯气与碘化钠反应,每1mol碘化钠完全反应转移6mol电子,反应化学方程式为o
4、氮气的实验室制法是用氯化铵(NH4CI)与亚硝酸钠(NaNO2)反应,同时生成氯化钠和水.写出该反应的化学方程式:
o
5、氧化还原反应中实际上包含氧化和还原两个过程。
下面是一个还原过程的反应式:
NO3^+4H++3e-~NO+2H2O,KMnO4、NazCOs、CU2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:
o
(2)反应中硝酸体现了、性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:
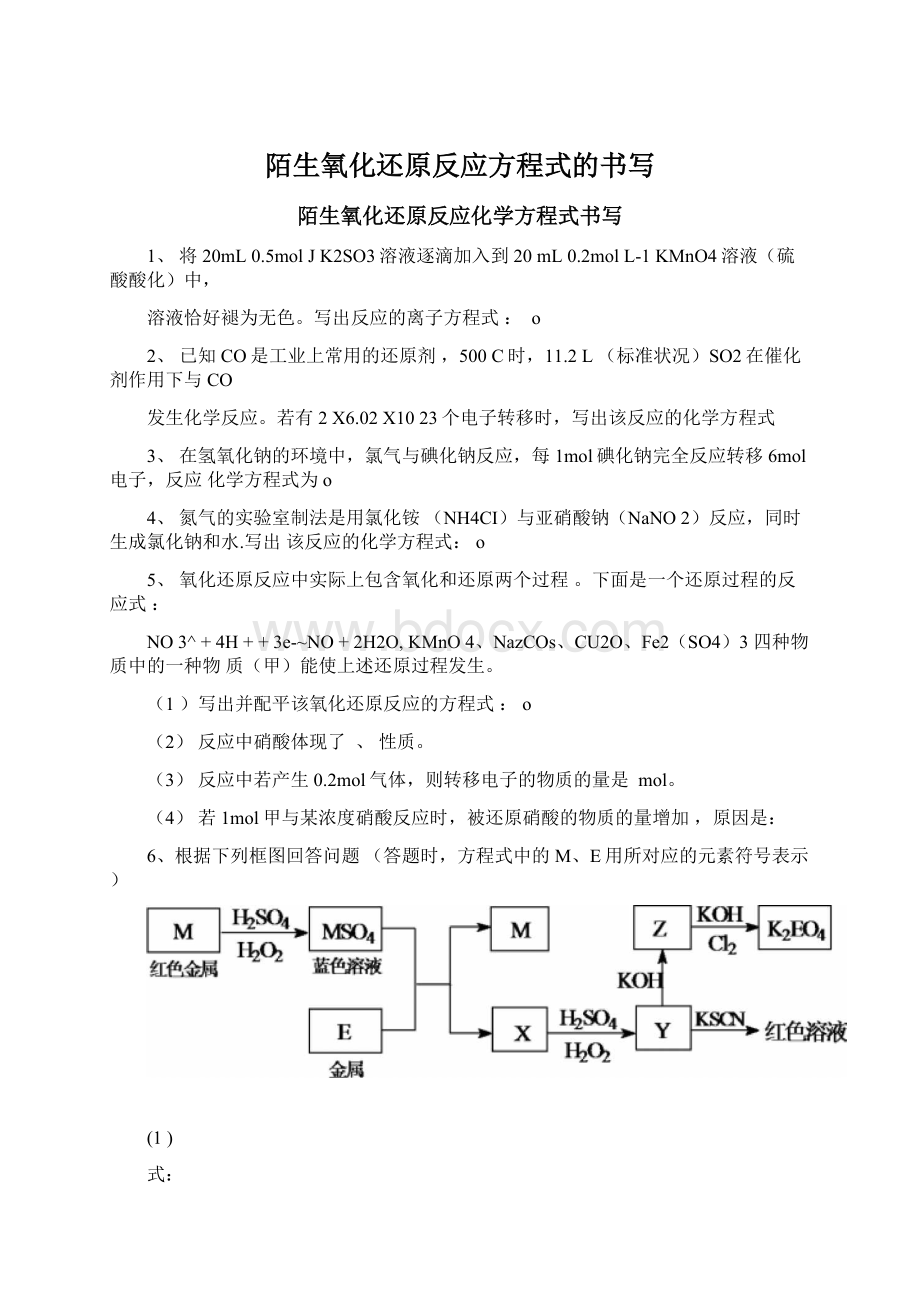
6、根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示)
(1)
式:
写出M溶于稀H2SO4和H2O2混合液的化学方程
O
(2)某同学取X的溶液,酸化后加入KI、淀粉溶液,变为蓝色。
写出与上述变化过程相关的离子方程式:
、
(3)写出Cl2将Z氧化为K2EO4的化学方程式:
(1[①电解法:
原理如右图所示。
阴极的电极反应
2湿法氧化:
在溶液中用次氯酸钠、氢氧化铁和氢氧化钾制
高铁酸钾,其反应的离子方程式为:
。
(2)已知©FeO4溶液中加入稀硫酸,迅速反应产生Fe2(SO4)3的离子方程式
(3)用高铁酸钾和锌制成的高铁碱性电池,能储存比普通碱性电池多50%的电能,已知该电
池的总反应是:
NWMigQ.ZnO2K,ZnC\.,则负极的电极反应是
8、污水及自来水处理的方法有很多
(1)碱性环境下,CI2可将水中的CN-转化为两种无毒的气体。
(2)酸性环境下,向含重铬酸根的废水中加入FeSO4溶液,然后调节溶液的PH,使生成的
Cr3+转化为Cr(OH)3,写出第一步对应的离子方程式
(3)含CN-的污水危害很大。
处理污水时,可在催化剂TiO2作用下用NaCIO将CN-氧化成
CNO-。
CNO-在酸性条件下继续被NaCIO氧化生成N?
和CO?
。
试写出上述两步反应的离
子方程式:
。
(4)臭氧也是一种常用的污水处理剂。
它的氧化性很强,可以和酸性KI淀粉溶液反应,呈现
蓝色,同时放出一种气体,试写出对应的离子方程式
(5)二氧化氯(CIO2)作为一种高效强氧化剂,已被联合国世界卫生组织(WHO)列为AI级安
全消毒剂。
常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定。
温度过高,二氧化
氯的水溶液有可能爆炸。
其制备方法有
方法一:
用氯酸钠(NaCIO3)和硫酸酸化的H2O2反应生成CIO2。
请写出该反应的化学方程式
式。
方法三、
①如图,在烧瓶中先放入一定量的KCIO3和草酸(H2C2O4),然
后再加入足量的稀硫酸,水浴加热。
反应后产物中有CIO2、
氧化产物与还原产物的物质的量之比为
CO2和一种酸式盐,该反应的化学方程式为:
2控制水浴温度在60〜80C之间的目的是。
图示装置中缺少的一种必须的玻璃仪器是。
3A装置用于吸收产生的二氧化氯,其中最好盛放。
(填序号)
①60C的温水②冰水③饱和食盐水
4将足量二氧化氯溶液加入到硫化氢溶液中,所得溶液中加入少量氯化钡溶液,有白色沉淀生成。
请写出二氧化氯溶液和硫化氢溶液反应的离子方程式。
答案:
1.2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O
2.SO2+2CO=SJ+2CO2(500C、催化剂)
3.3C12+Nal+6NaOH=NalO3+6NaCI+3H2O
4.NH4CI+NaNO2=NaCI+2H2O+N2f
5.
(1)14HNO3+3Cu2O=6Cu(NO3)2+2NOf+7H2O
(2)酸性氧化性(3)0.6mol(4)使用了较浓的硝酸,产物中有部分NO2生成
6.⑴Cu+H2O2+H2SO4=CuSO4+2H2。
⑵4Fe2++O2+4H+=4Fe3++2H2O2Fe3++2I—=2Fe2++I2
⑶10KOH+3CI2+2Fe(OH)3=2K2FeO4+6KCI+8H2O
7.(1[①2H++2e—=H2f②2Fe(OH)3+3CIO-+4OH-=2FeO4-+3CI-+5H2O
(2)4FeO42-+20H+=4Fe3++3O2f+10H2O
(3)-ZnO-2ZnO;-5Ek-O
8.2CN-+8OH-+5CI2=2CO2+N2+IOCI-+4H2O
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
cn~+ao~cno~4-cr
.专业专注.
2CN0-+3CIO~+2H*二弘T+2CO2T+3CT-十禺°—
2I-+2H++O3=I2+O2+H2O
2NaCI03+H2O2+H2SO4=Na2SO4+2CIO2t+O2t+2H2O
2CI03-+2CI-+4H+=2CIO2t+CI2t+2H2O
=2C102t+2C0af+2冏百4+2用0
方法三:
⑴一…'''1:
1
(2)使反应正常进行,并防止温度过高引起爆炸。
温度计。
(3[②
(4)5H2S+8CIO2+4H2O=5SO42—+8CI—+18H+
1•硫粉、炭粉与硝酸钾混合,可以得到黑火药。
黑火药爆炸的产物与其组成有关。
一般
黑火药组成为一硫二硝三碳,爆炸产物为©S、N2、C02。
(1)写出黑火药爆炸反应的化学方程式
该反应的氧化剂是,还原剂是。
(2)求氧化产物与还原产物的物质的量之比。
2•某校曾发生在实验室中学生误将高锰酸钾与红磷相混,发生爆炸,造成一死一残的严重
事故。
试写出这一变化的化学方程式(KMnO4的还原产物是MnO2)(并用双线
桥标明化合价升降)
3•某一反应体系中共有Pb3O4、NO、MnO2、62O3、Cr(Mn04)2和Pb(N3)2(名称叠氧化
铅,其中Pb为+2价)六种物质,已知Pb(N3)2是反应物之一。
根据你学过的有关化学定律和知识,试写出这个反应的化学方程式。
4•完成并配平以下化学方程式。
(1)在MnB"的硝酸溶液中,加入PbO2,反应后溶液呈紫红色,并有溴单质生成。
(要求:
化学方程式,用双桥式表示电子得失关系)
(2)在一支试管中,盛少量AS2O3和K2S粉末(物质的量之比为1:
2),往其中加入足
量硝酸并微热。
(提示:
As和S氧化为最高价态,HN03还原为NO。
要求:
用一个化学方程式反映出还原剂的物质的量之比)
(3)在SnCI2的硫酸溶液中滴入KMnO4至刚好反应完全。
(要求:
写离子方程式)
5•完成并配平以下化学方程式。
(1)氯化钠、溴化钠、碘化钠晶体分别与浓硫酸共热(300C以下)。
【提示:
碘化钠可
跟浓硫酸反应生成硫化氢。
】
(2)在MnBr2的硝酸溶液中,加入PbO?
反应后溶液呈紫红色,并有溴单质生成。
(要求:
化学方程式,用双桥式表示电子得失关系)
(3)在一支试管中,盛少量AS2O3和K2S粉末(物质的量之比为1:
2),往其中加入足量硝酸并微热。
(提示:
As和S氧化为最高价态,HNO3还原为NO。
要求:
用一个化学方程式反映出还原齐廿的物质的量之比)
(4)在SnCI2的硫酸溶液中滴入KMnO4至刚好反应完全。
(要求:
写离子方程式)
6•为实现消除碘缺乏病的目标,国家卫生部规定食盐必须加碘,其中碘以碘酸钾或碘化钾的形式存在。
(1)有人烹调时,分别含有碘化钾和碘酸钾的加碘食盐混合,当滴食醋时,产生紫色蒸
气,反应的离子方程式为
(2)这两种加碘食盐可以在潮湿的空气中曝露而加以鉴别,其原理是
反应的离子方程式为
7•分析化学上常用硫代硫酸钠与单质碘反应来进行元素分析。
硫代硫酸根(S2O32-)离子与
12之间的反应进行得迅速、完全,但必须在中性或弱酸性溶液中进行。
因为在碱性溶液中,12
会发生反应,其离子方程式为:
而且12与S2O32-
发生畐U发应,其离子方程式为。
若在强酸性溶液中,Na2S2O3会发生分解,其离子方程式为,
同时I一离子容易与空气中的氧气发生反应,其反应的离子方程式
为。
在用碘量法进行测定时,为防止碘的挥发,在实验中首先
应该采取的措施是。
题型技巧分类训练10陌生情景中化学方程式的书写技巧
1.答案】2KMn04+5H2O=2K0H+2Mn(0H)4+3[0]
解析】注意题设条件中是活性氧,一般以[0]表示。
根据题意写出反应物和生成物,然后
配平即可。
2.答案】
(1)氧化剂、酸N0、N02
(2)0.6mol0.9mol4.48L
(3)3Cu+10H++4N03-=3Cu2++N0T+3N02T+5H20
(4)该反应式含两种还原产物,两者的比例和氧化剂、还原剂的用量都可以发生变化。
解析】
(1)根据硝酸跟铜反应的化学方程式可以看出,硝酸是反应的氧化剂,同时还有
一部分硝酸变成了硝酸盐和水,起到酸性作用,硝酸对应的还原产物是氮氧化物(一氧化氮和
二氧化氮)。
(2)反应中铜失去电子,每摩尔铜参加反应转移2mol电子。
0.3molCu被硝酸完全溶解后,Cu失去的电子的物质的量是0.6mol。
HNO3宀N02宀1e-,HNO3宀NO~3e-,反应中生成了等物质的量的两种气体,贝U(1+3)Xx=0.6mol,x=0.15mol,考虑到起酸性作用的硝
酸,根据质量守恒定律,反应中共消耗硝酸2X0.3mol+0.15mol+0.15mol=0.9mol.因为
3NO2+H2O=2HNO3+N0,当用排水法收集这些气体时,只得到NO,其体积为:
[0.15mol+0.15molX1/3]X22.4L/mol=4.48L.
(3)设生成NO和NO2的物质的量分别为x和y,
根据电子守恒:
3x+y=3X2
根据质量守恒:
2X3+x+y=10
联立两个方程,可得:
x=1,y=3
据此,可写出整个反应的化学方程式。
(4)因为还原产物有两种,不同的反应情况,产生的氮氧化物的比例不相同,相应的化学方程式也不相同,会出现多组系数。
3.答案】D
解析】铁元素由三价变为六价,升高三价,氯元素由0价变为-1价,每个氯分子降低2价,故Fe3+和Cl2前的计量数之比为2:
3,根据电荷守恒,可得0H—前的计量数为16,再根据质量守恒定律可得H2O的化学计量数为8.
4.答案】3S+60H—=2S—+SO32—+3H2O3b+60H一=5厂+103—+3H20
解析】写出反应物和生成物,然后配平即可。
5.瞰军析】
(1)S+2KNO3+3^—K2S+N2+3CO2,从此化学方程式可以看出,反应物
的化学计量数正好是一硫二硝三碳。
氧化剂S、KNO3,还原剂是Co
(2)还原产物©S、
N2,氧化产物C02,所以氧化产物与还原产物的物质的量之比是3:
2。
答案】见解析。
6.答案】
升抽价
30KMnaj+13P=lOKjPOi+SOMnOj+^Oj
澤90价
解析】反应物是P和KMnO4,产物中有MnO2,因为是剧烈的反应,所以,P应变为+5价。
根据化合价升降相等,参加反应的锰和磷的原子个数之比为5:
3•再据质量守恒定律,钾
原子反应后只能生产磷酸钾,配平即可。
7.答案】15Pb(N3)2+44Cr(MnO4)^^22C"O3十88MnO2+5Pb3O4+90NOf
解析】Pb(N3)2是反应物之一”是本题的关键信息,据此可知,Pb3O4和NO是生成物,且铅元素的化合价升高,每生成1分子Pb3O4,同时生成18分子NO,共失去44个电子(需要3分子Pb(N3)2参加反应);根据化合价的变化可以看出,Cr(MnO4)2是反应物,生成物为
MnO2、Cr2O3,其中锰元素化合价降低,铬元素化合价升高,将Cr(MnO4)2作为整体考虑,每有1molCr(MnO4)2参加反应,净转移”得到)5mol电子,故得失电子"的最小公倍数是
220,据此可写出整个反应的化学方程式
8.答案】
(1)
失5e~x2失Cx4
1;
2皿腿+7PIA+14HNQ,=2HMnO4+2Bri+7Pb(+6H2O
得x7
(2)3AS2S3+6K2S+56HNO3=6H3ASO4+15H2SO4+44NOf+4H2O+12KNO3。
(3)5Sn2++10C|—+4MnO4一+32H+=5Sn4十+5Cbf+4Mn2十+16H2O
解析】
(1)在MnBr2的硝酸溶液中,加入PbO2,反应后溶液呈紫红色,说明生成了MnO「并有溴单质生成,介质是硝酸,据此,写出反应物和生成物,然后配平即可。
(2)根据提示,写出反应的方程式,且已知两种主要反应物的物质的量之比为1:
2,将方程式配平。
(3)锡为第IVA族元素,其最高价态为+4价,高锰酸钾在酸性条件下作氧化剂,可以认为其还原产物为Mn2+,特别要小心的是,氯离子同时被氧化。
9•答案】2KMnO4=©MnO4+MnO2+O2f或2KMnO4=©Mn2O6+O2f4KMnO4=2K2Mn2O5+3O2f
解析】加热失重是因为生成了氧气,设有158gKMnO4分解,则在200C加热产生氧气约0.5mol,在240C加热产生氧气约0.75mol。
据此,写出两个反应的化学方程式。
10解析】本题设计的题眼”是碘单质的颜色:
蒸气呈紫色。
答案】
(1)103—+51—+6CH3COOH=3I2+6CH3COO—+3H2O
(2)KI在潮湿空气里,在阳光的作用下会被空气氧化而产生紫黑色固体而KIO3不被空气氧化。
4I-+O2+2H2O=2I2+4OH—
11.答案】3I2+6OH—=IO3—+5I—+3H2O
◎O32—+4I2+10OH—=2SO42—+8I—+5H2O
S2O32+2H+=SO2f+SJ+H2O
4I—+O2+4H+=2I2+2H2O
(或紫色蒸气),
注意,不要将氯
解析】碘单质在碱性溶液中会迅速发生歧化反应生成碘酸盐和碘化钾气跟稀氢氧化钠溶液反应生成次氯酸钠和氯化钠的反应对照迁移过来。