中考化学复习滚动小专题一 气体的制备与净化.docx
《中考化学复习滚动小专题一 气体的制备与净化.docx》由会员分享,可在线阅读,更多相关《中考化学复习滚动小专题一 气体的制备与净化.docx(13页珍藏版)》请在冰豆网上搜索。
中考化学复习滚动小专题一气体的制备与净化
2019-2020年中考化学复习:
滚动小专题
(一)气体的制备与净化
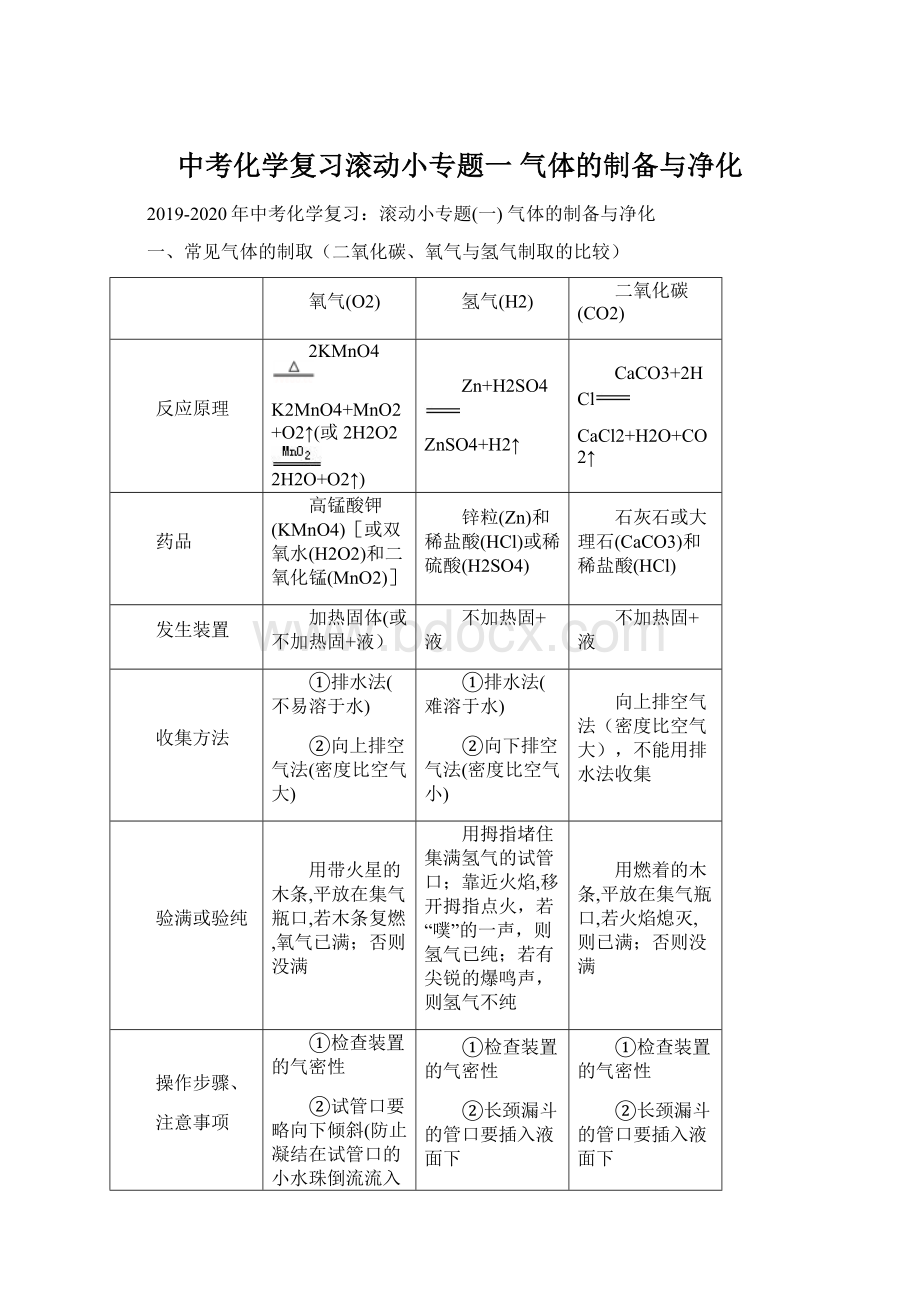
一、常见气体的制取(二氧化碳、氧气与氢气制取的比较)
氧气(O2)
氢气(H2)
二氧化碳(CO2)
反应原理
2KMnO4
K2MnO4+MnO2+O2↑(或2H2O2
2H2O+O2↑)
Zn+H2SO4
ZnSO4+H2↑
CaCO3+2HCl
CaCl2+H2O+CO2↑
药品
高锰酸钾(KMnO4)[或双氧水(H2O2)和二氧化锰(MnO2)]
锌粒(Zn)和稀盐酸(HCl)或稀硫酸(H2SO4)
石灰石或大理石(CaCO3)和稀盐酸(HCl)
发生装置
加热固体(或不加热固+液)
不加热固+液
不加热固+液
收集方法
①排水法(不易溶于水)
②向上排空气法(密度比空气大)
①排水法(难溶于水)
②向下排空气法(密度比空气小)
向上排空气法(密度比空气大),不能用排水法收集
验满或验纯
用带火星的木条,平放在集气瓶口,若木条复燃,氧气已满;否则没满
用拇指堵住集满氢气的试管口;靠近火焰,移开拇指点火,若“噗”的一声,则氢气已纯;若有尖锐的爆鸣声,则氢气不纯
用燃着的木条,平放在集气瓶口,若火焰熄灭,则已满;否则没满
操作步骤、
注意事项
①检查装置的气密性
②试管口要略向下倾斜(防止凝结在试管口的小水珠倒流流入试管底部使试管破裂)
③加热时应先使试管均匀受热,再集中在药品部位加热
④排水法收集完氧气后,先撤导管后撤酒精灯(防止水槽中的水倒流,使试管破裂)
①检查装置的气密性
②长颈漏斗的管口要插入液面下
③点燃氢气前,一定要检验氢气的纯度(空气中,氢气的体积达到总体积的4%~74.2%点燃会爆炸)
①检查装置的气密性
②长颈漏斗的管口要插入液面下
③不能用排水法收集
二、气体的净化与干燥
1.原则:
不能引入新的气体杂质;不能减少被净化的气体的量。
2.顺序:
气体的发生装置——除杂——干燥——主体实验——尾气处理。
3.干燥和净化气体的装置:
洗气瓶和干燥管。
4.常用干燥剂:
浓硫酸、固体氢氧化钠、无水氯化钙等。
5.注意事项:
a、选择的干燥剂(净化剂)必须是只能吸收水分(杂质气体),不与被干燥(净化)的气体反应;b、洗气瓶长导管为进气口,短导管为出气口;干燥管大口进气,小口出气,且两口都应堵一团脱脂棉,防止干燥颗粒进入导气管。
类型1常见气体的制取
例1(2014·滨州)气体的制备是化学实验基本技能之一。
现用如下装置进行化学实验,试回答下列问题:
(1)实验室利用加热高锰酸钾的方法能制得氧气,则发生装置应选用______(填字母);
(2)实验室利用B装置通过复分解反应制得的气体是______,要制取一瓶该气体,所选装置的连接顺序是______(填字母);
(3)证明集气瓶中充满
(2)中所制气体的方法是________________________________________________。
思路点拨:
常见气体发生装置有固体加热型和固液不加热型,加热高锰酸钾的方法制得氧气发生装置选A;B装置常用于实验室制取CO2,由于CO2能溶于水且密度比水大,故收集装置只能用C;二氧化碳的验满是将燃着的木条放在集气瓶口。
类型2气体的净化
例2实验室制得的CO2气体常含有HCl和水蒸气。
为了制得纯净、干燥的CO2气体,除杂装置的导管按气流方向连接顺序是()
A.a→b→c→dB.b→a→c→d
C.c→d→a→bD.d→c→b→a
思路点拨:
实验室制得的CO2气体常含有HCl和水蒸气,除去CO2气体中的HCl常用饱和碳酸氢钠溶液,水蒸气常用液态干燥剂浓硫酸,在除去HCl时又会带出水蒸气,因此要先除去杂质,再干燥除去水蒸气。
一、选择题
1.实验室制取气体选择收集方法时,下列性质:
①颜色;②密度;③溶解性;④可燃性;⑤能否与水反应,必须考虑的是()
A.①②③B.②③④C.③④⑤D.②③⑤
2.常温下,氨气为无色有刺激性恶臭气味的气体,密度比空气小,易溶于水。
氨气溶于水显弱碱性,实验室可用氯化铵固体和氢氧化钙固体混合加热制取。
则下列说法正确的是()
A.可用向下排空气法收集到氨气B.氨水能使紫色石蕊试液变红色
C.多余的氨气可排放到大气中D.实验室制氨气的发生装置与双氧水制氧气相同
3.(2014·潍坊)实验室常用二氧化锰和浓盐酸共热制氯气,反应的化学方程式:
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
下列说法正确的是()
A.反应前后锰元素的化合价不变
B.可以用向上排空气法收集Cl2
C.用浓盐酸配制稀盐酸时,必须用托盘天平、量筒、烧杯和玻璃棒
D.该反应是复分解反应
4.某无色气体X可能含有氢气、一氧化碳、二氧化碳和甲烷四种气体中的一种或两种。
为确认其组成,某同学取一定量该气体按下图所示装置进行实验(假设每步都充分反应或吸收),结果装置①中无明显变化,装置③增重1.8g,装置④增重2.2g。
下列关于气体X成分的分析中,错误的是()
A.一定没有二氧化碳B.可能含有甲烷和氢气
C.可能只有甲烷D.可能含有氢气和一氧化碳
二、填空题
5.(2014·菏泽)实验室制取气体时需要的一些装置如图所示,请回答下列问题:
(1)实验室里用A装置制取氧气的化学方程式为______________________________,可选择的收集装置有______。
若要得到干燥的氧气,所选择装置的连接顺序为______。
(2)某同学利用上述B装置,用贝壳和盐酸反应生成了一种无色气体,请你设计实验方案,应用化学方法检验生成的气体为二氧化碳。
(要求写出操作过程、使用试剂和实验现象)
_____________________________________________________________________________________________________________________________________________________________________________________________________。
6.(2014·重庆)根据下列装置回答问题:
(1)仪器a的名称是______。
(2)C是进行______操作装置中的一部分。
(3)若选用D装置收集CO2,则气体应从______(填“①”或“②”)端进入。
若D装置中盛有NaOH溶液,则可以除去CO气体中混有的CO2,反应的化学方程式为______________________________。
(4)向装置A、B中分别加入两种试剂都可以制得氧气,两个反应中用到的同一种试剂是______(写化学式),该试剂的作用______(填“相同”或“不相同”)。
7.(2014·广安)如图是实验室制取气体时常用的装置(其中G、I为干燥装置),根据装置回答下列问题:
(1)仪器①的名称:
______。
(2)用A装置制取的某气体可使带火星的木条复燃,请写出用A装置制取该气体的化学方程式为__________________________________________。
(3)现用C装置收集一瓶无色无味的气体,欲检验其是否为CO2的方法是__________________,若改用F装置收集该气体,则气体应从______(填“a”或“b”)通入。
(4)常温下,氨气(NH3)是一种有刺激性气味的气体,极易溶于水,密度比空气小,溶液呈碱性。
实验室制取氨气的原理是NH4Cl(固)与Ca(OH)2(固)混合共热。
现要制得干燥的氨气并处理尾气,防止污染空气,所选择的装置连接顺序依次是B→(______)→F→H(填装置序号)。
三、实验探究题
8.(2014·潍坊)某化学小组查阅资料得知:
在不同温度下,甲烷(CH4)可将氧化铁(Fe2O3)还原为Fe、Fe3O4中的一种或两种。
他们为探究甲烷与氧化铁反应后产物(黑色粉末)的成分,进行了如下实验:
(1)按如图装置连接好仪器,检查装置的气密性后,往装置中添加药品。
①向黑色粉末中滴加稀硫酸,观察到有气泡产生,则黑色粉末中含有______,产生气泡的化学方程式是____________________________________。
②导管b的作用是__________________________________________________________________。
(2)按下图装置连接好仪器(图中夹持设备已略去)检查装置的气密性,往装置中添加药品,打开止水夹K通入含有少量二氧化碳的一氧化碳,持续一段时间后再点燃装置C处的酒精喷灯。
①装置A中反应的化学方程式为________________________,装置B中浓硫酸的作用是__________________。
②持续一段时间后再点燃装置C处的酒精喷灯的原因是__________________。
D装置的作用是__________________。
③实验中观察到装置E中石灰水变浑浊,则黑色粉末中含有______。
尾气处理方法为__________________。
参考答案
归类例析
例1
(1)A
(2)CO2(或二氧化碳)BC(3)将燃着的木条放于集气瓶口,若火焰熄灭,则证明已集满气体
例2C
专题精练
1.D2.A3.B4.B5.
(1)2KClO3
2KCl+3O2↑或2KMnO4
K2MnO4+MnO2+O2↑CEA→F→E(或B→F→E)
(2)将生成的气体通入到盛有少量澄清石灰水的试管中(或洗气瓶中),若溶液变浑浊(或有白色沉淀生成),证明生成的气体是二氧化碳。
6.
(1)铁架台
(2)过滤(3)①2NaOH+CO2
Na2CO3+H2O(4)MnO2相同7.
(1)锥形瓶
(2)2H2O2
2H2O+O2↑(3)看是否能使澄清石灰水变浑浊a(4)I8.
(1)①FeFe+H2SO4
FeSO4+H2↑②防止滴加稀硫酸时生成的气体从分液漏斗逸出
(2)①2NaOH+CO2
Na2CO3+H2O除去气体中的水蒸气②防止CO与空气的混合气加热时发生爆炸防止E中的石灰水被倒吸进玻璃管③Fe3O4将尾气点燃
2019-2020年中考化学复习:
滚动小专题(三)溶解度曲线及其应用
一、溶解度曲线的意义
1.溶解度曲线上的每个点表示的是某温度下某种物质的溶解度,即曲线上的任意一点都对应有相应的温度和溶解度。
2.溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度的变化情况。
曲线的坡度越大,说明溶解度受温度影响越大;反之,说明受温度影响较小。
3.两条溶解度曲线的交点表示该点所示的温度下两物质的溶解度相同,此时两种物质饱和溶液的溶质质量分数也相同。
4.在溶解度曲线上的每一个点都表示溶质在某温度下的溶解度,此时的溶液必然是恰好饱和的溶液;在溶解度曲线下方的点,则表示溶液是不饱和溶液;在溶解度曲线上方的点,则表示未溶解的溶质与饱和溶液共存的混合物或过饱和溶液。
二、溶解度曲线的应用
1.溶解度曲线上的点有三个方面的作用:
(1)根据已知温度查出有关物质的溶解度;
(2)根据物质的溶解度查出对应的温度;(3)比较相同温度下不同物质溶解度的大小或者饱和溶液中溶质的质量分数的大小。
2.溶解度曲线也有三个方面的应用:
(1)根据溶解度曲线,可以看出物质的溶解度随着温度的变化而变化的情况;
(2)根据溶解度曲线,比较在一定温度范围内的物质的溶解度大小;(3)根据溶解度曲线,选择分离某些可溶性混合物的方法。
3.如果要使不饱和溶液(曲线下方的一点)变成对应温度下的饱和溶液,方法有两种:
第一种方法是向该溶液中添加溶质使之到达曲线上;第二种方法是蒸发一定量的溶剂。
类型1溶解度曲线的意义
例1(2014·潍坊)甲、乙、丙三种固体物质的溶解度曲线如图所示。
下列说法正确的是()
A.把a1℃时甲、乙的饱和溶液升温到a2℃仍是饱和溶液
B.a2℃时,丙的溶液的质量分数大于乙的溶液的质量分数
C.三种物质的溶解度都随温度的升高而增大
D.a3℃时,三种物质的溶解度大小关系:
甲>丙>乙
思路点拨:
根据甲、乙、丙三种固体物质的溶解度曲线可知,a1℃时甲、乙的饱和溶液升温到a2℃都为不饱和溶液;a2℃时,乙和丙的溶液是否达到饱和都无法确定,所以无法比较其溶液中溶质质量分数的大小;丙物质的溶解度随温度的升高而减小。
类型2溶解度曲线的应用
例2(2014·呼和浩特)如图是a、b、c三种物质的溶解度曲线。
根据图回答:
(1)______℃时,a和c的溶解度相等。
(2)t3℃时,把20克a、b、c三种物质分别加入到盛有50克水的烧杯中不断搅拌,所得溶液的溶质质量分数大小关系为______(填字母,下同);若将温度降低到t1℃时,溶液质量的大小关系为______。
A.c>a=bB.b>a=cC.a>b>cD.b>a>c
(3)在t2℃时,将c物质的不饱和溶液变为饱和溶液,下列有关说法不正确的是______(填字母)。
A.溶剂的质量可能变小B.溶液的质量可能变大
C.溶质的质量分数一定变大D.溶质的质量一定不变
思路点拨:
根据溶解度曲线可知,a和c的溶解度相等时对应的温度为t1℃;t3℃时,把20克a、b、c三种物质分别加入到盛有50克水的烧杯中时,50克水最多溶解的a、b、c分别为25克、19克、不足10克;c物质的溶解度随温度的升高而减小,可通过加溶质、蒸发溶剂或升高温度的方法将其变成饱和溶液。
一、选择题
1.(2014·广安)甲、乙两物质的溶解度曲线如图所示,下列说法不正确的是()
A.t1℃时,甲和乙的溶解度相等
B.甲和乙的溶解度都随温度的升高而增大
C.t1℃时,甲和乙各30g分别加入90g水中,均能完全溶解
D.t2℃时,在100g水中放入60g甲,形成饱和溶液
2.(2014·遂宁)甲、乙两种固体物质的溶解度曲线如图所示。
下列说法正确的是()
A.甲的溶解度比乙大
B.20℃时,50g水中最多能溶解30g甲
C.t℃时,甲、乙两物质的饱和溶液的溶质质量分数相等
D.将45℃时甲、乙的饱和溶液分别降温到t℃时,两溶液均会析出晶体
3.根据某物质在不同质量的水中达到饱和状态时所溶解物质的质量,绘制成如图中的斜线。
下列说法正确的是()
A.该物质的溶解度随温度的升高而增大
B.t℃时该物质的溶解度为40
C.G点表示溶液中溶质的质量分数为20%
D.图中4个点表示的溶液中溶质质量分数的关系是:
G<M<W=Z
4.(2014·安徽)甲、乙两种物质的溶解度曲线如图。
t1℃时,在两支试管中分别加入等质量的两种物质,再分别加入等量的蒸馏水,充分振荡后,试管底部均有未溶解的固体。
再将两支试管升温到t2℃(不考虑溶剂质量变化)。
由t1℃到t2℃的过程中,下列说法正确的是()
A.甲溶液中溶质的质量分数减小B.装有乙物质的试管中剩余的固体增多
C.甲、乙两种物质的溶解度都增大D.两支试管里剩余的固体质量相同
5.(2013·安徽)如图表示某物质在水(a)和酒精(b)中的溶解度曲线。
下列有关该物质的说法正确的是()
A.在水和酒精中的溶解度相同
B.在水和酒精中的溶解度都随温度的升高而增大
C.20℃时,其水溶液比其酒精溶液的溶质质量分数大
D.40℃时,其水溶液的溶质质量分数为38%
6.(2013·连云港)图1是甲、乙两种固体物质的溶解度曲线,图2是盛水的烧杯中放着t2℃时甲、乙两种物质饱和溶液的试管(不考虑溶剂的蒸发),根据图像和有关信息判断,下列说法中错误的是()
A.t2℃时,甲、乙两种物质的饱和溶液中溶质的质量分数大小关系为:
甲>乙
B.将甲、乙两种物质的饱和溶液都从t2℃降至t1℃时,两种溶液中溶质的质量分数相等
C.向烧杯中的水加NaOH固体后,只有乙溶液中溶质的质量分数变小
D.向烧杯中的水加NH4NO3固体后,只有盛放甲溶液的试管中有晶体析出
二、填空题
7.(2014·衡阳)如图是a、b、c三种固体物质的溶解度曲线。
据图回答下列问题。
(1)P点表示的含义是__________________________________________。
(2)将相同质量t2℃时的a、b、c饱和溶液的温度降低到t1℃,析出晶体最多的是______。
(3)将t1℃时的a、b、c饱和溶液温度升高到t2℃时,溶质质量分数最大的是______。
8.(2014·重庆)下表是NaCl、KNO3在不同温度时的溶解度。
温度/℃
0
20
40
60
80
溶解
度/g
NaCl
35.7
36.0
36.6
37.3
38.4
KNO3
13.3
31.6
63.9
110
169
(1)若要比较KNO3与NaCl在水中的溶解能力,需要控制的变量是水的质量和______。
(2)20℃时,各取NaCl、KNO3固体3.5g分别加入10g水中,充分溶解后达到饱和状态的是______溶液。
(3)若将上表数据在坐标系中绘制成NaCl和KNO3的溶解度曲线,两条曲线的交点对应的温度范围是______(填序号)。
A.0℃~20℃B.20℃~40℃C.40℃~60℃D.60℃~80℃
9.(2013·东营)20℃时,将等质量的甲、乙两种固体物质分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2,甲、乙两种物质的溶解度曲线如图3。
请结合图示回答下列问题:
(1)图1中一定为饱和溶液的是______。
(2)图2中甲、乙两溶液中溶质质量分数的大小关系为______。
(3)图3中表示乙的溶解度曲线是N;P点表示的含义是______________________________。
三、实验探究题
10.(2014·泰安)KNO3和NaCl在不同温度时的溶解度如表所示。
请回答下列问题:
温度/℃
溶解度/g
KNO3
NaCl
0
13.3
35.7
10
20.9
35.8
20
31.6
36.0
30
45.8
36.3
40
63.9
36.6
50
85.5
37.0
60
110
37.3
70
138
37.8
(1)依据表中数据,绘制出KNO3和NaCl的溶解度曲线如图所示,图中能表示KNO3溶解度曲线的是______(填“A”或“B”);
(2)由表中数据分析可知,KNO3和NaCl在某一温度时具有相同的溶解度,则温度的范围是______;
(3)某兴趣小组做了以下实验:
上述实验过程中得到的溶液一定属于不饱和溶液的是______(填数字序号),将⑤继续冷却至10℃,过滤,共可回收得到KNO3固体______g;
(4)硝酸钾中含有少量氯化钠时,可通过______(填“蒸发结晶”或“降温结晶”)的方法提纯。
参考答案
归类例析
例1D
例2
(1)t1
(2)CB(3)D
专题精练
1.C2.C3.D4.B5.B6.B7.
(1)在t1℃时,a、c两种物质的溶解度都是20克
(2)a(3)b8.
(1)温度
(2)KNO3(或硝酸钾)(3)B9.
(1)甲
(2)相等(或甲=乙)(3)30℃时,甲、乙两种固体物质的溶解度相等
10.
(1)A
(2)20℃~30℃(3)①③④59.1(4)降温结晶