硅.docx
《硅.docx》由会员分享,可在线阅读,更多相关《硅.docx(14页珍藏版)》请在冰豆网上搜索。
硅
碳、硅及其化合物
【知识梳理】
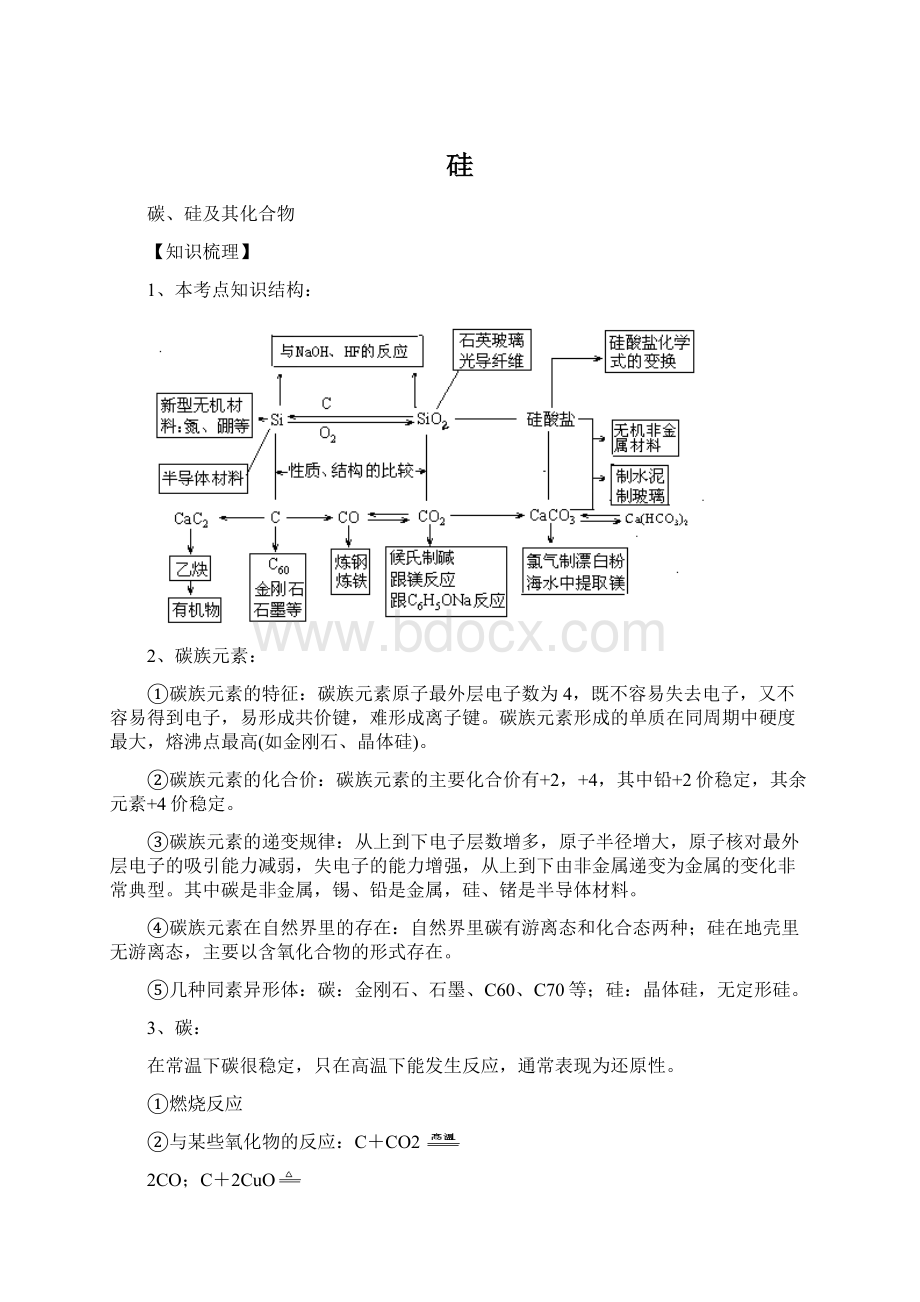
1、本考点知识结构:
2、碳族元素:
①碳族元素的特征:
碳族元素原子最外层电子数为4,既不容易失去电子,又不容易得到电子,易形成共价键,难形成离子键。
碳族元素形成的单质在同周期中硬度最大,熔沸点最高(如金刚石、晶体硅)。
②碳族元素的化合价:
碳族元素的主要化合价有+2,+4,其中铅+2价稳定,其余元素+4价稳定。
③碳族元素的递变规律:
从上到下电子层数增多,原子半径增大,原子核对最外层电子的吸引能力减弱,失电子的能力增强,从上到下由非金属递变为金属的变化非常典型。
其中碳是非金属,锡、铅是金属,硅、锗是半导体材料。
④碳族元素在自然界里的存在:
自然界里碳有游离态和化合态两种;硅在地壳里无游离态,主要以含氧化合物的形式存在。
⑤几种同素异形体:
碳:
金刚石、石墨、C60、C70等;硅:
晶体硅,无定形硅。
3、碳:
在常温下碳很稳定,只在高温下能发生反应,通常表现为还原性。
①燃烧反应
②与某些氧化物的反应:
C+CO2
2CO;C+2CuO
CO2↑+2Cu;
C+H2O
CO+H2O(CO、H2的混合气体叫水煤气);
2C+SiO2
Si+2CO↑
③与氧化性酸反应:
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O;
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
4、一氧化碳:
不溶于水,有毒(CO和血红蛋白结合,使血红蛋白无法和O2结合,而使细胞缺氧引起中毒),但由于CO无色无味因此具有更大的危险性。
①可燃性
②还原性:
CO+CuO
CO2+Cu,CO+H2O(g)
CO2+H2O
5、二氧化碳:
直线型(O=C=O)非极性分子,无色能溶于水,密度大于空气,可倾倒,易液化。
固态CO2俗称干冰,能升华,常用于人工降雨。
实验室制法:
CaCO3+2HCl=CaCl2+CO2↑+H2O。
①酸性氧化物一—酸酐
Ca(OH)2+CO2=CaCO3↓+H2O(用于检验CO2)
②氧化性:
CO2+C
2CO;2Mg+CO2
2MgO+C
6、碳酸盐:
①溶解性:
Ca(HCO3)2>CaCO3;Na2CO3>NaHCO3。
②热稳定性:
Na2CO3>CaCO3;碱金属正盐>碱金属酸式盐:
Na2CO3>NaHCO3。
③相互转化:
碳酸正盐
碳酸酸式盐(除杂用)
7、硅:
①硅在地壳中只有化合态,没有游离态。
其含量在地壳中居第二,仅次于氧,是构成矿物和岩石的主要成分。
②晶体硅是灰黑色,有金属光泽,硬而脆的固体,是半导体,具有较高的硬度和熔点。
③硅的化学性质不活泼,常温下,只能与氟气、氢氟酸及强碱溶液反应:
Si+2F2=SiF4、Si+4HF=SiF4+2H2↑、Si+2NaOH+H2O=Na2SiO3+2H2↑;在加热条件下,能与氧气、氯气等少数非金属单质化合:
Si+O2
SiO2。
④制备:
在电炉里用碳还原二氧化硅先制得粗硅:
SiO2+2C
Si+2CO↑,将制得的粗硅,再与C12反应后,蒸馏出SiCl4,然后用H2还原SiCl4可得到纯硅。
有关的反应为:
Si十2C12
SiCl4、SiCl4+2H2
Si+4HCl。
⑤硅在高新技术中的应用:
高纯硅可作半导体材料,晶体硅还可做光电转换材料及制作DNA芯片为代表的生物工程芯片。
8、二氧化硅:
①SiO2为原子晶体,是一种坚硬难熔的固体,硬度、熔点都很高。
而CO2通常状况下是气体,固体熔点很低。
其差别在于晶体类型不同。
CO2是分子晶体,故熔点很低。
②二氧化硅的化学性质很稳定,不能跟酸(氢氟酸除外)发生反应。
由于它是一种酸性氧化物,所以能跟碱性氧化物或强碱反应。
SiO2+CaOCaSiO3、SiO2+2NaOH=Na2SiO3+H2O(碱溶液不能在使用磨口玻璃塞的试剂瓶中)。
③二氧化硅是一种特殊的酸性氧化物。
a.酸性氧化物大都能直接跟水化合生成酸,但二氧化硅却不能直接跟水化合,它的对应水化物(硅酸)只能用相应的可溶性硅酸盐跟盐酸作用制得:
首先让SiO2和NaOH(或Na2CO3)在熔化条件下反应生成相应的硅酸钠:
SiO2+2NaOH
Na2SiO3+H2O,SiO2+Na2CO3
Na2SiO3+CO2,然后用酸与硅酸钠作用制得硅酸:
Na2SiO3+2HCl===H2SiO3+2NaCl。
b.酸性氧化物一般不跟酸作用,但二氧化硅却能跟氢氟酸起反应:
SiO2+4HF=SiF4+2H2O(氢氟酸不能盛放在玻璃容器中)。
④光导纤维:
从高纯度的SiO2或石英玻璃熔融体中,拉出的直径约100μm的细丝,称为石英玻璃纤维,这种纤维称为光导纤维。
光纤通信是一种新技术,它将光信号在光导纤维中进行全反射传播,取代了电信号在铜线中的传播,达到两地通信的目的。
光纤通信优点:
信息传输量大,每根光缆可同时通过10亿路电话;原料来源广;质量轻,每千米27克;不怕腐蚀,铺设方便;抗电磁干扰,保密性好。
⑤石英、水晶及其压电效应
石英的主要成分是SiO2,可用来制造石英玻璃。
石英晶体中有时含有其他元素的化合物,它们以溶解状态存在于石英中,呈各种颜色。
。
纯净的SiO2晶体叫做水晶,它是六方柱状的透明晶体,是较贵重的宝石。
水晶或石英在受压时能产生一定的电场,这种现象被称为“压电效应”。
后来这种“压电效应”被应用在电子工业及钟表工业和超声技术上。
。
9、硅酸和硅胶:
①硅酸:
硅酸有多种形式,如H4SiO4、H2SiO3、H2Si2O5等。
一般用通式xSiO2·yH2O表示,由于“H2SiO3”分子式最简单,习惯采用H2SiO3作为硅酸的代表。
②硅酸酸性比碳酸还弱,由下列反应可证明:
Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3
③硅胶:
刚制得的硅酸是单个小分子,能溶于水,在存放过程中,它会逐渐失水聚合,形成各种多硅酸,接着就形成不溶于水,但又暂不从水中沉淀出来的“硅溶胶”。
如果向硅溶胶中加入电解质,则它会失水转为“硅凝胶”。
把硅凝胶烘干可得到“硅胶”。
烘干的硅胶是一种多孔性物质,具有良好的吸水性。
而且吸水后还能烘干重复使用,所以在实验室中常把硅胶作为作为干燥剂。
10、硅及其化合物的“反常”
①Si的还原性大于C,但C却能在高温下还原出Si:
SiO2+2C
Si+2CO↑
②非金属单质跟碱液作用一般无H2放出,但Si却放出H2:
Si+2NaOH+H2O=Na2SiO3+2H2↑
③非金属单质一般不跟非氧化性酸作用,但Si能与HF作用:
Si+4HF=SiF4+2H2↑
④非金属单质大多为非导体,但Si为半导体。
⑤SiO2是H2SiO3的酸酐,但它不溶于水,不能直接将它与水作用制备H2SiO3。
⑥酸性氧化物一般不与酸作用,但SiO2能跟HF作用:
SiO2+4HF=SiF4+2H2O
⑦无机酸一般易溶于水,但H2SiO3难溶于水。
⑧因H2CO3的酸性大于H2SiO3,所以在Na2SiO3溶液中通人CO2能发生下列反应:
Na2SiO3+CO2+
H2O=H2SiO3↓+Na2CO3,但在高温下SiO2+Na2CO3
Na2SiO3+CO2↑也能发生。
⑨Na2SiO3的水溶液称水玻璃,但它与玻璃的成分大不相同,硅酸钠水溶液(即水玻璃)称泡花碱,但它却是盐的溶液,并不是碱溶液。
11、硅酸盐:
①硅酸盐是构成地壳岩石的主要成分,其结构复杂,组成可用氧化物的形式表示。
例如:
硅酸钠Na2SiO3(Na2O·SiO2);镁橄榄石Mg2SiO4(2MgO·SiO2);高岭石Al2(Si2O5)(OH)4(A12O3·2SiO2·2H2O)
②云母、滑石、石棉、高岭石等,它们都属于天然的硅酸盐。
③人造硅酸盐:
主要有玻璃、水泥、各种陶瓷、砖瓦、耐火砖、水玻璃以及某些分子筛等。
④硅酸盐制品性质稳定,熔点较高,难溶于水,有很广泛的用途。
最简单硅酸盐是硅酸钠,其水溶液俗称水玻璃,是一种矿物胶,可作粘合剂,防腐剂。
12、水泥、玻璃、陶瓷:
①普通水泥的主要成分是硅酸三钙(3CaO·SiO2)、硅酸二钙(2CaO·SiO2)和铝酸三钙(3CaO·Al2O3),水泥具有水硬性,水泥、沙子和碎石的混合物叫混凝土。
②制玻璃的主要原料是纯碱、石灰石和石英,主要反应是:
SiO2+Na2CO3
Na2SiO3+CO2↑、SiO2+CaCO3
CaSiO3+CO2↑,玻璃是无固定熔点的混合物。
加入氧化钴后的玻璃呈蓝色,加入氧化亚铜后的玻璃呈红色,普通玻璃一般呈淡绿色,这是因为原料中混有二价铁的缘故。
③制造陶瓷的主要原料是黏土,黏土的主要成分:
Al2O3·2SiO2·2H2O。
13、无机非金属材料:
无机非金属材料包含除传统陶瓷外的各种性能优异的精细陶瓷:
耐高温的二氧化锆(ZrO2)陶瓷、高熔点的氮化硅(Si3N4)和碳化硅(SiC)陶瓷;透明的氧化铝、砷化镓(GaAs)、硫化锌(ZnS)、硒化锌(ZnSe)、氟化镁(MgF2)、氟化钙(CaF2)等氧化物或非氧化物陶瓷;生物陶瓷;超细微粉体粒子制造的纳米陶瓷等。
【实例分析】
【例1】(2010全国卷1)下面关于SiO2晶体网状结构的叙述正确的是
A.存在四面体结构单元,O处于中心,Si处于4个顶角
B.最小的环上,有3个Si原子和3个O原子
C.最小的环上,Si和O原子数之比为1:
2
D.最小的环上,有6个Si原子和6个O原子
【解析】二氧化硅是原子晶体,结构为空间网状,存在硅氧四面体结构,硅处于中心,氧处于4个顶角所以A项错误;在SiO2晶体中,每6个Si和6个O形成一个12元环(最小环),所以D对,B、C都错误!
【答案】D
【命题意图】考查学生的空间想象能力,和信息迁移能力,实际上第三册课本第一单元里面有结构图!
【点评】怎样理解SiO2的结构,可从晶体硅进行转化,晶体硅与金刚石结构相似,只需将C原子换成Si原子即可,课本上有我直接拿来用,再将Si-Si键断开,加入氧即可,见:
但是若将题目中B、B、D三个选项前面分别加上“平均每个”,则本题的答案就又变了,这时就要应用均摊法了,由于每个Si原子被12个环所共用,每个O原子被6个环所共用,每个Si-O键被6个环所共用,则均摊之后在每个环上含有0.5个Si,1个O,2个Si-O键,此时则B、D错误,C正确了,也即在1molSiO2中含有4molSi-O键(这是我们经常考的)。
【例2】(江苏省扬州市2010届高三四模)多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环境污染很大,能遇水强烈水解,放出大量的热。
研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成份为BaCO3,且含有钙、铁、镁等离子)制备BaCl2·2H2O,工艺流程如下。
已知常温下Fe3+、Mg2+完全沉淀的pH分别是:
3.4、12.4。
(1)SiCl4水解控制在40℃以下的原因是。
已知:
SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g)ΔH1=47kJ/mol
SiHCl3(s)+H2(g)=Si(s)+3HCl(g)ΔH2=189kJ/mol
则由SiCl4制备硅的热化学方程式为。
(2)加钡矿粉时生成BaCl2的离子反应方程式是。
(3)加20%NaOH调节pH=12.5,得到滤渣A的主要成分是,控制温度70℃的目的是。
(4)BaCl2滤液经蒸发浓缩、降温结晶、过滤,再经真空干燥后得到·2H2O。
实验室中蒸发浓缩用到的含硅酸盐的仪器有种。
(5)为体现该工艺的绿色化学思想,该工艺中能循环利用的物质是。
【答案】
(1)防止HCl挥发污染环境或控制SiCl4的水解速率,防止反应过于剧烈。
SiCl4(s)+2H2(g)=Si(s)+4HCl(g)ΔH=236kJ/mol(4分)
(2)BaCO3+2H+=Ba2++CO2+H2O↑(2分)
(3)Mg(OH)2、Ca(OH)2,
确保钙离子完全除去(或温度越高,Ca(OH)2溶解度越小)。
(2分)
(4)3(2分)
(5)BaCl2溶液(2分)
【一课一练】
一、选择题(本题包括12小题,每小题4分,共48分)
1.(浙江省绍兴一中2010届高三上学期期末调研)2009年10月6日,瑞典皇家科学院宣布,将2009年物理诺贝尔奖授予英籍华裔科学家高锟,表彰他在“有关光在纤维中的传输以用于光学通信方面”取得的突破性成就。
光导纤维的主要成分是()
A.SiB.SiO2C.H2SiO3D.Na2SiO3
2.(山东省聊城一中2010届高三期末考试)氮化硅(SiN4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
3SiO2+6C+2N2Si3N4+6CO。
下列叙述正确的是()
A.在氮化硅的合成反应中,N2是还原剂,SiO2是氧化剂
B.上述反应中每生成1molSi3N4,N2得到12mol是电子
C.若已知上述反应为放热反应,升高温度,其平衡常数增大
D.若使压强增大,上述平衡向正反应方向移动
3.(河南省内乡一高2010届高三第一次月考)制取下列物质时,不需用石灰石作原料的是( )
A.硅酸 B.水泥 C.玻璃 D.生石灰
4.(2010山东卷13)下列推断正确的是
A.SiO2是酸性氧化物,能与NaOH溶液反应
B.Na2O、Na2O2组成元素相同,与CO2反应产物也相同
C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
5.赛伦的化学通式为Si6-xAlxOxN8-x,以耐高温、高强度、超硬度、耐磨损、抗腐蚀等性能为主要特征,因此,在冶金、机械、光学、医学等领域有重要应用.它属于( )
A.金属材料B.有机高分子材料
C.新型无机非金属材料D.无机高分子材料
解析:
赛伦属于无机物,具备新型无机非金属材料的特征.
6.(2010·东城模拟)下列四种物质中,不能与水发生反应,但能与碱发生反应的是( )
A.Cl2B.CO2C.NOD.SiO2
解析:
A、B项均能与水、碱反应,C项不能与水、与碱反应.
7.(2010·南京模拟)下列有关Na2CO3溶液、Na2SiO3溶液的共同点的描述中不正确的是( )
A.水溶液均显碱性
B.滴入盐酸均有气泡产生
C.均能与CO2反应
D.均不能用带磨口玻璃塞的试剂瓶保存
8.工业制造金刚砂(SiC)的化学方程式如下:
SiO2+3C
SiC+2CO↑.在这个氧化还原反应中,氧化剂和还原剂的物质的量之比是( )
A.3∶5B.1∶2C.2∶1D.1∶1
9.用4种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是( )
选项
操作及现象
溶液
A
通入CO2,溶液不变浑浊.先通入CO2再通入氨气,溶液变浑浊
CaCl2溶液
B
通入CO2,溶液不变浑浊.继续通CO2至过量,浑浊消失
Na2SiO3溶液
C
通入CO2,溶液变浑浊.再加入品红溶液,红色褪去
Ca(ClO)2溶液
D
通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失.再加入足量NaOH溶液,又变浑浊
Ca(OH)2溶液
10.下列离子方程式书写不正确的是()
A.SiO2与烧碱溶液作用:
SiO2+2OH-===SiO
+H2O
B.向烧碱溶液中通入足量CO2:
CO2+OH-===HCO
C.晶体硅与烧碱溶液作用:
Si+2OH-+H2O===SiO
+2H2↑
D.CaCO3溶于稀硝酸中:
CO
+2H+===CO2↑+H2O
11.下列事实中能证明碳的非金属性比硅强的是( )
①往Na2SiO3溶液中通入CO2产生白色沉淀 ②石墨是导体,晶体硅是半导体 ③制
玻璃过程中发生反应:
Na2CO3+SiO2
Na2SiO3+CO2↑ ④CH4比SiH4稳定
A.①④B.②③C.③④D.①②
12.(2010·海淀模拟)北京奥运金牌“金玉合璧”(如图)上的环形玉是产自新疆的和田玉,和田玉是一种具有链状结构的含水钙镁硅酸盐.某种和田玉的化学成分为Ca2Mg3Fe2(Si4O11)2(OH)2,下列有关叙述中正确的是( )
A.将该和田玉的化学式改写成氧化物的形式表示如下:
2CaO·3MgO·Fe2O3·8SiO2·H2O
B.该和田玉能抵抗任何酸或碱的腐蚀
C.该和田玉中Fe的化合价为+2价
D.该和田玉是由5种氧化物组成的混合物
1~3BBA
4.【解析】酸性氧化物能够跟碱反应,生成盐和水的氧化物,故A正确,因为2NaOH+SiO2=Na2SiO3+H2O,Na2O与CO2反应生成Na2CO3,Na2O2与CO2反应除生成Na2CO3外,还生成O2,故B错;NO在空气中会发生反应2NO+O2=NO2,故C错;因为新制氯水中含有HClO,故滴入少量的紫色石蕊的现象是先变红,后褪色,故D错。
【答案】A
5.C6.D
7.【解析】二者水解均呈碱性,故A、D正确,均能与CO2反应生成NaHCO3、H2SiO3,
B项Na2SiO3与盐酸反应生成H2SiO3,不能放出气泡.
【答案】B
8.【解析】在该反应中,3molC参加化学反应,生成1mol的Si
和2mol的
O,所以氧化剂与还原剂均为C,且物质的量之比为1∶2,B正确.
【答案】B
9.【解析】A项CaCl2溶液不与CO2反应,但通入NH3后溶液变为(NH4)2CO3可产生浑浊;
B项H2SiO3沉淀不溶于过量的CO2;C项生成的HClO漂白品红;D项CaCO3
Ca(HCO3)2
CaCO3.
【答案】B
10.【解析】SiO2与CO2均具有酸性氧化物的性质,均能与碱作用生成盐和水,但CO2过量时生成碳酸氢盐,故A、B正确;单质硅能与NaOH溶液作用生成Na2SiO3同时放出H2,C正确;D项中CaCO3难溶于水,应写化学式,D错误.
【答案】D
11.【解析】①说明酸性H2CO3>H2SiO3;②③不能说明碳比硅的非金属性强.
【答案】A
12.【解析】A项应为2CaO·3MgO·2FeO·8SiO2·H2O,B项HF与之可反应,D项属于纯净物。
【答案】C
二、非选择题
13.(12分)A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如图所示,A
为地壳中含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似.
请填空:
(1)形成单质A的原子的结构示意图为________,它的最高化合价为________价.
(2)B的化学式(分子式)为________,B的晶体类型为____________,B和碳反应生成A
和E的化学方程式是__________________________________________________
________________________________________________________________________
(3)C的化学式(分子式)为________,D的化学式(分子式)为________.
【解析】根据“A为地壳中含量仅次于氧的非金属元素的单质”可确定A是Si单质,它可由SiO2和C在高温条件下反应制取.
【答案】
(1)
(2)SiO2 原子晶体 SiO2+2C高温,Si+2CO↑
(3)CaSiO3 Na2SiO3
14.(14分)含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱溶液反应生成含A元素的化合物D.
(1)在元素周期表中,A位于__________族,与A同族但相对原子质量比A小的元素B的原子结构示意图为________,A与B在原子的电子层结构上的相同点是__________________________.
(2)易与C发生化学反应的酸是________,反应的化学方程式是_____________________.
(3)将C与纯碱混合高温熔融时也发生化学反应生成D.同时还生成B的最高价氧化物
E;将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物
F.
①写出生成D和F的化学方程式:
_____________________________________
________________________________________________________________________.
②要将纯碱高温熔化,下列坩埚中不可选用的是________.
A.普通玻璃坩埚B.石英玻璃坩埚
C.氧化铝坩锅D.铁坩锅
(4)100gC与石灰石的混合物充分反应后,生成的气体在标准状况下的体积为11.2
L,100g混合物中石灰石的质量分数是______.
【解析】
(1)A元素单质可做半导体材料,含A元素的某化合物是制造光导纤维的原料,
可知A为硅元素,比硅相对原子质量小的同族元素为碳.
(2)C为SiO2,能与SiO2反应的酸只有氢氟酸.
(3)SiO2与Na2CO3高温下反应生成Na2SiO3和CO2,故含SiO2的材料、普通玻璃、石
英玻璃以及Al2O3等都能与Na2CO3在高温下反应,故不能用以上材质的坩埚熔融
Na2CO3.
(4)若SiO2恰好或过量,与CaCO3反应方程式只有一个,即CaCO3+SiO2
CaSiO3
+CO2↑.
若CaCO3过量,除发生上述反应外,还会发生反应:
CaCO3
CaO+CO2↑.总之,
CaCO3的多少决定了CO2的产量,可通过以下关系式列式求解:
CaCO3~CO2
=
,m(CaCO3)=50g.
混合物中CaCO3的质量分数:
×100%=50%.
【答案】
(1)ⅣA 最外层均有4个电子,最内层均有2个电子
(2)氢氟酸 SiO2+4HF===SiF4↑+2H2O
(3)①SiO2+Na2CO3
Na2SiO3+CO2↑
Na2SiO3+CO2+H2O===Na2CO3+H2SiO3↓
②ABC (4)50%