新药CRF.docx
《新药CRF.docx》由会员分享,可在线阅读,更多相关《新药CRF.docx(19页珍藏版)》请在冰豆网上搜索。
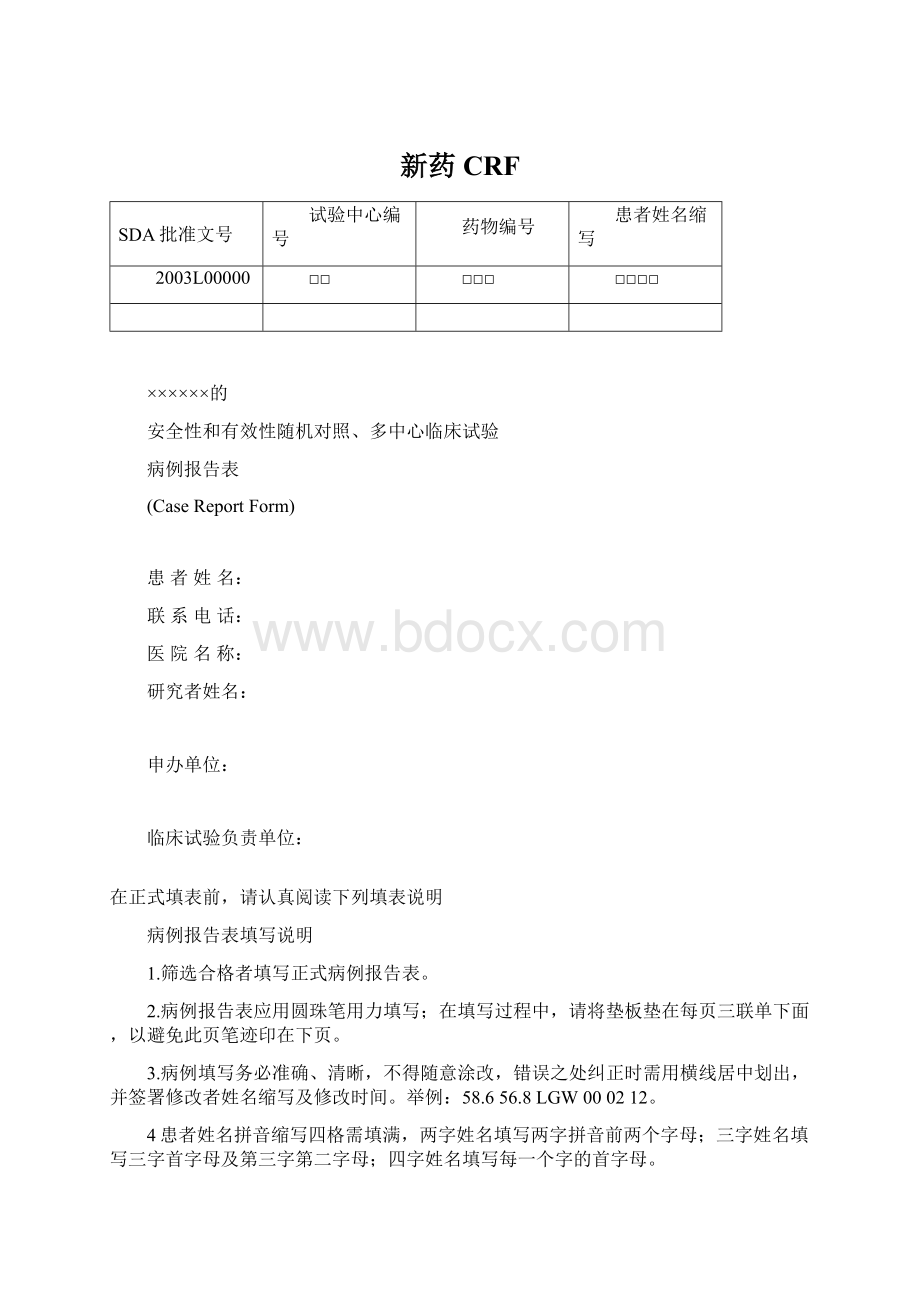
新药CRF
SDA批准文号
试验中心编号
药物编号
患者姓名缩写
2003L00000
□□
□□□
□□□□
××××××的
安全性和有效性随机对照、多中心临床试验
病例报告表
(CaseReportForm)
患者姓名:
联系电话:
医院名称:
研究者姓名:
申办单位:
临床试验负责单位:
在正式填表前,请认真阅读下列填表说明
病例报告表填写说明
1.筛选合格者填写正式病例报告表。
2.病例报告表应用圆珠笔用力填写;在填写过程中,请将垫板垫在每页三联单下面,以避免此页笔迹印在下页。
3.病例填写务必准确、清晰,不得随意涂改,错误之处纠正时需用横线居中划出,并签署修改者姓名缩写及修改时间。
举例:
58.656.8LGW000212。
4患者姓名拼音缩写四格需填满,两字姓名填写两字拼音前两个字母;三字姓名填写三字首字母及第三字第二字母;四字姓名填写每一个字的首字母。
举例:
张红
Z
H
H
O
李淑明
L
S
M
I
欧阳小惠
O
Y
X
H
5.所有选择项目的□内用√标注。
如:
√。
表格中所有栏目均应填写相应的文字或数字,不得留空。
如果此项“未做”则填入“ND”,“不知道”则填入“UK”,“不能提供”或“不适用”,则填入“NA”。
6.各实验室检查的检查报告、化验单均应贴在病例报告表的最后附页上。
7.试验期间应如实填写不良事件记录表。
记录不良事件的发生时间、严重程度、持续时间、采取的措施和转归。
如有严重不良事件发生(包括临床试验过程中发生需住院治疗、延长住院时间、伤残、影响工作能力、危及生命或死亡、导致先天畸形等事件),必须立即通知主要研究单位××××××、申办者××××××。
单位
联系人
联系电话
传真
国家药品监督管理局安全监管司药品研究监督处
(010)68313344-1013
(发生严重不良事件时需在24小时以内上报有关单位)
8.临床试验应严格按照临床试验方案要求进行。
试验不同时期需完成的检查和需记录的项目,请对照临床研究流程图执行。
×××××的
安全性和有效性随机对照、多中心
临床试验流程图
阶段
入选
研究期
访视
第一次
第二次
天数
0天
3+?
天
基本情况采集
签署知情同意书
√
入选/排除病例
√
人口学资料
√
病史采集
√
既往治疗史
√
合并用药
√
√
有效性观察
临床症状分级记分
√
√
发日记卡
√
收日记卡
√
安全性观察
血压、心率、呼吸
√
√
血、尿、便常规,肝、肾功
√
√
心电图检查
√
√
记录不良事件
√
其他工作
随机分组
√
发放药物
√
药品数量统计
√
注:
随访仅用于患者发生了与药物有关的不良事件或有临床意义的异常实验改变时
SDA批准文号
试验中心编号
药物编号
患者姓名拼音字母
知情同意书
2003L00000
□□
□□□
□□□□
×××××治疗×××临床研究
患者知情同意书
尊敬的患者:
我们邀请您参加一项治疗×××××药×××××新药临床研究。
×××××由×××××研制,是一种新的局部尿道止痛药。
用于治疗尿道感染等原因引起的尿痛及伴发的尿急、尿频等。
经国家药品监督管理局批准[批准文号:
2003L00000],并经研究负责单位(×××××)医学伦理学委员会对临床试验方案进行审查,同意进行临床研究。
如果您决定参加本研究,医生将检查您是否符合参加本研究的条件,询问您的健康情况和有关疾病情况,医生还将对您进行相应的体格检查,包括血、尿、便常规,肝、肾功、心电图等。
如果您符合入选条件,您将随机被分配到两个不同的研究组中,免费使用临床研究药物×××××;或免费使用对照安慰剂。
在您服药过程中,请您按医生要求提供临床需要记录的有关信息。
疗程结束后,请您主动复诊,并请将药盒(不管是否服完全部药物)带来交给您的医生,医生将询问您的健康与治疗情况如果您完全自愿参加本研究,我们希望您能坚持服药,以协助我们完成本项研究任务。
如果您在任何时候因任何原因退出本研究,请与您的医生联系,并完成最后一次就诊时所要求回答的问题,以便医生能完成最后一次就诊要求的所有检查项目。
如果您决定退出本试验将不会影响您与医生的关系,医生将根据您的病情和患者至上的原则对您进行其它合理治疗。
您在自愿参加临床研究过程中,无论服药治疗药物或对照药物,将可能使您的病情得到改善。
但在极少数情况下,也可能会出现一些不良反应如头痛、眩晕、皮疹、骚痒、胃肠道不适及过敏反应。
以上不良反应发生率极低,如果出现,我们将予以及时、相应的治疗。
如出现严重不良反应(但这种不良反应必须与本临床研究有关),可与申办单位协商解决。
我们将对您身份的记录完全保密,只有您的医生清楚。
您的有关资料将记录在病例报告表上。
您的姓名不会出现在任何研究报告和公开出版物中。
我已阅读了患者知情同意书,并得到了医生完整的解释,因此,我自愿参加本研究,我也同意有关方面对照我的原始医疗记录核对收集资料,并愿意按要求与研究者合作完成本研究。
受试者签名:
年月日
研究者签字:
年月日
见证人签字:
年月日
第1页
SDA批准文号
试验中心号
药物编号
患者姓名拼音字母
就诊日期
访视一
病例入组
2003L00000
□□
□□□
□□□□
|_|_|_|_|/|_|_|/|_|_|
年月日
入选标准
是
否
1自愿作为受试对象,签署知情同意书。
□
□
2年龄18~65岁的病人;
□
□
3符合临床研究方案规定的纳入标准者;
□
□
如以上任何一个答案为“否”,此受试者不能参加试验
排除标准
是
否
1年龄:
在18岁以下或65岁以上者;
□
□
2不符合临床研究方案规定的纳入标准者;
□
□
3合并有心、脑、肝、肾和造血系统疾病及精神病患者;
□
□
4妊娠、哺乳期妇女、过敏体质者;
□
□
5已知对该类药物过敏者;
□
□
6参加其它临床试验者或研究者认为不宜参加本试验者;
□
□
7就诊前24小时内用过其它解痉镇痛药物者。
□
□
如以上任何一个答案为“是”,此受试者不能参加试验
接诊医生签名:
签名日期:
年___月___日
第2页
SDA批准文号
试验中心号
药物编号
患者姓名拼音字母
就诊日期
访视一
病例入组
2003L00000
□□
□□□
□□□□
|_|_|_|_|/|_|_|/|_|_|
知情同意书签署情况
患者是否已经签署了患者知情同意书?
□是□否签署时间:
|_|_|_|_|/|_|_|/|_|_|(年/月/日)
人口学资料
出生日期|_|_|_|_|/|_|_|/|_|_|(年/月/日)性别:
男□女□
身高|_|_|_|cm体重|_|_|_|.|_|kg血压|_|_|_|/|_|_|_|mmHg
体温|_|_|.|_|℃心率|_|_|_|次/分呼吸|_|_|_|次/分
既往病史
诊断为尿路感染无□有□如有,病程:
|_|_|.|_|天
对尿路感染的治疗无□有□如有,请在下面记录:
药物名称
剂量和用法
开始日期
年/月/日
停药日期
年/月/日
疗效
治愈/显效/有效/无效
//
//
□□□□
//
//
□□□□
//
//
□□□□
//
//
□□□□
其它病史:
其它病史:
无□有□如有,请在下面记录:
疾病名称
开始日期
年/月/日
痊愈日期
年/月/日
未
愈
疾病详情
(如正在治疗,请填写合并用药表)
//
//
□
//
//
□
//
//
□
//
//
□
//
//
□
接诊医生签名:
签名日期:
年___月___日
第3页
SDA批准文号
试验中心号
药物编号
患者姓名拼音字母
就诊日期
访视一
病例入组
2003L00000
□□
□□□
□□□□
|_|_|_|_|/|_|_|/|_|_|
临床症状分级记分
尿痛
□0级:
无痛
□1级(轻度):
虽有疼痛但可以忍受,能正常生活,睡眠不受干扰。
□2级(中度):
疼痛明显,不能忍受,要求服用止痛剂,睡眠受干扰。
□3级(重度):
疼痛剧烈,不能忍受,需要服用止痛剂,睡眠受干扰,可伴随有植物
神经紊乱或被动体位。
尿频:
24小时排尿次
尿急
□—正常无症状
□+Ⅰ××××
□++Ⅱ××××
□+++Ⅲ××××
接诊医生签名:
签名日期:
年___月___日
第4页
SDA批准文号
试验中心号
药物编号
患者姓名拼音字母
就诊日期
访视一
病例入组
2003L00000
□□
□□□
□□□□
|_|_|_|_|/|_|_|/|_|_|
实验室检查
指标
测定值
单位
临床意义判定*
1234
血常规检查日期:
年月日
血红蛋白
g/L
□□□□
红细胞
×1012/L
□□□□
白细胞
×109/L
□□□□
血小板
g/L
□□□□
尿常规检查日期:
年月日
Protein
(-)
□□□□
Glucose
(-)
□□□□
RBC
/HP
□□□□
WBC
/HP
□□□□
肝肾功血液生化检查日期:
年月日
ALT
IU/L
□□□□
AST
IU/L
□□□□
BUN
mmol/L
□□□□
Cr
umol/L
□□□□
Glu
umol/L
□□□□
ALP
IU/L
□□□□
Na
mmol/L
□□□□
K
umol/L
□□□□
Cl
umol/L
□□□□
Ca
umol/L
□□□□
心电图检查检查日期:
年月日
异常描述:
□□□□
注:
临床意义判定:
(1)正常
(2)异常但无临床意义(3)异常且有临床意义(4)未查
患者注意事项:
1按时服药,如实填写患者日记卡,复诊时带回未服用的药品,患者日记卡。
2约下次访试时间:
年月日。
接诊医生签名:
签名日期:
年___月___日
第5页
SDA批准文号
试验中心号
药物编号
患者姓名拼音字母
就诊日期
访视二
2
2003L00000
□□
□□□
□□□□
|_|_|_|_|/|_|_|/|_|_|
药品收发表
实际发药量:
|_|_|粒+|_|_|片应服药量:
|_|_|粒+|_|_|片返回药量:
|_|_|粒+|_|_|片
依从性计算方法:
服药率=(实际发药量-返回药量)/应服药量×100%=|_|_|_|∙|_|%
如果服药率〈80%或〉120%者,则中止试验
一般资料
受试对象是否中止试验
□否□是,如是,请完成实验室检查并填写试验总结表(第10页)
血压
|_|_|_|/|_|_|_|mmHg
心率
|_|_|_|次/分
呼吸
|_|_|_|次/分
近2天内有无合并用药?
□否□有,如有,请填写合并用药表(第7页)
近2天内有无不良事件发生?
□否□有,如有,请填写不良事件表(第8页)
患者用药后临床症状分级记分
尿痛
□0级:
无痛
□1级(轻度):
虽有疼痛但可以忍受,能正常生活,睡眠不受干扰。
□2级(中度):
疼痛明显,不能忍受,要求服用止痛剂,睡眠受干扰。
□3级(重度):
疼痛剧烈,不能忍受,需要服用止痛剂,睡眠受干扰,可伴随有植物
神经紊乱或被动体位。
尿频:
24小时排尿次
尿急
□—正常无症状
□+Ⅰ尿急但可控制
□++Ⅱ有尿急后稍延迟即尿于裤中
□+++Ⅲ基本不能控制排尿
接诊医生签名:
签名日期:
年___月___日
第6页
SDA批准文号
试验中心号
药物编号
患者姓名拼音字母
就诊日期
访视二
2
2003L00000
□□
□□□
□□□□
|_|_|_|_|/|_|_|/|_|_|
实验室检查
指标
测定值
单位
临床意义判定*
1234
血常规检查日期:
年月日
血红蛋白
g/L
□□□□
红细胞
×1012/L
□□□□
白细胞
×109/L
□□□□
血小板
g/L
□□□□
尿常规检查日期:
年月日
Protein
(-)
□□□□
Glucose
(-)
□□□□
RBC
/HP
□□□□
WBC
/HP
□□□□
肝肾功血液生化检查日期:
年月日
ALT
IU/L
□□□□
AST
IU/L
□□□□
BUN
mmol/L
□□□□
Cr
umol/L
□□□□
Glu
umol/L
□□□□
ALP
IU/L
□□□□
Na
mmol/L
□□□□
K
umol/L
□□□□
Cl
umol/L
□□□□
Ca
umol/L
□□□□
心电图检查检查日期:
年月日
异常描述:
□□□□
注:
临床意义判定:
(1)正常
(2)异常但无临床意义(3)异常且有临床意义(4)未查
患者注意事项:
按时服药,如实填写患者日记卡,复诊时带回未服用的药品,患者日记卡。
接诊医生签名:
签名日期:
年___月___日
第7页
SDA批准文号
试验中心号
药物编号
患者姓名拼音字母
就诊日期
合并
用药
2003L00000
□□
□□□
□□□□
|_|_|_|_|/|_|_|/|_|_|
合并用药(CONCOMITANTMEDICATION)
商品名或通用名
每日总剂量
使用原因
开始日期
(年/月/日)
结束日期(年/月/日)
或未次就诊时仍在使用
_____/__/__
_____/__/__□
_____/__/__
_____/__/__□
_____/__/__
_____/__/__□
_____/__/__
_____/__/__□
_____/__/__
_____/__/__□
_____/__/__
_____/__/__□
_____/__/__
_____/__/__□
_____/__/__
_____/__/__□
_____/__/__
_____/__/__□
_____/__/__
_____/__/__□
_____/__/__
_____/__/__□
_____/__/__
_____/__/__□
_____/__/__
_____/__/__□
_____/__/__
_____/__/__□
_____/__/__
_____/__/__□
_____/__/__
_____/__/__□
_____/__/__
_____/__/__□
_____/__/__
_____/__/__□
_____/__/__
_____/__/__□
_____/__/__
_____/__/__□
_____/__/__
_____/__/__□
_____/__/__
_____/__/__□
_____/__/__
_____/__/__□
_____/__/__
_____/__/__□
接诊医生签名:
签名日期:
年___月___日
第8页
SDA批准文号
试验中心号
药物编号
患者姓名拼音字母
就诊日期
不良
事件
2003L00000
□□
□□□
□□□□
|_|_|_|_|/|_|_|/|_|_|
不良事件(ADVERSEEVENT)
(用标准医学术语)记录所有观察到的和用以下问句“自上次检查后,您有何不同的感觉?
”直接询问得出的不良事件。
尽量使用诊断名称而不使用症状名称。
每一栏记录一个不良事件。
该受试者整个试验期间有无经历任何不良事件?
□有□无如“有”请分别填下表。
不良事件名称
(填写字迹要清晰)
开始发生日期和时间
_______年__月__日
___:
__(24小时制)
_______年__月__日
___:
__(24小时制)
_______年__月__日
___:
__(24小时制)
不良事件严重程度
□轻□中□重
□轻□中□重
□轻□中□重
是否采取措施
(如是,请记录伴随用药和伴随治疗记录表)
□是□否
□是□否
□是□否
对研究药物
的剂量影响
□剂量不变□增加剂量
□减小剂量□暂停用药
□永久停药
□剂量不变□增加剂量
□减小剂量□暂停用药
□永久停药
□剂量不变□增加剂量
□减小剂量□暂停用药
□永久停药
与研究药物的关系
□肯定有关□可能有关
□可能无关□无关
□无法判定
□肯定有关□可能有关
□可能无关□无关
□无法判定
□肯定有关□可能有关
□可能无关□无关
□无法判定
根据研究者的判断是否符合严重不良事件定义?
1.导致死亡.
2.威胁生命.
3.导致住院或延长住院期间.
4.导致持续或严重残疾/能力丧失.
5.导致先天性异常或出生缺陷.
6.重要医学事件(如有可能影响到受试者并有可能需要药物/手术以防止上述结果)
□是□否
(如是,请立即电话/传真报告××××和××××)
报告日期:
__年_月_日
□是□否
(如是,请立即电话/传真报告××××和××××)
报告日期:
__年_月_日
□是□否
(如是,请立即电话/传真报告××××和××××)
报告日期:
__年_月_日
在不良事件终止或研究结束时填写以下部分
所发生不良
事件的结局
□仍存在□已缓解
□不知道
缓解日期:
__年_月_日
□仍存在□已缓解
□不知道
缓解日期:
__年_月_日
□仍存在□已缓解
□不知道
缓解日期:
__年_月_日
患者是否因此不良
事件而退出试验?
□是□否
□是□否
□是□否
接诊医生签名:
签名日期:
年___月___日
第9页
SDA批准文号
试验中心号
药物编号
患者姓名拼音字母
就诊日期
试验
总结
2003L00000
□□
□□□
□□□□
|_|_|_|_|/|_|_|/|_|_|
试验完成情况总结
患者末次用药日期:
|_|_|_|_|/|_|_|/|_|_|年/月/日
该患者试验期间是否有不良事件发生?
□是□否
该患者在试验期间是否被揭盲?
□是□否
患者是否在2天完成了临床试验?
□是□否
如否,请填写以下中止试验原因
患者中止试验日期|_|_|_|_|/|_|_|/|_|_|年/月/日
中止试验的主要原因是:
(选择一个)
不良事件(已填写不良事件表)..................□
缺乏疗效........................................................□
违背试验方案..................................................□
失访..................................................................□
受试者撒回知情同意书..................................□
其它..................................................................□
尿痛:
疗前级疗后级
尿频:
疗前次/24小时疗后次/24小时
尿急:
疗前度疗后度
患者对治疗的感受:
患者主观有无从本研究中受益?
□有受益□没有受益
如果有受益请问患者的受益程度□受益很多□受益很少
接诊医生签名:
签名日期:
年___月___日
CRF审核声明
我证实,由我签名的这位患者的病例报告表的各页已由我检查,并确认所有信息是真实、准确的并符合研究方案的要求。
试验中心负责人(签字):
日期:
年月日
监查员签字:
日期:
年月日
附页
SDA批准文号
试验中心号
药物编号
患者姓名拼音字母
化验单
粘贴页
2003L00000
□□
□□□
□□□□