急性淋巴细胞白血病患儿红血球中6巯基嘌呤及其代谢产物的精.docx
《急性淋巴细胞白血病患儿红血球中6巯基嘌呤及其代谢产物的精.docx》由会员分享,可在线阅读,更多相关《急性淋巴细胞白血病患儿红血球中6巯基嘌呤及其代谢产物的精.docx(11页珍藏版)》请在冰豆网上搜索。
急性淋巴细胞白血病患儿红血球中6巯基嘌呤及其代谢产物的精
急性淋巴细胞白血病患儿红血球中6-巯基嘌呤及其代谢产物的HPLC分析
项目完成人:
牟德海郑家概闫世平辜英杰喻凌寒
项目完成单位:
中国广州分析测试中心广东省化学危害应急检测技术重点实验室
6-巯基嘌呤(6-mercaptopuring,6-MP)和硝基咪唑硫嘌呤(azathiopurine,Aza)主要作为抗肿瘤药用于治疗急性淋巴细胞白血病(acutelymphoblasticleukemia,ALL),或者作为免疫抑制剂用于治疗炎性肠病、风湿关节炎、系统性红斑狼疮和抑制器官移植病人的急性排斥。
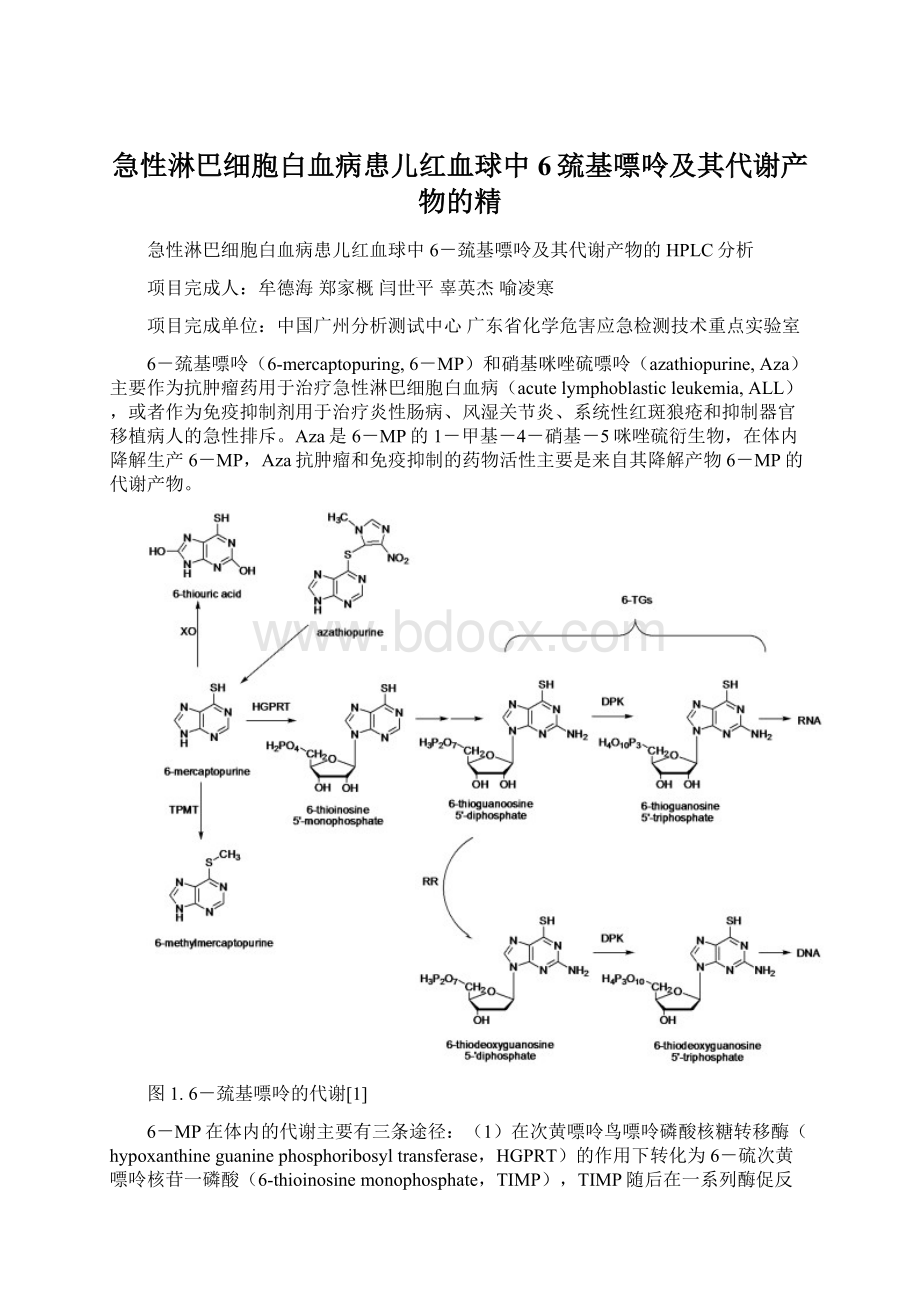
Aza是6-MP的1-甲基-4-硝基-5咪唑硫衍生物,在体内降解生产6-MP,Aza抗肿瘤和免疫抑制的药物活性主要是来自其降解产物6-MP的代谢产物。
图1.6-巯基嘌呤的代谢[1]
6-MP在体内的代谢主要有三条途径:
(1)在次黄嘌呤鸟嘌呤磷酸核糖转移酶(hypoxanthineguaninephosphoribosyltransferase,HGPRT)的作用下转化为6-硫次黄嘌呤核苷一磷酸(6-thioinosinemonophosphate,TIMP),TIMP随后在一系列酶促反应中转化为活性代谢物6-硫鸟嘌呤核苷(6-thioguaninenucleotides,6-TGNs)发挥细胞毒作用;
(2)在硫嘌呤甲基转移酶(thiopurinemethyltransferase,TPMT)作用下转化为无药物活性的甲基硫嘌呤(6-methylmercaptopurine,6-MMP);(3)在黄嘌呤氧化酶(xanthineoxidase,XO)作用下转化为6-硫尿酸(6-thiouricacid,6-TUA)[1],见图1。
与6-MP转化为活性代谢产物性6-TGNs相竞争的有两条途径:
在TPMT作用下转化为6-MMP和在XO作用下转化为6-TUA。
XO活性在个体之间的差异不大,而TPMP活性在不同个体之间有很大的差异。
因而病人对6-MP反应(即药物的疗效和毒性)的差异主要决定于其体内TPMT的活性。
已经发现红细胞中6—TGNs的含量与TPMT的活性呈负相关关系。
在标准用药剂量下,TPMT活性低的个体能积累高浓度的6-TGNs导致致死性的骨髓细胞毒性。
相反TPMT活性高的个体对硫嘌呤类药物可能没有反应,因为它们很快就被转化为无活性的6-MMP。
因而通过监测接受硫嘌呤类药物治疗的病人血红细胞内6-MMP和6-TGNs的水平,据此确定准确的用药剂量,对提高治疗效果、减小药物毒副作用是非常关键的。
在本项目的资助下,我们与广州医学院第一附属医院合作,研究建立了急性淋巴细胞白血病患者红血球中6-MP及其代谢产物的高效液相色谱分析方法,为6-MP个性化治疗提供基础。
1实验
1.1仪器与试剂
6-巯基嘌呤(6-mercaptopurine,6-MP)、6-硫鸟嘌呤(6-thioguanine,6-TG)、6-硫黄嘌呤(6-thioxanthine,6-TX)、6-甲基硫嘌呤(6-methylmercaptopurine,6-MMP)、戊醇、乙酸苯汞(phenylmercuryacetate,PMA)和二硫苏糖醇(DL-dithiothreitol,DTT)为Sigma公司产品;甲醇、甲苯为色谱纯,其他试剂均为分析纯。
高效液相色谱仪:
岛津LC-6A,配LC-6A高压输液泵、柱温箱、SPD-6AV可变波长紫外-可见分光检测器、系统控制器、CR-3A积分仪和色谱工作站。
1.2试剂配制
(1)PMA-戊醇-甲苯溶液的配制:
取1.85mL戊醇,加入1000mL甲苯中,摇匀,再加入0.5gPMA,轻轻搅动1h使PMA溶解,置于暗处保存。
此溶液含PMA1.3mmol/L,含戊醇170mmol/L。
(2)3.75mmol/LDTT水溶液配制:
取289.2mgDTT溶于500mL水中。
(3)0.5mol/LH2SO4。
(4)3.4mol/LNaOH。
(5)0.1mol/LHCl。
1.3标准溶液配制
分别取16.8mg6-TG、16.6mg6-MMP、17.0mg6-TX和17.1mg6-MP溶于水中并定容于100mL,此溶液为贮备液I,含每种硫嘌呤1.00μmol/mL。
取10mL贮备液I,稀释至100mL,为贮备液II,含每种硫嘌呤100nmol/mL;用贮备液II稀释成1nmol/mL、2nmol/mL、5nmol/mL、10nmol/mL、15nmol/mL和20nmol/mL的系列标准溶液备用。
1.4样品处理
(1)血红细胞制备:
采集正在接受硫嘌呤治疗的病人全血样本,肝素锂抗凝,室温下1000×g离心10min,弃去血浆和白血胞,红细胞以2倍体积的生理盐水洗涤两次,最后红细胞重新悬浮于生理盐水中,使红细胞的浓度约为8×108细胞/200μL。
取少量作红细胞的准确计数,其余在-20℃下保存至分析。
(2)样品提取:
200μL血红细胞(约含8×108红细胞)加入有800μL3.75mmol/LDTT的10mL螺旋口试管中,再加入500μL0.5mol/L的H2SO4,盖紧,置于100℃烘箱中水解1h。
在这一步中,硫嘌呤核苷水解转化为相应母体硫嘌呤和甲基硫嘌呤,如6-TGNs水解生成6-TG、6-TIMP水解生成6-MP、6-甲基巯基嘌呤核苷转化为6-MMP,硫嘌呤和甲基硫嘌呤可以和乙酸苯汞形成复合物而被有机溶剂萃取出来。
水解物冷却后,向水解管中加入500μL3.4mol/L的NaOH后立即加入6mLPMA-戊醇-甲苯溶液,振荡10min,离心。
吸取5mL甲苯相于具塞离心试管中,加入200μL0.1mol/LHCl,在旋转混合器上混合3×20s,离心,弃去上层甲苯相,取水相50μL注入色谱仪进行于HPLC分析。
1.5色谱条件
色谱柱:
C18反相柱。
流动相A:
0.2%的乙酸-水溶液;流动相B:
甲醇。
梯度洗脱程序:
其中0~16min为分析梯度,四种物质在16min内全部出峰,16~15min为洗色谱柱的时间。
时间(min)
A浓度(%)
B浓度(%)
0
100
0
16
20
80
16
0
100
25
0
100
25
100
0
检测波长:
0~12.5min波长为340nm,检测6—TG、6-MP和6-TX;12.5min后切换到290nm,检测6-MMP。
柱温:
40℃。
流速:
1.0mL/min。
进样体积:
10μL。
2结果
2.1色谱图
在上述色谱条件下,6-TG、6-MP、6-TX和6-MMP混合标准溶液的色谱图见图2,四种物质出峰的时间依次为9.26、9.96、10.84和15.57min。
从图2可以看出,色谱分离状况良好,峰形对称,四种物质均达到基线分离,分离度≥1.5。
图2.梯度洗脱分析6-MP及其代谢产物的高效液相色谱图
色谱柱:
C18;流动相流A:
0.2%的醋酸,流动相B:
甲醇;梯度:
0min时,100%A,16min时,20%A+80%B,检测器:
0~12.5min为340nm,检测6-TG、6-MP、6-TX,12.5min以后切换为290nm,检测6-MMP;柱温:
40℃;流速:
1.0mL/min。
进样量:
每种物质100pmol/10μL。
保留时间:
6-TG,9.26min;6-MP9.96min,6-TX10.85min;6-MMP,15.57min。
2.2标准曲线
将1nmol/mL、2nmol/mL、5nmol/mL、10nmol/mL、15nmol/mL和20nmol/mL的系列混合标准溶液进样10μL,得到每种物质的峰面积,峰面积对进样量进行线性拟合,拟合结果见表1和图3。
本方法对红血球中10pmol/8×108RBC含量水平的6-TG、6-MP、6-TX和6-MMP可进行准确地检出和定量分析,满足临床应用的要求。
表1.6-TG、6-MP、6-TX和6-MMP的标准曲线及线性拟合参数
进样量
pmol
峰面积
6-TG
6-MP
6-TX
6-MMP
10
1023
880
2669
961
20
1825
1732
5838
1986
50
4423
4032
11095
4639
100
9051
8256
23232
9435
150
14092
12985
33793
13621
200
18907
16629
43016
19012
Y=aX+b
y=94.5x-130.2
y=84.1x-9.4
y=213.5x+1077.7
y=93.6x+9.3
R2
0.9993
0.9989
0.9980
0.9989
图3.6-TG、6-MP、6-TX和6-MMP的标准曲线
2.3精密度和准确度
向未接受硫嘌呤治疗的健康人红血球中加入低、中和高三个浓度的混合标准溶液,然后按照1.4的方法进行处理,按1.5的方法进行色谱分析,平行5份样品,计算每个标准加入水平下的回收率及其变异系数,结果见表2。
表2.6-TG、6-MP、6-TX和6-MMP分析的精密度和准确度
加入量
批内(n=5)
批间(n=5)
(pmol)
测得量
回收率
RSD
测得量
回收率
RSD
(pmol)
(%)
(%)
(pmol)
(%)
(%)
平均值±SD
平均值±SD
6-TG
20
19.2
±
0.9
96.0
4.7
19.1
±
1.5
95.5
7.9
50
48.1
±
2.1
96.2
4.4
47.3
±
4.7
94.6
9.9
200
188.1
±
4.6
94.1
2.4
194.4
±
11.3
97.2
5.8
6-MP
20
19.7
±
0.9
98.5
4.6
19.2
±
1.4
96.0
7.3
50
49.3
±
2.2
98.6
4.5
47.9
±
4.1
95.8
8.6
200
194.5
±
5.6
97.3
2.9
194.4
±
12.3
97.2
6.3
6-TX
20
19.4
±
0.7
97.0
3.6
19.0
±
1.4
95.0
7.4
50
48.9
±
2.3
97.8
4.7
48.5
±
4.5
97.0
9.3
200
195.3
±
7.3
97.7
3.7
190.4
±
12.3
95.2
6.5
6-MMP
20
19.2
±
0.8
96.0
4.2
19.1
±
1.5
95.5
7.9
50
49.4
±
2.0
98.8
4.0
47.3
±
4.7
94.6
9.9
200
196.3
±
7.6
98.2
3.9
194.4
±
10.4
97.2
5.3
2.4样品分析结果
在建立上述能同时分析6-TG、6-MP、6-TX和6-MMP等4种物质的HPLC方法之前,我们首先建立了前3种物质6-TG、6-MP和6-TX的HPLC方法。
本方法采用等度洗脱,具体如下:
色谱柱:
C18;流动相为10:
90的甲醇-水,含100mmol/L三乙胺并用磷酸调pH值为3.2,脱气前加入0.5mmol/L的DTT;流速:
1.0ml/min;检测波长:
335nm。
色谱图见图4。
从图4可以看出,6-TG、6-MP和6-TX在等度洗脱的条件下,在8min内得到了很好的分离。
方法的线性、精密度和准确度均满足要求。
但用这个方法,在我们的实验条件下,6-MMP不易出峰。
我们用等度洗脱方法,分析了正在接受硫嘌呤药物治疗的ALL患者的49份血样,典型的色谱图见图4B。
以正常健康人的血样为空白对照,其色谱图见图4C,分析结果见表3。
A
B
C
图4.等度洗脱分析6-TG、6-MP和6-TX的高效液相色谱图
A-混合标准,B-正在接受硫嘌呤药物治疗的ALL患者血样,C-正常健康人的血样。
色谱柱:
C18;流动相为10:
90的甲醇-水,含100mmol/L三乙胺并用磷酸调pH值为3.2,脱气前加入0.5mmol/L的DTT;流速:
1.0ml/min;检测波长:
335nm。
保留时间:
6-TG,4.72min;6-MP,5.46min;6-TX,7.17min。
表3.接受硫嘌呤药物治疗的ALL患者红血球中6-TG、6-MP和6-TX的等度洗脱
高效液相色谱分析结果(单位:
pmol/8×108RBC)
No
6-TG
6-MP
6-TX
No
6-TG
6-MP
6-TX
1
0
<10
<10
27
<10
<10
<10
2
0
<10
<10
28
9
<10
<10
3
0
<10
<10
29
19
3<10
<10
4
21
<10
<10
30
1<10
<10
<10
5
27
<10
<10
31
<10
36
<10
6
0
<10
<10
32
<10
<10
<10
7
35
12
<10
33
<10
<10
<10
8
0
<10
<10
34
5
<10
<10
9
23
<10
<10
35
<10
<10
<10
10
15
<10
<10
36
<10
<10
<10
11
50
15
<10
37
<10
<10
<10
12
0
17
<10
38
—
—
—
13
8
13
<10
39
<10
<10
<10
14
0
<10
<10
40
<10
<10
<10
15
8
14
<10
41
<10
<10
<10
16
0
<10
<10
42
<10
<10
<10
17
18
8
<10
43
14
<10
<10
18
54
35
<10
44
<10
<10
<10
19
—
—
—
45
<10
<10
<10
20
—
—
—
46
<10
<10
<10
21
14
<10
<10
47
<10
<10
<10
22
13
<10
<10
48
16
<10
<10
23
21
<10
<10
49
14
<10
<10
24
0
<10
<10
50
<10
<10
<10
25
5
4
<10
51
<10
<10
<10
26
65
<10
<10
在本项目的研究中,我们先建立了等度洗脱高效液相色谱法,并用此方法分析了一批临床样品。
由于等度洗脱法6-MMP不能很好出峰,我们继续对方法进行改进,采用梯度洗脱程序,在优化的实验条件下,在16min内6-TG、6-MP、6-TX和6-MMP得到良好的分离,并用向正常健康人血样中加标的方法进行了精密度和准确度实验,结果良好。
由于ALL患者血样不易得到,所以还没有用梯度洗脱HPLC法分析ALL患者红血球中6-MP及其代谢物的结果。
3讨论
由于硫嘌呤类药物治疗ALL等疾病的效果和毒副作用在患者个体之间的差异很大,所以,在治疗的过程中监测病人体内硫嘌呤类药物的活性代谢学产物(如6-TGNs)和非活性代谢产物(如6-MMP),并以次为依据调整治疗和用药方案,进行个体化治疗,对提高药物疗效、减小毒副作用具有非常主要的意义。
Lennard和Singleton[2,3]建立了同时测定红细胞中6-TGNs和6-MMPNs的HPLC方法,其样品处理方法是将红细胞样品在1.0mol/L的H2SO4介质中于100℃下水解1h,使6-TGNs和6-MMPNs水解为相应的母体硫嘌呤6-TG和6-MMP,然后在碱性介质中用含乙酸苯汞的甲苯溶液将6-TG和6-MMP萃取到有机相甲苯中,再用0.1mol/L的HCl将6-TG和6-MMP反萃到水相中,用于高效液相色谱分析。
在样品水解的过程中加入DTT以防止含硫基团被氧化。
PMA萃取的效率与萃取时的pH值密切相关,碱性越强,萃取效率越高[10]。
Dervieux和Boulieu[4,5]的样品处理方法是在红血球中加入固体DTT,然后用HClO4沉淀蛋白,离心,提取液于100℃下水解45min,将硫嘌呤核苷水解转化为相应的硫嘌呤,水解液直接用于HPLC分析。
Dervieux和Boulieu的研究结果表明,6-MMPNs在酸水解的过程中会转化为4-氨基-5-(甲硫基)羰基咪唑衍生物,转化效率与水解时的pH密切相关,在硫嘌呤核苷水解转化为硫嘌呤的条件下,6-MMPNs的转化率为100%。
因而在色谱分析时色谱图上没有6-MMP的色谱峰,而有6-MMP衍生物的色谱峰。
他们认为本方法不能直接测定6-MMP,但可以通过其衍生物间接测定。
但Hawatari等[6,7]稍作修饰的Dervieux和Boulieu方法却在色谱图中得到了6-MMP的色谱峰,他们认为水解时6-MMP并不能完全转化,因而可以直接测定红细胞中6-MMP的含量。
Su等[11]用100μL血浆,相向中加入25μL1mol/L的HCl,旋转混合,置上冷却,在加入25μLTE缓冲液,旋转混合,置冰上冷却后离心超滤除去蛋白质,取50μL注入液相色谱仪分析。
分析时用C18反相柱,梯度洗脱,在40分钟内6-MP及其7种代谢产物得到良好分离。
这7种代谢物是6-TG、6-TX、6-巯基嘌呤核苷(6-mercaptopurineriboside,rMP)、6-硫鸟嘌呤核苷(6-thioguanosine,rTG)、6-硫黄嘌呤核苷(6-thioxanthineriboside,rTX)、6-MMP和6-甲基巯基嘌呤核苷(6-methylmercaptopurineriboside,rMMP)。
这种处理方法由于不用水解,可以同时测定硫嘌呤和硫嘌呤核苷。
Shipkova等[8,9]对比研究了Lennard和Singleton方法与Dervieux和Boulieu方法。
结果表明,用Dervieux和Boulieu的方法测得的TGNs的含量是用Lennard和Singleton的方法测得的含量的2.6倍,虽然两种方法所得到的结果是显著相关的。
如果将Lennard和Singleton方法中水解介质有H2SO4改为HClO4,则两种方法的差异减小到1.4倍。
Stefan等也报道了近似的结果[9]。
文献报道的6-MP及其代谢产物的分析结果相差很大,各实验室之间的结果可比性很差,数据也无法交流和共享,这主要与样品处理和提取方法有关。
因此,分析方法的标准化是今后研究工作的重点[10]。
参考文献
[1]CuffariC,SeidmanEG,LatourSandThéorêtY.Quantitationof6-thioguanineinperipheralbloodleukocyteDNAinCrohn’sdiseasepatientsonmaintenance6-mercaptopurinetherapy.Can.JPhysiolPharmacol.1996,74:
580-585.
[2]LennardL.Assayof6-thioinosinicacidand6-thioguaninenucleotides,activemetabolitesof6-mercaptopurine,inhumanredbloodcells.JChromatogr1987;423:
169–78.
[3]LennardL,SingletonHJ.High-performanceliquidchromatographicassayofthemethylandnucleotidemetabolitesof6-mercaptopurine:
quantitationofredbloodcell6-thioguaninenucleotide,6-thioinosinicacidand6-methylmercaptopurinemetabolitesinasinglesample.JChromatogr1992;583:
83–90.
[4]BoulieuR,DervieuxT.High-performanceliquidchromatographicdeterminationofmethyl6-mercaptopurinenucleotides(Me6-MPN)inredbloodcells:
analysisofMe6-MPNperseorMe6-MPNderivative?
JChromatogr,B.1999,730:
273–4.
[5]DervieuxT,BoulieuR.Simultaneousdeterminationof6-thioguanineandmethyl6-mercaptopurinenucleotidesofazathioprineinredbloodcellsbyHPLC.ClinChem.1998;44:
551–5.
[6]MawatariH,KatoY,NishimuraS-I,SakuraN,UedaK.Reversedphasehigh-performanceliquidchromatographicassaymethodforquantitating6-mercaptopurineanditsmethylatedandnon-methylatedmetabolitesinasinglesample.JChromatogr,B.1998,716:
392–396.
[7]MawatariH,KatoY,NishimuraS-I,SakuraN,UedaK.Commentson‘‘High-performanceliquidchromatographicdeterminationof