综合化学实验复习整理及题目参考.docx
《综合化学实验复习整理及题目参考.docx》由会员分享,可在线阅读,更多相关《综合化学实验复习整理及题目参考.docx(15页珍藏版)》请在冰豆网上搜索。
综合化学实验复习整理及题目参考
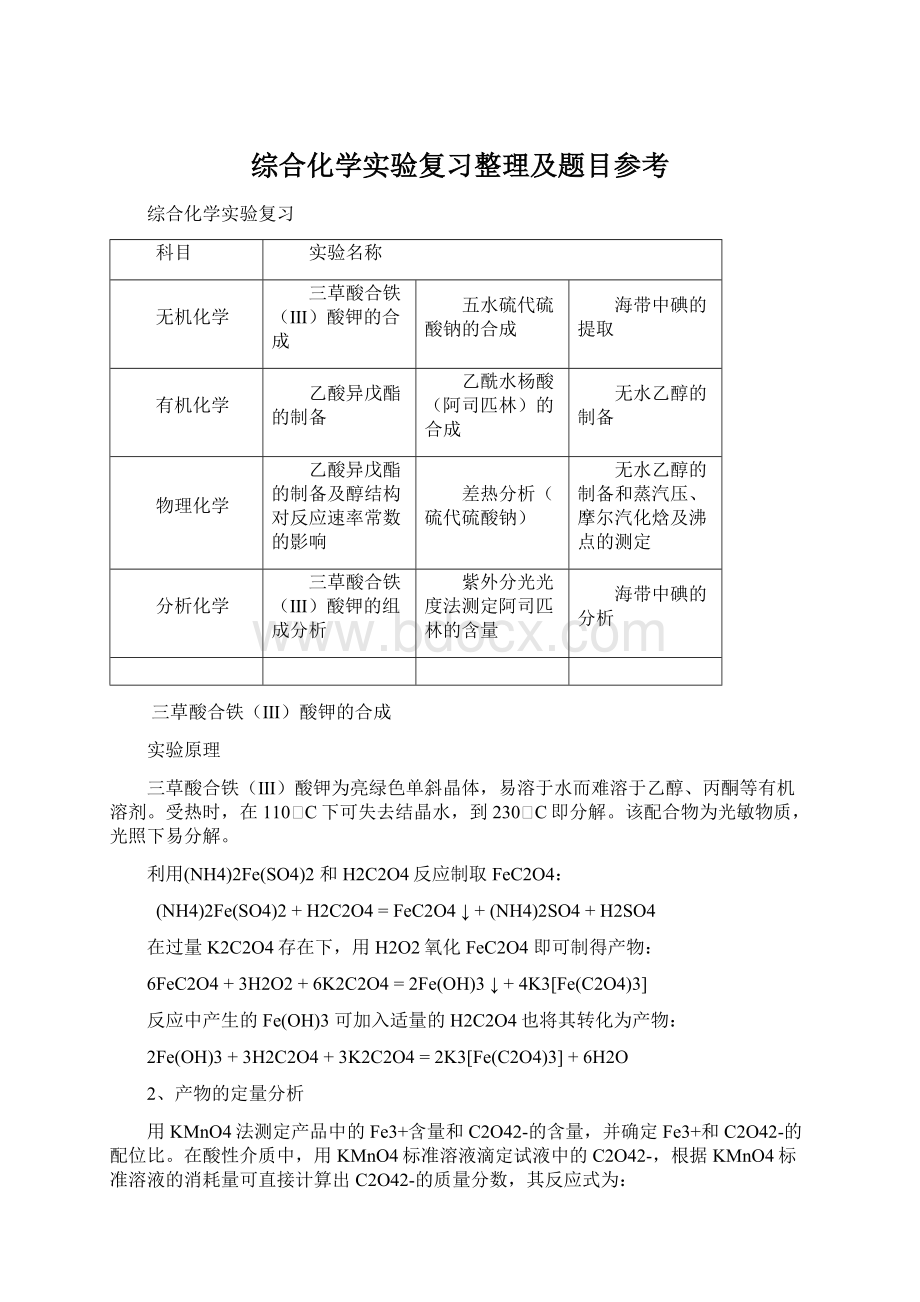
综合化学实验复习
科目
实验名称
无机化学
三草酸合铁(Ⅲ)酸钾的合成
五水硫代硫酸钠的合成
海带中碘的提取
有机化学
乙酸异戊酯的制备
乙酰水杨酸(阿司匹林)的合成
无水乙醇的制备
物理化学
乙酸异戊酯的制备及醇结构对反应速率常数的影响
差热分析(硫代硫酸钠)
无水乙醇的制备和蒸汽压、摩尔汽化焓及沸点的测定
分析化学
三草酸合铁(Ⅲ)酸钾的组成分析
紫外分光光度法测定阿司匹林的含量
海带中碘的分析
三草酸合铁(Ⅲ)酸钾的合成
实验原理
三草酸合铁(Ⅲ)酸钾为亮绿色单斜晶体,易溶于水而难溶于乙醇、丙酮等有机溶剂。
受热时,在110︒C下可失去结晶水,到230︒C即分解。
该配合物为光敏物质,光照下易分解。
利用(NH4)2Fe(SO4)2和H2C2O4反应制取FeC2O4:
(NH4)2Fe(SO4)2+H2C2O4=FeC2O4↓+(NH4)2SO4+H2SO4
在过量K2C2O4存在下,用H2O2氧化FeC2O4即可制得产物:
6FeC2O4+3H2O2+6K2C2O4=2Fe(OH)3↓+4K3[Fe(C2O4)3]
反应中产生的Fe(OH)3可加入适量的H2C2O4也将其转化为产物:
2Fe(OH)3+3H2C2O4+3K2C2O4=2K3[Fe(C2O4)3]+6H2O
2、产物的定量分析
用KMnO4法测定产品中的Fe3+含量和C2O42-的含量,并确定Fe3+和C2O42-的配位比。
在酸性介质中,用KMnO4标准溶液滴定试液中的C2O42-,根据KMnO4标准溶液的消耗量可直接计算出C2O42-的质量分数,其反应式为:
5C2O42-+2MnO4-+16H+=10CO2+2Mn2++8H2O
在上述测定草酸根后剩余的溶液中,用锌粉将Fe3+还原为Fe2+,再利用KMnO4标准溶
液滴定Fe2+,其反应式为:
Zn+2Fe3+=2Fe2++Zn2+
5Fe3++MnO4-+8H+=5Fe3++Mn2++4H2O
根据KMnO4标准溶液的消耗量,可计算出Fe3+的质量分数。
根据
n(Fe3+):
n(C2O42-)=[ω(Fe3+)/55.8]:
[ω(C2O42-)/88.0]
可确定Fe3+和C2O42-的配位比。
1、合成过程中,滴完H2O2后为什么还要煮沸溶液?
答:
除去过量的过氧化氢。
煮沸时间不能过长,否则会因氢氧化铁的团聚而使得颗粒较粗大且致密,导致酸溶配位反应速度缓慢,影响产品的产率及纯度。
2、氧化FeC2O4·2H2O时,氧化温度控制在40℃,不能太高。
为什么?
答:
氧化FeC2O4·2H2O时,氧化温度不能太高(保持在40℃),以免H2O2分解,同时需不断搅拌,使Fe2+充分被氧化。
3、如何提高产率?
能否用蒸干溶液的办法来提高产率?
答:
(1)关键是严格进行每一步操作,尤其是第一步加H2O2氧化时,要边加入边搅拌,使Fe2+氧化完全。
(2)不能用蒸干溶液的办法来提高产率,因为母液中含未反应的C2O42-、K+等杂质。
4、根据三草酸合铁(Ⅲ)酸钾的性质,应如何保存该化合物?
答:
应置于干燥器中避光保存。
5、在制备K3Fe[(C2O4)3]·3H2O的过程中,使用的氧化剂是什么?
有什么好处?
使用时应注意什么?
如何保证Fe(II)转化完全?
答:
过氧化氢。
对环境无污染。
使用时应注意控制温度在40摄氏度,防止过氧化氢因温度过高而分解。
为了保证转化完全,在氧化过程中应不断搅拌。
注意事项:
1.水浴40℃下加热,慢慢滴加H2O2.以防止H2O2分解.
2.减压过滤要规范.尤其注意在抽滤过程中,勿用水冲洗粘附在烧杯和布氏滤斗上的少量绿色产品,否则,将大大影响产量.
3、KMnO4滴定Fe2+、C2O42-时,滴定速度不能太快,否则部分KMnO4在热溶液中按下式分解:
4KMnO4+H2SO4——4MnO2+2K2SO4+2H2O+3O2
海带中碘的提取及分析
三、实验原理
海带中的碘主要以碱金属碘化物和有机碘化物形式存在。
利用灰化法将海带中有机碘化物转化为碘化物的形式,溶解过滤。
在碱性条件下,海带中I-离子被KMnO4氧化为IO3-(过量的KMnO4在弱酸条件下用(COOH)2溶液除去)。
然后在酸性条件下,加入KI和IO3-反应生成I2,再用Na2S2O3溶液滴定。
所涉及的化学反应方程式为:
I-+6MnO4-+6OH-=IO3-+6MnO42-+3H2O
5(COOH)2+2MnO4-+6H+=2Mn2++10CO2+8H2O
IO3-+5I-+6H+=3I2+3H2O
I2+I-=I3-
I2+2S2O32-=2I-+S4O62-
1.为什么要将海带进行灼烧?
灼烧后海带中的碘主要以何种形式存在?
答:
海带中的碘主要以碱金属碘化物和有机碘化物形式存在。
利用灰化法将海带中有机碘化物转化为碘化物的形式。
2.如何配制和保存Na2S2O3溶液?
答:
用五水硫代硫酸钠溶于新煮沸放冷的蒸馏水,并在溶液中加入少量的碳酸钠,放置几天,待溶液浓度趋于稳定后再用,贮存于棕色试剂瓶中,密封避光放置。
(保持碱性环境:
S2O32-是弱酸根,酸性环境下不稳定,隔绝空气:
S2O32-有强还原性,会被空气中的氧气氧化)
3、海带样品溶液中锰离子的存在对碘的测定有无影响,为什么?
答:
有影响,因为多的Mn2+会使溶液颜色变为浅粉红色,少的Mn2+使溶液无色,而MnO42-显绿色,MnO4-显现紫色,如果太多Mn2+会影响滴定终点的判断。
4.用Na2S2O3标准溶液滴定样品溶液时,淀粉指示剂应何时加入,为什么?
答:
淀粉溶液中的淀粉是大分子结构,滴定前的碘浓度较高,淀粉大分子对碘有吸附、包裹的作用,使碘不能定量完全反应,导致结果偏低。
通常是滴定至终点前,即成淡黄色时,再加入淀粉。
这时碘的浓度较低,上述作用发挥不完全,使结果相对准确。
五水硫代硫酸钠的合成
1、实验原理
五水硫代硫酸钠为无色透明单斜晶体,空气中加热易分解成硫酸钠和二氧化硫,易溶于水但不溶于乙醇。
反应式为:
Na2SO3+S+5H2O=Na2S2O3·5H2O
二、实验步骤
称取2.0克硫单质粉末,置于50mL烧杯中,加1.0mL乙醇将其润湿,再称取6.0克亚硫酸钠固体,将其加入盛有硫单质的烧杯中,并加入15mL至20mL蒸馏水,将烧杯置于酒精灯上加热至剧烈沸腾后,保持剧烈沸腾状态25至30分钟。
(在此过程中适时补加少量沸水,以保持溶液体积在15mL至20mL。
)反应后,立即趁热过滤,得滤液。
将此滤液置于酒精灯上加热蒸发浓缩,直至溶液产生连续不断的大量细小气泡为止。
取下烧杯,将其置于冰水浴中冷却至室温以下,然后投入一颗硫代硫酸钠晶体,观察记录现象。
一段时间后,减压过滤,并用少量乙醇洗涤产品抽干后用滤纸吸干产品上的水分。
称量,计算产率。
1硫磺粉稍有过量,为什么?
答:
增加反应的产率。
硫磺价格便宜。
2、如果没有晶体析出,该如何处理?
答:
(1)加入少量晶种;
(2)用玻璃棒摩擦烧杯壁;(3)降低温度。
3.蒸发浓缩时,为什么不可将溶液蒸干?
答:
脱色。
4.为什么加入乙醇?
目的何在?
答:
降低水的表面张力,增大亚硫酸钠和硫磺的接触机会,增加反应速度,减少反应时间。
5、反应过程中,为何要保持剧烈沸腾?
答:
为了提高反应物温度,提高实验产率
6、投入一颗硫代硫酸钠晶体的目的是什么?
答:
促使硫代硫酸钠晶体析出
差热分析(硫代硫酸钠)
5.差热峰的方向和样品吸放热的关系:
差热峰的方向和两个因素有关,首先,差热分析中是以参比物还是试样为基准来算差值(即TS-TR=ΔT还是TR-TS=ΔT);其次,发生的反应本身是吸热还是放热的。
在本次实验中以试样为基准,由于是吸热反应,因此差热峰向下。
1.DTA实验中如何选择参比物?
常用的参比物有哪些?
答:
要获得平稳的基线,参比物的选择很重要。
要求参比物在加热或冷却过程中不发生任何变化,在整个升温过程中参比物的比热、导热系数、粒度尽可能和试样一致或相近。
常用三氧化二铝(α-Al2O3)或煅烧过的氧化镁或石英砂作参比物。
如分析试样为金属,也可以用金属镍粉作参比物。
如果试样和参比物的热性质相差很远,则可用稀释试样的方法解决,主要是减少反应剧烈程度;如果试样加热过程中有气体产生时,可以减少气体大量出现,以免使试样冲出。
选择的稀释剂不能和试样有任何化学反应或催化反应,常用的稀释剂有SiC、Al2O3等。
2.差热曲线的形状和那些因素有关?
影响差热分析结果的主要因素是什么?
(1)气氛和压力的选择
(2)升温速率的影响和选择(3)试样的预处理及用量
(4)参比物的选择
除上述外还有许多因素,诸如样品管的材料、大小和形状、热电偶的材质以及热电偶插在试样和参比物中的位置等都是应该考虑的因素。
3、为什么差热峰有时向上,有时向下?
差热峰的方向由两个因素决定。
一是试样变化的热学性质,是放热还是吸热变化。
二是仪器是正接还是反接,即ΔT=TS-TR还是ΔT=TR-TS。
在两个因素影响下峰的方向如下表:
4、克服基线漂移,可以采取哪些措施?
基线漂移主要是由于试样和参比物的热学性质不同造成的。
因此克服基线漂移有三个方面的方法。
一是减小试样和参比物的热学性质差异;二是减小这种差异造成的影响;三是数据处理方法。
1)减小试样和参比物的热学性质差异:
(1)选择合适的参比物,要求在实验温区的热学性质和试样相似并且稳定。
(2)采用试样稀释方法,在填入试样前,先加参比物垫底约0.5MM,填入后再用参比物覆盖,混合物和参比物的热学性质差异变小。
但要求试样和参比物不反应。
2)减小热学性质差异造成的影响:
(1)降低升温速率,使系统更接近准平衡状态,可以减少温度传导过程的影响。
(2)对样品进行预处理,并使用小量样品,也可以增加分辨率,减少基线漂移。
(3)适当选择均温块,增大系统的热惯性,降低对这种差异的敏感度。
(4)适当选择热电偶位置,选择测量试样的中心温度或者表面温度,测量参比物中心温度还是炉内温度等。
3)数据处理方法:
如果我们已知基线漂移规律,就可以在数据处理时减去基线漂移的影响。
假设基线漂移是线性的,随温度而变化。
则漂移量ε=kT。
通过作图可以求出斜率k,进而求出ε。
于是修改后ΔT'=ΔT-ε。
5、影响峰高度和峰面积的因素有哪些?
如在误差分析中举出的因素:
(1)样品因素:
1、试样性质。
试样颗粒线度,即装填密度和空隙气体会影响峰的高度和面积。
空隙少,导热率dQ/dt大,峰高度增高,变窄,但面积不变。
如果有气体参和反应,则空隙少,扩散差,反应受阻,峰向高温移动,峰高减小,变宽。
2、参比物性质。
3、惰性稀释剂性质。
惰性稀释剂浓度大,反应试样量少,峰向低温移动,峰高减小,面积减小。
(2)实验条件影响:
1、试样量。
试样量大,峰高增高,面积增大。
2、升温速率。
升温速率快,峰向高温移动,峰高增高,面积不变。
3、炉内气氛。
静态较动态,峰向高温移动,变宽。
4、试样预处理。
粉末比固体块导热效果好,峰向低温移动,高度增高,宽度变窄,面积不变。
(3)仪器因素:
1、加热方式、炉子形状和大小。
2、样品支持器。
3、温度测量和热电偶。
4、电子仪器的工作状态。
无水乙醇的制备
一、实验原理
CaO+H2O->Ca(OH)2,
利用生石灰氧化钙和乙醇中的水反应掉,再蒸馏的方法将乙醇蒸出,获得无水乙醇,纯度最高可达99.5%,如果再高,就必须用金属镁或金属钠对无水乙醇进行处理。
二、实验装置
1.仪器的选择:
250ml圆底烧瓶,直型冷凝管,干燥管,酒精灯。
2.安装顺序:
按照从下到上的顺序依次安装酒精灯,石棉网,圆底烧瓶,直型冷凝管,干燥管,干燥管里装上干燥剂无水氯化钙(装得不要太紧,大概球形部分大部充满即可,以块状为主,粉末状的尽量少,因其可能易吸水,效果不好),先用冷凝水,再加热,并且圆底烧瓶中要加2~3粒沸石。
3.蒸馏:
补加1~2粒沸石,改成蒸馏装置,按从左到右,从下到上,装装置,温度计水银球,冷凝管水下进上出,十字夹,万用夹的安装,尾接管和接收瓶、冷凝管的位置。
三、实验步骤
1.量取100ml灯用酒精,称量30g生石灰氧化钙,并2~3颗沸石,一起加到圆底烧瓶中,按照上面步骤装好装置;
2.水浴或直接加热回流1.5h,小心暴沸;后停止加热,稍冷改为蒸馏装置,收集温度变化较小的范围内的馏分,当温度上升或下降较多时停止,保留前馏分和收集馏分,量取收集馏分的体积。
3.计算产率;待冷却后,按从右到左,从上到下拆下装置,洗净仪器装置(烧瓶中的固体倒到垃圾桶中,不要往水槽里倒。
),打扫卫生。
无水乙醇饱和蒸汽压的测定
1:
真空泵在开关之前为什么要先通大气?
:
答案:
保护真空泵,防止真空泵油被倒抽出来而损坏真空泵。
2:
本实验中缓冲压力罐有什么作用?
答案:
缓冲压力和调节压力。
3:
如何判断等压计中的空气已被抽尽?
答案:
重新抽气3分钟,若同一温度下两次压力读数相同则说明等压计中的空气已被抽尽。
4:
如何判断等压计中的气体和液体已达气液平衡?
答案:
等压计中的B、C两管液面不再移动。
乙酸乙酯的制备
三、反应原理:
主反应
副反应
1、酯化反应有什么特点?
实验中如何创造条件使酯化反应尽量向生成物的方向进行?
答:
酯化反应为可逆反应,反应进行慢且需要酸催化。
为提高产率,本实验中采用增加醇的用量、不断将产物酯和水蒸出、加大浓硫酸用量的措施,使平衡向右移动。
2、本实验若采用醋酸过量的做法是否合适?
为什么?
答:
不合适,因为使平衡向生成物一方移动,使用过量的酸不好,因为酸不能和酯共沸
3、蒸出的粗乙酸乙脂中主要有哪些杂质?
如何除去?
答:
主要杂质有乙醚、乙醇、乙酸和水等。
由于乙醚沸点低,在多次洗涤中,极易挥发掉;使用饱和的Na2CO3溶液洗涤除去乙酸;紧跟着用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,然后用饱和CaCl2溶液直接洗涤除去少量的乙醇。
4、实验中使用浓硫酸的作用?
答:
反应中,浓硫酸除了起催化剂作用外,还吸收反应生成的水,有利于酯的生成。
5、能否用浓氢氧化钠溶液代替饱和碳酸钠溶液来洗涤蒸馏液?
答:
不可以,使用浓氢氧化钠溶液可以使乙酸乙酯发生水解,降低产率。
6、为什么用饱和碳酸钠溶液洗涤时要小量分批加入,并不断摇动接受器?
答:
因为乙酸乙酯粗产品中含有乙酸,乙酸和饱和碳酸钠溶液反应生成二氧化碳,如果一次加入,反应剧烈,所以必须要小量分批加入,并不断摇动接受器,使乙酸和碳酸钠温和的反应。
7、实验中用饱和食盐水洗涤,是否可用水代替?
答:
不可以,由于乙酸乙酯在水中有一定的溶解度,为了尽可能减少由此而造成的损失,所以采用饱和食盐水进行洗涤。
8.为何本实验要在恒温条件进行,而CH3COOC2H5和NaOH溶液在混合前还要预先恒温?
答:
因为反应速率k受温度的影响大,(kT+10)/kT=2~4,若反应过程中温度变化比较大,则测定的结果产生的误差较大;反应物在混合前就预先恒温是为了保证两者进行反应的时候是相同温度的,防止两者温差带来温度的变化影响测定结果。
9.为什么CH3COOC2H5和NaOH起始浓度必须相同,如果不同,试问怎样计算k值?
如何从实验结果来验证乙酸乙酯反应为二级反应?
答:
因为乙酸乙酯的皂化反应是二级反应,为了简化计算,采用反应物起始浓度相同。
如果不同,则k=1/t(a-b)·ln[b(a-x)/a(b-x)]。
选择不同浓度的CH3COOC2H5和NaOH溶液,测定不同浓度的反应物在相同反应条件下的反应速率。
10.如果两溶液均为浓溶液,能否用相同的方法求k值?
为什么?
答:
不能。
因为实验原理成立的先决条件是电导和浓度成正比例关系,如果为浓溶液,则电导很低,试验将无法进行。
11、为什么氢氧化钠和乙酸乙酯的浓度必须足够低?
答:
实验原理成立的先决条件是电导和浓度成正比例关系,而其中的比例系数K=∧m/Kcell,若使K成为和浓度无关的常数,需将∧m以∧m∞代替,则要求电解质的浓度足够稀。
12、反应分子数和反应级数是两个完全不同的概念,反应级数只能通过实验来确定。
试问如何从实验结果来验证乙酸乙酯为二级反应?
答:
保证实验条件完全相同的情况下,采用不同浓度的CH3COOC2H5和NaOH进行实验,比较实验的反应速率常数来证明乙酸乙酯皂化反应为二级反应。
13、乙酸乙酯皂化反应为吸热反应,试问在实验过程中如何处置这一影响而使实验得到较好的结果?
答:
实验采用稀溶液在超级恒温水浴中进行,并反应前水浴槽恒温10分钟才进行实验,NaOH和CH3COOC2H5溶液在混合前还要预先恒温10分钟,以保证整个实验过程都在相对稳定的温度下进行。
乙酰水杨酸的制备
水杨酸分子中含羟基(—OH)、羧基(—COOH),具有双官能团。
本实验采用以强酸为硫酸[1]为催化剂,以乙酐为乙酰化试剂,和水杨酸的酚羟基发生酰化作用形成酯。
反应如下:
M=138.12M=102.09M=180.15
引入酰基的试剂叫酰化试剂,常用的乙酰化试剂有乙酰氯、乙酐、冰乙酸。
本实验选用经济合理而反应较快的乙酐作酰化剂。
制备的粗产品不纯,除上面两副产品外,可能还有没有反应的水杨酸等杂质。
本实验用FeCl3检查产品的纯度,此外还可采用测定熔点的方法检测纯度。
杂质中有未反应完酚羟基,遇FeCl3呈紫蓝色。
如果在产品中加入一定量的FeCl3,无颜色变化,则认为纯度基本达到要求。
利用阿斯匹林的钠盐溶于水来分离少量不溶性聚合物。
二、实验步骤及注意事项
实验步骤
实验注意事项、实验改进
一.乙酰水杨酸制备
(1)称取水杨酸1.98g于锥形瓶(150mL);在通风条件下用吸量管取乙酸酐5mL,加入锥形瓶,滴入5滴浓流酸,摇动使固体全部溶解,盖上带玻璃管的胶塞,在事先预热的水浴中加热约10-15min[2]
水浴装置:
500mL烧杯中加100mL水、沸石,用温度计控制85℃-90℃。
(2)取出锥形瓶,将液体转移至250mL烧杯并冷却至室温(可能会没有晶析出)。
加入50mL水,同时剧烈搅拌;冰水中冷却10min,晶体完全析出。
(3)抽滤。
冷水洗涤几次,尽量抽干,固体转移至表面皿,风干。
(1)若用3mL可减少副反应发生,易于晶体析出,提高产率。
n(水杨酸):
n(乙酸酐)=1:
2~3较为合适。
浓硫酸作用在于破坏水杨酸分子内氢键,降低反应温度(150℃-160℃)到85℃~90℃发生,避免高温副反应发生,提高产品纯度、产率。
浓硫酸用量要控制(V<0.2mL)。
附乙酰水杨酸分解温度:
126℃-135℃
水杨酸和乙酐混合后没有及时加硫酸并加热,会发生较多副反应。
(2)该步搅拌要激烈,否则会析出块状物体,影响后续实验。
(3)准备干燥、干净的抽滤瓶,用母液洗烧杯二至三次,尽量将固体都转移至漏斗。
二.乙酰水杨酸提纯
(1)粗产品置于100mL烧杯中缓慢加入饱和NaHCO3溶液,产生大量气体,固体大部分溶解。
共加入约5mL饱和NaHCO3(aq)搅拌至无气体产生。
(2)用干净的抽滤瓶抽滤,用5-10mL水洗(可先转移溶液,后洗)。
将滤液和洗涤液合并并转移至100mL烧杯中,缓缓加入15mL4mol/L的盐酸。
边加边搅拌,有大量气泡产生。
(3)用冰水冷却10min后抽滤,2-3mL冷水洗涤几次,抽干。
干燥。
称量。
(4)产品纯度检验:
取几粒结晶,加5mL水,滴加1%FeCl3溶液。
检验纯度。
(1)饱和NaHCO3溶液溶解乙酰水杨酸,不溶解水杨酸聚合物,以此提纯乙酰水杨酸。
(2)加入盐酸要滴加,加入过快会导致析出过大的晶粒影响干燥。
(3)干燥步骤未取得较好方法,烘箱中80℃1h以上会烧焦,本次用55min。
产品秤量:
1.57g,理论:
2.58g。
产率60.85%
(4)为增加水杨酸和乙酰水杨酸在水中溶解度,可加入乙醇少许。
注释:
1、参考数据:
名称
分子量
m.p.或b.p.
水
醇
醚
水杨酸
138
158(s)
微
易
易
醋酐
102.09
139.35(l)
易
溶
∞
乙酰水杨酸
180.17
135(s)
溶、热
溶
微
2、注意事项
1)、实验在通风橱中进行,因为乙酸酐具有强烈刺激性,并注意不要粘在皮肤上。
2)、仪器要全部干燥,药品也要实现经干燥处理。
3)、醋酐要使用新蒸馏的,收集139~140℃的馏分。
长时间放置的乙酸酐遇空气中的水,容易分解成乙酸。
4)、要按照书上的顺序加样。
否则,如果先加水杨酸和浓硫酸,水杨酸就会被氧化。
5)、水杨酸和乙酸酐最好的比例为1:
2或1:
3
6)、本实验中要注意控制好温度(85-90℃),否则温度过高将增加副产物的生成,如水杨酰水杨酸、乙酰水杨酰水杨酸、乙酰水杨酸酐等。
7)、将反应液转移到水中时,要充分搅拌,将大的固体颗粒搅碎,以防重结晶时不易溶解。
四、实验关键及注意事项
1、仪器要全部干燥,药品也要实现经干燥处理,醋酐要使用新蒸馏的,收集139-140℃的馏分2、乙酰水杨酸受热后易发生分解,分解温度为126-135℃,因此重结晶时不宜长时间加热,控制水温,产品采取自然晾干3、为了检验产品中是否还有水杨酸,利用水杨酸属酚类物质可和三氯化铁发生颜色反应的特点,用几粒结晶加入盛有3mL水的试管中,加入1-2滴1%FeCl3溶液,观察有无颜色反应(紫色)。
4、本实验中要注意控制好温度(水温90℃)
3、思考题
1、反应容器为什么要干燥无水?
答:
以防止乙酸酐水解转化成乙酸
2、为什么用乙酸酐而不用乙酸?
答:
不可以。
由于酚存在共轭体系,氧原子上的电子云向苯环移动,使羟基氧上的电子云密度降低,导致酚羟基亲核能力较弱,进攻乙酸羰基碳的能力较弱,所以反应很难发生。
3、加入浓硫酸的目的是什么?
答:
浓硫酸作为催化剂。
①水杨酸形成分子内氢键,阻碍酚羟基酰化作用。
水杨酸和酸酐直接作用须加热至150~160℃才能生成乙酰水杨酸,如果加入浓硫酸(或磷酸),氢键被破坏,酰化作用可在较低温度下进行,同时副产物大大减少。
4、本实验中可产生什么副产物?
本实验的副产物包括水杨酰水杨酸酯、乙酰水杨酰水杨酸酯、乙酰水杨酸酐和聚合物。
5、那么副产物中的高聚物如何除去呢?
答:
用NaHCO3溶液。
副产物聚合物不能溶于NaHCO3溶液,而乙酰水杨酸中含羧基,能和NaHCO3溶液反应生成可溶性盐。
)
6、水杨酸可以在各步纯化过程和产物的重结晶过程中被除去,如何检验水杨酸已被除尽?
答:
利用水杨酸属酚类物质可和三氯化铁发生颜色反应的特点,用几粒结晶加入盛有3mL水的试管中,加入1~2滴1%FeCl3溶液,观察有无颜色反应(紫色)。
7.通过什么样的简便方法可以鉴定出阿斯匹林是否变质?
答:
为了检验产品中是否还有水杨酸,利用水杨酸属酚类物质可和三氯化铁发生颜色反应的特点,用几粒结晶加入盛有3ml水的试管中,加入1-2滴1%三氯化铁溶液,观察有无颜色反应(紫色)。
8、为什么控制反应温度在70℃左右?
答:
反应温度不宜过高,否则将增加副产物(如水杨酰水杨酸酯、乙酰水杨酰水杨酸酯)的生成。
实验改进的可能方法------碱催化
实验原理
M=138.12M=102.09M=180.15
(碱催化)
实验步骤
(1)在15×150