食源性致病菌检验实用标准操作程序.docx
《食源性致病菌检验实用标准操作程序.docx》由会员分享,可在线阅读,更多相关《食源性致病菌检验实用标准操作程序.docx(111页珍藏版)》请在冰豆网上搜索。
食源性致病菌检验实用标准操作程序
食源性致病菌检验标准操作程序
福建省疾病预防控制中心
二〇一二年十一月
一、生物样本检验标准操作程序
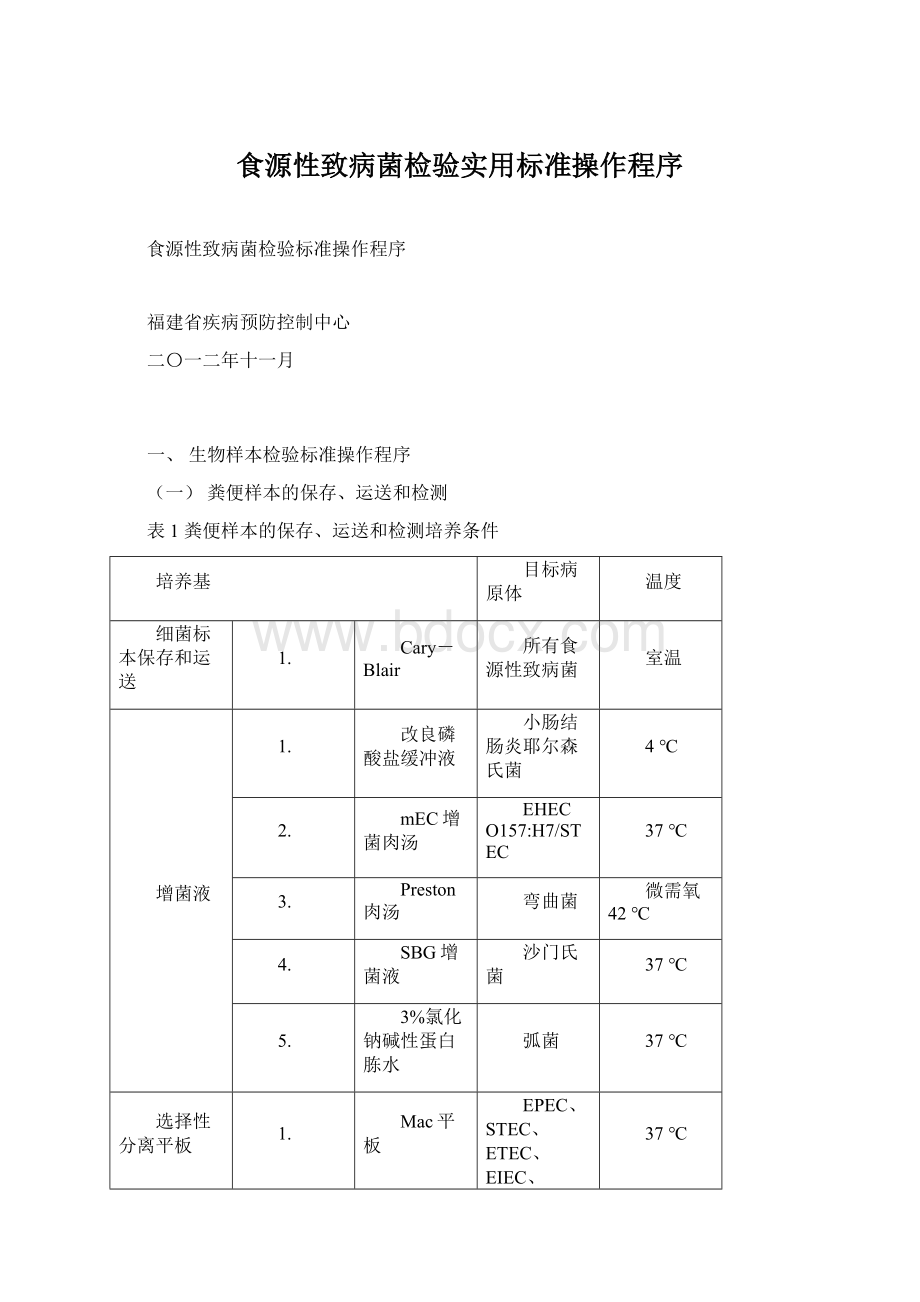
(一)粪便样本的保存、运送和检测
表1粪便样本的保存、运送和检测培养条件
培养基
目标病原体
温度
细菌标本保存和运送
1.
Cary-Blair
所有食源性致病菌
室温
增菌液
1.
改良磷酸盐缓冲液
小肠结肠炎耶尔森氏菌
4℃
2.
mEC增菌肉汤
EHECO157:
H7/STEC
37℃
3.
Preston肉汤
弯曲菌
微需氧42℃
4.
SBG增菌液
沙门氏菌
37℃
5.
3%氯化钠碱性蛋白胨水
弧菌
37℃
选择性分离平板
1.
Mac平板
EPEC、STEC、ETEC、EIEC、EAEC、志贺氏菌
37℃
2.
XLD平板
志贺氏菌
37℃
3.
mCCD平板
弯曲菌
微需氧42℃
4.
耶尔森氏菌选择性平板
小肠结肠炎耶尔森氏菌
25℃
5.
科玛嘉O157:
H7显色平板
EHECO157:
H7
37℃
6.
科玛嘉沙门氏菌显色平板
沙门氏菌
37℃
7.
科玛嘉弧菌显色平板
TCBS平板
弧菌
37℃
病毒标本
1.
采便盒
轮状病毒、诺如病毒、札如病毒、星状病毒、腺病毒
-20℃以下
(二)检验方法与流程
(三)沙门氏菌和志贺氏菌检测操作程序
11 范围
本程序规定了粪便标本中沙门氏菌(Salmonella)和志贺氏菌(Shigella)的检验方法。
12 检验程序
沙门氏菌和志贺氏菌检验程序见图1。
图1 沙门氏菌和志贺氏菌检验程序
13 操作步骤
13.1 标本收集
标本包括新鲜的或转移至Cary-Blair运送培养基的粪便或肛拭子。
最优标本是转移至Cary-Blair运送培养基的粪便拭子。
肛拭子不是最佳标本,仅在病人无粪便标本时采用。
肛拭子收集后应当目测,需要在拭子上明显见到粪便。
所采集的标本尽快检验,放入Cary-Blair运送培养基中的标本应在冷藏条件下24h内送检。
新鲜的粪便标本置于清洁、干燥、无肥皂或消毒液残留的容器中,冷藏条件下8h内送检。
13.2 分离培养
直接分离培养
新鲜粪便:
无菌拭子采集少量粪便,尽量从可见血或黏液的部位收集;新鲜拭子在XLD和MAC一区划线;以1µL无菌接种环或接种针划线分离。
在标本中再插入一个清洁的无菌拭子,将拭子放入SBG增菌液。
轻拧管盖。
注意:
拭子表面有一层标本即可,不可将过量的标本放入SBG增菌液。
肛拭子:
操作程序同新鲜粪便。
转移至Cary-Blair运送培养基的粪便拭子:
轻搅混合标本;拭子在XLD和MAC一区划线;以1µL无菌接种环或接种针划线分离;在标本中再插入一个清洁的无菌拭子,将拭子放入SBG增菌液。
轻拧管盖。
注意:
拭子表面有一层标本即可,不可将过量的标本放入SBG增菌液。
平板36℃1℃培养18h~24h。
增菌培养
增菌液于36℃1℃培养18h~24h,采用上述方法于科玛嘉沙门氏菌显色平板上划线分离,36℃1℃培养18h~24h。
13.3 菌落特征
选择性平板上可疑菌落的特征见表1。
表1沙门氏菌属和志贺氏菌属在不同选择性琼脂平板上的菌落特征
选择性琼脂平板
沙门氏菌
(大多数)
伤寒沙门氏菌
志贺氏菌属
MAC琼脂
菌落光滑、无色,直径2mm~3mm
XLD琼脂
菌落呈红色,直径2mm~4mm
科玛嘉显色培养基
紫色或酒红色
紫色或酒红色
13.4 纯培养
挑取3个或以上可疑菌落,划线接种5%羊血琼脂平板,36℃±1℃培养18h~24h。
13.5 初步鉴定
可疑菌落接种TSI琼脂,赖氨酸脱羧酶培养基、动力-靛基质-鸟氨酸琼脂(MIO)、西蒙氏柠檬酸盐琼脂和尿素琼脂。
沙门氏菌属和志贺氏菌属生化反应初步鉴别见表2。
表2沙门氏菌属和志贺氏菌属生化反应初步鉴别表
项目
沙门氏菌
(大多数)
伤寒
沙门氏菌
甲型副伤寒
沙门氏菌
志贺氏菌属
TSI(斜面)
K
K
K
K
TSI(底层)
A
A
A
A
TSI(产气)
+
-
+
+
TSI(硫化氢)
+
少量
-
-
赖氨酸
+
+
-
-
MIO(动力)
+
+
+
-
MIO(靛基质)
-
-
-
可变
MIO(鸟氨酸)
+
+
+
痢疾志贺氏菌、福氏志贺氏菌、鲍氏志贺氏菌:
-
宋内志贺氏菌:
+
柠檬酸盐(西蒙氏)
+
-
-
-
尿素
-
-
-
-
13.6 血清学鉴定
挑取5%羊血琼脂平板上的菌落,进行沙门氏菌和志贺氏菌的血清学鉴定,设盐水对照。
13.7 确定鉴定
刮取5%羊血琼脂平板上的单个菌落,进行系统生化鉴定。
14 结果与报告
报告粪便标本中检出沙门氏菌或志贺氏菌。
15 菌株的保存和上送
培养物穿刺接种半固体培养基,轻拧管盖,36℃±1℃培养24h,盖紧管盖。
如果需要长期保存菌株,将0.7mL脑心浸液肉汤6h~12h培养物和0.3mL灭菌甘油加入灭菌菌种管,立即放置-70°C保存。
按照方案要求定期上送。
(四)
致泻大肠埃希氏菌检测操作程序
16 范围
本程序规定了粪便标本中致泻大肠埃希氏菌(DiarrheagenicEscherichiacoli)的检验方法。
17 操作步骤
17.1 标本收集
标本包括新鲜的或转移至Cary-Blair运送培养基的粪便或肛拭子。
最优标本是转移至Cary-Blair运送培养基的粪便拭子。
肛拭子不是最佳标本,仅在病人无粪便标本时采用。
肛拭子收集后应当目测,需要在拭子上明显见到粪便。
所采集的标本尽快检验,放入Cary-Blair运送培养基中的标本应在冷藏条件下24h内送检。
新鲜的粪便标本置于清洁、干燥、无肥皂或消毒液残留的容器中,冷藏条件下8h内送检。
17.2 直接分离培养
新鲜粪便:
无菌拭子采集少量粪便,尽量从可见血或黏液的部位收集;新鲜拭子在MAC一区划线;以1µL无菌接种环或接种针划线分离。
肛拭子:
操作程序同新鲜粪便。
转移至Cary-Blair运送培养基的粪便拭子:
轻搅混合标本;拭子在MAC一区划线;以1µL无菌接种环或接种针划线分离。
平板36℃1℃培养18h~24h。
17.3 菌落特征
挑取5个可疑大肠埃希氏菌菌落(粉红色、突起、光滑、湿润)直接保存半固体菌种管;采用PCR检测特异毒力基因方法鉴别5种致泻大肠埃希氏菌。
18 多重PCR鉴定
18.1 标准菌株
标准菌株一览表见表3。
表3标准菌株一览表
菌株名称
标准号
来源
EPEC
CMCC44155
中国食品药品检定研究院
STEC
具有stx1、stx2毒力基因
中国疾病预防控制中心传染病所
ETEC
CMCC44815
中国食品药品检定研究院
EIEC
CMCC44825
中国食品药品检定研究院
EAEC
042血清型
中国疾病预防控制中心传染病所
大肠埃希氏菌
ATCC25922
WHO
18.2 引物合成
多重PCR引物序列见表4。
表4五种致泻大肠埃希氏菌目的基因引物序列
目标菌
目标基因
引物序列
片段大小(bp)
EPEC、STEC
escV–F
5′-ATTCTGGCTCTCTTCTTCTTTATGGCTG-3′
544
escV–R
5′-CGTCCCCTTTTACAAACTTCATCGC-3′
EPEC
bfpB–F
5′-GACACCTCATTGCTGAAGTCG-3′
910
bfpB–R
5′-CCAGAACACCTCCGTTATGC-3′
STEC
stx1A–F
5′-CGATGTTACGGTTTGTTACTGTGACAGC-3′
244
stx1A–R
5′-AATGCCACGCTTCCCAGAATTG-3′
stx2A–F
5′-GTTTTGACCATCTTCGTCTGATTATTGAG-3′
324
stx2A–R
5′-AGCGTAAGGCTTCTGCTGTGAC-3′
ETEC
Elt–F
5′-GAACAGGAGGTTTCTGCGTTAGGTG-3′
655
Elt–R
5′-CTTTCAATGGCTTTTTTTTGGGAGTC-3′
estIa–F
5′-CCTCTTTTAGYCAGACARCTGAATCASTTG-3′
157
estIa–R
5′-CAGGCAGGATTACAACAAAGTTCACAG-3′
estIb–F
5′-TGTCTTTTTCACCTTTCGCTC-3′
171
estIb–R
5′-CGGTACAAGCAGGATTACAACAC-3′
EIEC
invE–F
5′-CGATCAAGAATCCCTAACAGAAGAATCAC-3′
766
invE–R
5′-CGATAGATGGCGAGAAATTATATCCCG-3′
EAEC
astA–F
5′-TGCCATCAACACAGTATATCCG-3′
102
astA–R
5′-ACGGCTTTGTAGTCCTTCCAT-3′
aggR–F
5′-ACGCAGAGTTGCCTGATAAAG-3′
400
aggR–R
5′-AATACAGAATCGTCAGCATCAGC-3′
Pic–F
5′-AAATGTCAGTGAACCGACGATTGG-3′
1111
Pic–R
5′-AGCCGTTTCCGCAGAAGCC-3′
通用
uidA–F
5′-AAAGTGTGGGTCAATAATCAGGAAGTG-3′
1487
uidA–R
5′-ATGCCAGTCCAGCGTTTTTGC-3′
18.3 标本处理
刮取营养平板上的过夜新鲜培养物1环~2环,至装有1mL0.85%灭菌生理盐水的Eppendorf管内,混匀。
4℃~8℃,12000r/min离心15min,弃去上清。
沉淀加入100µL灭菌去离子水中,混匀。
100℃煮沸12min,12000r/min离心5min,上清即为PCR扩增模板,可直接用于PCR反应。
18.4 多重PCR
五种致泻大肠埃希氏菌目的基因多重PCR扩增加样体系见表5。
PCR反应条件:
预变性94℃5min。
变性94℃30s,复性63℃30s,延伸72℃1.5min,30个循环。
最后72℃延伸5min。
表5
五种致泻大肠埃希氏菌目的基因多重PCR扩增加样体系
试剂
加样体积(µL)
dH2O
8.3
10×PCRBuffer
2.5
25mMMgCl2
2.5
2.5mMdNTPs
3.0
25µMescV–F
0.4
25µMescV–R
0.4
25µMbfpB–F
0.1
25µMbfpB–R
0.1
25µMstx1A–F
0.2
25µMstx1A–R
0.2
25µMstx2A–F
0.4
25µMstx2A–R
0.4
25µMelt–F
0.1
25µMelt–R
0.1
25µMestIa–F
0.4
25µMestIa–R
0.4
25µMestIb–F
0.2
25µMestIb–R
0.2
25µMinvE–F
0.2
25µMinvE–R
0.2
25µMastA–F
0.4
25µMastA–R
0.4
25µMaggR–F
0.2
25µMaggR–R
0.2
25µMpic–F
0.2
25µMpic–R
0.2
25µMuidA–F
0.2
25µMuidA–R
0.2
3U/µLTaq酶
0.7
DNA模板
2.0
18.5 检测结果的判定
取5µLPCR扩增产物在2%琼脂糖凝胶上电泳。
根据特异性核酸条带大小和数目判断致泻大肠埃希氏菌的种类。
见图2。
图2
种致泻大肠埃希氏菌目的基因多重PCR扩增片段
注:
图中标示EPEC、EHEC(STEC)、ETEC、EIEC、EAEC的泳道为反应体系中仅存在相应的一种模板和12对引物同时扩增后出现的片段,而MIX泳道为将五种致泻大肠埃希氏菌混合后与12对引物同时扩增后出现的片段。
19 血清学鉴定
19.1 挑取PCR扩增阳性菌种,营养平板分离,36℃±1℃培养过夜。
19.2 根据PCR鉴定结果,用相应致病大肠血清O多价、单价、K、H诊断血清进行血清玻片凝集试验进行诊断。
见表6。
表6常见致泻大肠埃希氏菌的O血清群及血清型
婴幼儿腹泻
成人和儿童腹泻
EPEC
ETEC
EIEC
STEC
EAEC
O20O26O44
O6:
K15:
H16O8:
K40:
H9
O28ac
O157:
H7
O9:
K99
O55O86O111
O8:
K25:
H9O8:
H47:
H-
O112
O26:
K62:
H11
O101:
K99
O114O119O125
O11:
H27O15:
H11
O124
O111
O126O127O128
O20:
H-O25:
K7:
H42
O136
O103
O142O158
O25:
K98:
H-O27:
H7
O143
O145
O27:
H20O63:
H12
O144
O104
O73:
H45O78:
H11
O152
O78:
H12O85:
H7
O164
O114:
H21O115:
[H51]1)
O127:
H12O128:
H7
O128:
H21O139:
H28
O148:
H28O149:
H4
O159:
H4O159:
H20
O159:
H34O166:
H27
O169:
H-
注:
1:
无动力的变异
19.3 报告血清学实验结果。
110 生化鉴定
110.1 对PCR阳性、血清学可分型及不可分型菌株进行系统生化鉴定。
110.2 报告最终鉴定结果。
111 菌株保存和上送
4℃或室温保存的半固体培养基保菌菌种至少2套(穿刺接种后36℃培养过夜即可)或30%甘油肉汤冻存管-70℃保存菌株至少2套。
按照要求定期上送。
(五)大肠埃希氏菌O157:
H7检测操作程序
112 范围
本程序规定了粪便标本中大肠埃希氏菌O157:
H7(EscherichiacoliO157:
H7)的检验方法。
113 检验程序
大肠埃希氏菌O157:
H7检验程序见图3。
图3 大肠埃希氏菌O157:
H7检验程序
114 操作步骤
114.1 标本收集
标本包括新鲜的或转移至Cary-Blair运送培养基的粪便或肛拭子。
最优标本是转移至Cary-Blair运送培养基的粪便拭子。
肛拭子不是最佳标本,仅在病人无粪便标本时采用。
肛拭子收集后应当目测,需要在拭子上明显见到粪便。
所采集的标本尽快检验,放入Cary-Blair运送培养基中的标本应在冷藏条件下24h内送检。
新鲜的粪便标本置于清洁、干燥、无肥皂或消毒液残留的容器中,冷藏条件下8h内送检。
114.2 增菌培养
增菌液采用添加20mg/L新生霉素的改良EC肉汤(mEC)。
将采集的一支便拭子1:
10接种于6mLmEC肉汤,36℃±1℃恒温摇床增菌培养6h(如无摇床,36℃±1℃恒温增菌培养9h~12h)。
114.3 大肠埃希氏菌O157:
H7胶体金试纸快速筛查
将胶体金试纸从袋中取出,平放于洁净、干燥的工作台上,编号;
用加样器吸取样品增菌液150µL,加入检测卡一端的加样孔;
2min~20min内读取结果。
阴性样品在视窗上部出现一条单一的红色对照线,这表明试剂已正确流动且检测过程已发生。
阳性样品将显示两条红色带,这表明检出O157抗原。
如果红色条带出现,实验失败,应考虑重做。
114.4 免疫磁珠集菌
将O157胶体金试纸呈阳性的mEC增菌肉汤,进行免疫磁珠集菌。
取下磁铁板,将编好号的1.5mL的Eppendorf离心管,置入DynalMPC-M架上。
轻柔混匀抗O157免疫磁珠(反复颠倒,直到管底沉淀完全消失),吸取抗O157免疫磁珠,置入每只编号的Eppendorf离心管中20µL。
取胶体金试纸阳性增菌培养物1mL,加入上述对应的Eppendorf离心管中。
盖紧盖子。
轻轻颠倒混匀。
置于DynalMX3旋转培养器上,室温下,旋转30min(如果没有旋转器,可人工旋转)。
将磁铁板插入DynalMPC-M管架中,反复颠倒数次,将抗O157免疫磁珠吸附沉淀在Eppendorf离心管壁上。
吸去上清(包括残留在管盖上的液体),并弃掉。
将磁铁板从DynalMPC-M架抽出。
每只Eppendorf离心管中加入1mLPBS-Tween20(PH7.4),轻轻颠倒混匀,重新悬浮免疫磁珠。
重复3.4.5~3.4.6步骤
重复3.4.5步骤。
用50µLPBS-Tween20重新悬浮免疫磁珠细菌混合物。
114.5 接种选择性平板
将50µL免疫磁珠细菌混合物用接种环划线或L棒涂布分别接种于O157:
H7科玛嘉显色平板或山梨醇麦康凯平板(SMAC)各一块,36℃±1℃培养18h~24h;
在SMAC平板上O157:
H7菌落应为扁平、透明或半透明、表面光滑湿润、不发酵山梨醇乳白色菌落,极少部分迟缓发酵山梨醇,呈红色。
边缘光滑,直径约2mm。
在O157:
H7科玛嘉显色培养基上呈淡紫色或紫红色菌落。
114.6 初步鉴定
对疑似菌落染色为革兰阴性杆菌者,在上述平板挑取疑似菌落10~20个,转种克氏双糖(KIA)培养基,36℃±1℃培养16h~20h。
如其生长性状为葡萄糖(+)、乳糖(+)、产气(+)、硫化氢(-)者。
114.7 诊断血清凝集试验
可疑菌株可用大肠埃希氏菌O157抗血清和O157单克隆抗体进行玻片凝集,凝集强度达(+++),再用H7抗血清凝集鉴定。
同时设盐水做对照。
上述,冷冻,真空抽干,并于真空状态下封口保存。
若患者不能自然排除O157:
H7与肠杆菌科的某些菌种存在抗原交叉现象,例如:
弗劳地柠檬酸杆菌、赫尔曼埃希氏菌、沙门氏菌、小肠结肠炎耶尔森氏菌等,一般可通过单克隆抗体解决,但弗劳地枸椽酸杆菌与O157:
H7的O抗原交叉反应用单克隆抗体也无法辨别,只可通过检测O抗原编码基因鉴别。
114.8 API20E生化鉴定试剂盒
采用API20E生化鉴定试剂盒进行鉴定,生化反应编码:
大多为5144172,极少数为1144172或5144162。
115 菌株保存和定期上送
4℃或室温保存的半固体培养基保菌菌种至少2套(穿刺接种后36℃培养过夜即可)或30%甘油肉汤冻存管-70℃保存菌株至少2套。
按照方案要求定期上送。
116 多重PCR毒力基因鉴定
PCR扩增O157、H7编码基因,并且检测stx1、stx2、hly、eae毒力基因。
典型的造成人类感染的大肠埃希氏菌O157:
H7为O157+、H7+,并且携带志贺毒素、溶血素与粘附抹平因子:
stx1+、stx2+、hly+、eae+,我国大部分O157:
H7菌株不携带stx1,为stx1-、stx2+、hly+、eae+。
多重PCR各对引物序列见表7。
表7多重PCR毒力基因鉴定的引物
目标基因
引物序列
片段大小(bp)
stx1
F5'-ATAAATCGCCATTCGTTGACTAC-3'
R5'-AGAACGCCCACTGAGATCATC-3'
180
stx2
F5'-GGCACTGTCTGAAACTGCTCC-3'
R5'-TCGCCAGTTATCTGACATTCT-3'
255
eaeA
F5'-GACCCGGCACAAGCATAAGC-3'
R5'-CCACCTGCAGCAACAAGAGG-3'
384
hlyA
F5'-GCATCATCAAGCGTACGTTCC-3’
R5'-AATGAGCCAAGCTGGTTAAGCT-3’
534
rfbO157
F5'-CGGACATCCATGTGATATGG-3’
R5'-TTGCCTATGTACAGCTAATCC-3’
259
116.1 模板DNA提取:
用热裂解法,将纯化的可疑菌株接种5mL营养肉汤,36℃±1℃培养6h或过夜,10000r/min离心5min,弃上清;加入1mL生理盐水,震荡分散细菌,10000r/min离心5min,弃上清;沉淀加100µL无菌蒸馏水,重新震荡悬浮后置100℃水浴10min;10000r/min离心5min,上清用于PCR扩增。
阳性和阴性对照分别为我们保存的产志贺氏毒素1和2的大肠埃希氏菌O157:
H7和不具备上述6种基因的大肠埃希氏菌,同法制备。
116.2 多重PCR反应体系:
模板DNA提取液5µL,10×PCR缓冲液5µL,分别加终浓度1.5mMMgCl2,0.2mMdNTP,每种引物500nM,TaqDNA聚合酶1.5µL,最后加无菌蒸馏水至总体积50µL。
116.3 多重PCR反应条件:
除变性温度由95℃改为94℃和增加最后72℃延伸外,均按Paton法。
1~10循环,94℃1min变性;65℃2min退火;72℃1.5min延伸。
11~25循环,94℃1min;60℃2min;72℃1.5min。
26~35循环,94℃1min;65℃2min;72℃2.5min。
最后72℃10min。
116.4 扩增产物用含EB(0.5μg/mL)的2%琼脂糖电泳,阳阴性对照正常,紫外灯下观察结果,照相记录。
(六)副溶血性弧菌检验操作程序
117 范围
本程序规定了粪便标本中副溶血性弧菌(Vibrioparahaemolyticus)的检验方法。
118 检验程序
副溶血性弧菌检验程序见图4。
图4 副溶血性弧菌检验程序
119 操作步骤