化学水处理技术操作规.docx
《化学水处理技术操作规.docx》由会员分享,可在线阅读,更多相关《化学水处理技术操作规.docx(22页珍藏版)》请在冰豆网上搜索。
化学水处理技术操作规
化学水处理技术操作
规 程
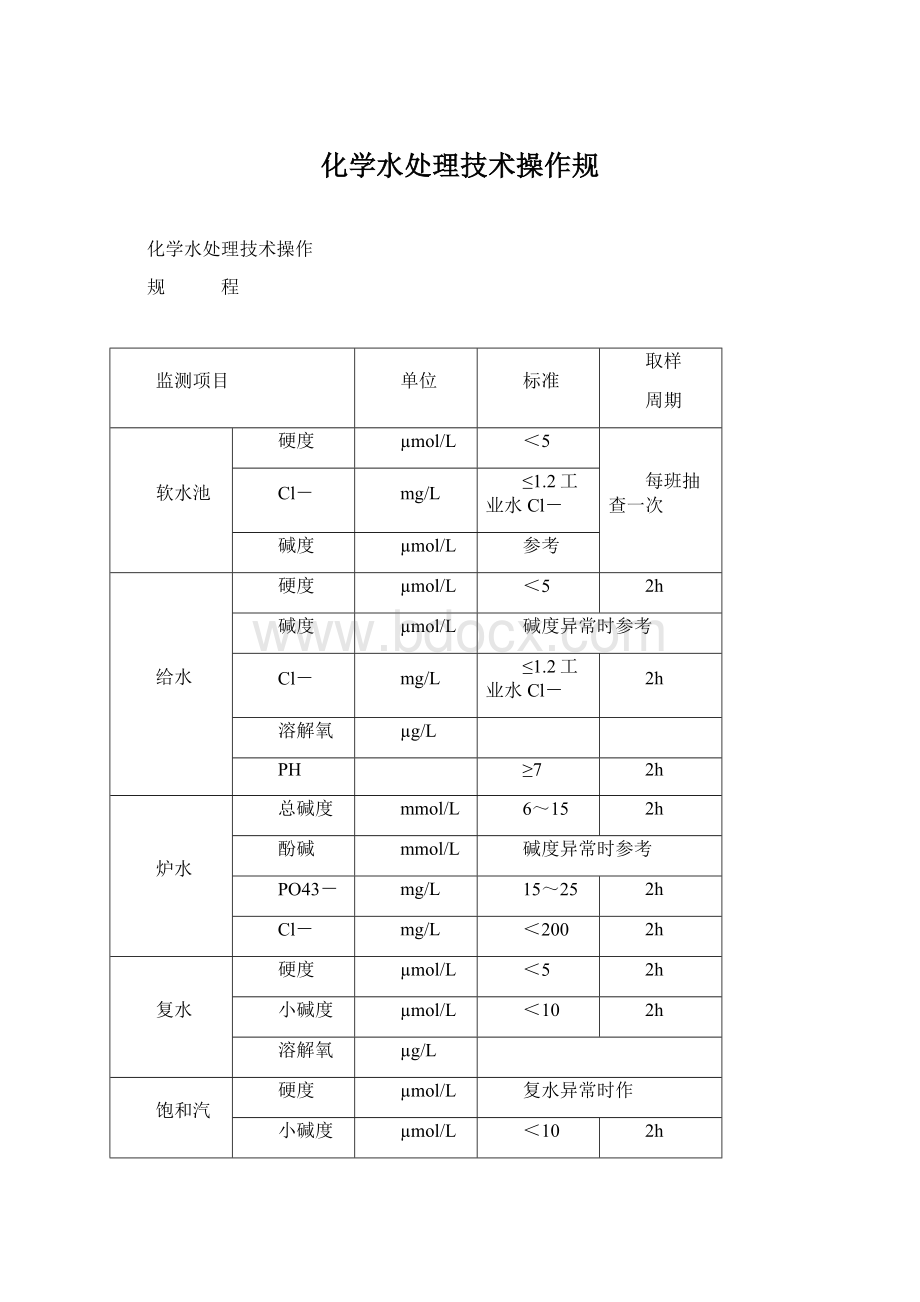
监测项目
单位
标准
取样
周期
软水池
硬度
µmol/L
<5
每班抽查一次
Cl-
mg/L
≤1.2工业水Cl-
碱度
µmol/L
参考
给水
硬度
µmol/L
<5
2h
碱度
µmol/L
碱度异常时参考
Cl-
mg/L
≤1.2工业水Cl-
2h
溶解氧
µg/L
PH
≥7
2h
炉水
总碱度
mmol/L
6~15
2h
酚碱
mmol/L
碱度异常时参考
PO43-
mg/L
15~25
2h
Cl-
mg/L
<200
2h
复水
硬度
µmol/L
<5
2h
小碱度
µmol/L
<10
2h
溶解氧
µg/L
饱和汽
硬度
µmol/L
复水异常时作
小碱度
µmol/L
<10
2h
过热蒸汽
小碱度
µmol/L
<10
2h
硬度
µmol/L
复水异常时作
汽水质量标准
第一章汽水汽水质量标准与化验方法
一、给水化验方法
1、硬度:
(EDTA法):
取100毫升透明水样于250毫升三角瓶中加入2%的(氨—氯化铵缓冲溶液)⑴3—5毫升,再加入酸性铬兰⑵K3~5滴,用0.01mol/L⑶特利隆(EDTA)标准液滴定到由红色变成紫红色为终点。
计算:
硬度(微摩尔/升)=
当水样为100ml,微量滴定管lml=100小格,则此硬度等于耗EDTA的小格数。
注意事项:
a、滴定时应慢慢加入EDTA,并剧烈摇动。
b、水样温度须控制在30℃左右,防止假终点。
c、为防止Cu2+及其他离子干扰需加Na2S⑷两滴。
d、本法须在氨性溶液PH=10~10.5来滴定。
2、小碱度的化验方法:
取100毫升蒸汽样水注入250毫升三角瓶中,放在电炉上加热沸腾5~7分钟(余水样余原有的2/3)时取下置于冷却水槽中冷至恒温,加入混合指示剂⑷5滴,用0.01mol/L
H2SO4⑸滴定至紫灰色。
小碱度(μmol/L)=
注意事项:
a、一定要遵守加热时间和冷却要求,否则影响结果。
b、在做蒸汽小碱度时,禁止盐酸瓶及倒酸影响化验结果。
c、混合指示剂规定每周至少更换一次。
d、蒸汽煮沸时间,不应少于5分钟。
但也不应过长,否则影响蒸汽碱度结果。
4、Cl-化验方法:
取样水100ml250ml三角瓶中,加p=5%铬酸钾⑹指示剂1ml,以1mgCl-/ml的AgNO3⑺滴定至浅棕红色为终点。
计算方法:
Cl-(mg/L)=(耗AgNO3毫升数/100)×1000
注意事项:
a、若水样呈碱性,必须先用0.1mol/L⑽酸中和,
b、若水样中呈有酸性必级用0.1mol/L碱⑾中和,
c、溶液温度越高铬酸银溶得越多,结果不准确,故必须将其冷却至室温再化验。
测定炉水时必须将其先冷却后再化验。
酚酞碱度:
取滤清的水样100ml于250ml三角瓶中,加2~3滴1%酚酞⑸以0.01mol/L
H2SO4⑹滴定至由红色为转为无色为终点。
计算方法:
一、炉水化验方法
1、总碱度:
取100毫升蒸汽样水注入250毫升三角瓶中,置于冷却水槽中冷至恒温,水样中加2~3滴1%甲基橙⑻(用0.1~0.01mol/L
H2SO4滴定)至由橙黄色为转为橙红色为终点。
碱度(毫摩尔/升)=
2、酚酞碱度:
取100毫升蒸汽样水注入250毫升三角瓶中,置于冷却水槽中冷至恒温,水样中加2~3滴酚酞⑼(用0.1~0.01mol/L
H2SO4滴定)至由绿色为转为紫恢色为终点。
碱度(毫摩尔/升)=
3、Cl-:
同给水。
4、PO43-:
取炉水(混浊时应滤清)5毫升于25毫升比色管中,以蒸馏水稀释至刻度,加酸性钼酸铵⑽0.5毫升混匀,加氯化亚锡⑾3滴混合均匀,放置2~3分钟与标准色进行比色。
标准色的配制:
取0.05毫克/毫升磷酸根⑿的KH2PO40.1ml、0.5ml、0.75ml、1.25ml、1.5ml标准液于比色管中,以蒸馏水稀释至刻度,加酸性钼酸铵0.5毫升混匀,加氯化亚锡3滴混合均匀,放置2~3分钟与标准色进行比色。
计算方法:
待测PO43-(毫克/升)=
=
=10×相当于标准色毫升数
注意事项:
a、测定炉水内磷酸根时,必须过滤至清,否则结果不正确。
b、氯化亚锡存于棕色瓶内,不可一次配得很多,应每天配一次。
c、在做此项化验之前,必须先把手洗干净。
三、复水化验方法
1、硬度:
同给水。
2、小碱度:
同给水。
3、溶解氧:
四、蒸汽化验方法
1、硬度:
同给水。
2、小碱度:
同给水。
第二章汽水取样规程
1、取样瓶须洁净,不附着脏物及不呈碱性或酸性方可使用。
2、取样管及取样瓶,须有标记。
3、取样时应将取样水把瓶冲洗数次后再取样。
4、取样管应保持小水量常流,每天白班早上第一次取样前应把取样门大开20秒左右后调节水流,水流稳定后再取样。
5、取样时不可用外部脏物及其它水溅入瓶内。
6、各种水及汽水的取样瓶不可乱用。
7、水样温度应为30~40℃
8化验不合格后应立即再取样,重新化验一次,结果仍不合格再与班长查找原因。
第三章炉内水处理
1、炉内水处理原理
锅炉水中加入Na3PO4·12H2O能与补给水中的残余钙镁硬度相作用即生成松软的分散水渣,碱性磷灰石Ca10(OH)2(PO4)6此类物质不粘附在受热面上,而随底部排污排掉。
反应式:
10Ca2++6PO43-+2OH-=Ca10(OH)2(PO4)6↓
3Mg2+=2Si32-+2OH-+H2O
=3MgO·2SiO2·2H2O↓
2 锅炉排污
2.1 排污目的:
A、表面排污(或叫连续排污)是为了排除汽鼓水表面的悬浮物、油类及盐分,达到保持炉水水质在标准范围内和保证蒸汽品质的目。
由化验岗位负责。
如需大量排污应停止加磷酸三钠。
表面排污(或叫连续排污)阀门应常开,大小根据化验指标控制。
B、底部排污(或叫定期排污)是为了排除炉内沉淀物、水渣及腐蚀产物,达到不使管路及下联箱堵塞的目的。
由锅炉工负责。
C、只要炉水的氯根或碱度其中一样超标,都要开排污,如果增大开连续排污门还下不来,则应开定排帮助。
D、排污率的计算:
排污率(%)=
在计算时应注意:
a、因化验两种碱度使用不同的指示剂,在算完给水碱度的平均值后加上40(经验值)才是平均给水碱度。
每天22时的样化验完后即可算出一天的平均值。
b、两种碱度单位不一样,计算出的平均炉水碱度×1000才变成µmol/L或算出平均给水碱度后÷1000才变成mmol/L,单位统一后才能计算排污率。
分段锅炉炉水碱度只算盐段的平均值。
第四章水的沉淀处理
将水中杂质转化为沉淀物而析出的各种方法,统称为沉淀处理。
沉淀处理的内容包括悬浮物的自然沉降、混凝处理和沉淀软化。
水中含有的悬浮物和胶体,如不首先除去,则会引起管道堵塞、泵与测量装置擦伤、各种配件磨损,以致影响到后阶段水处理工艺中离子交换器的正常运行,如,使其交换容量降低,有时还会使出水水质变坏。
所以在水处理工艺中,应首先清除水中悬浮物和胶体。
一、水的沉淀处理
沉淀软化处理的方法是:
将天然水中的钙、镁离子转化为难溶于水的化合物沉淀析出,达到降低水的硬度的目的。
最常用的沉淀软化处理的方法是,加石灰使水中的钙镁离子分别化合成难溶于水的碳酸钙和氢氧化镁析出。
1.石灰软化沉淀处理的原理
水的石灰软化处理的实质是:
在水中加人氧化钙后,水的pH值增大,因而使水中原有的碳酸平衡向生成的方向移动,即有
H2O+CO2 H++HCO3- 2H+CO32-
H++OH- H2O
由上式可看出,水中保持一定的OH—浓度的条件下,原水中的钙镁碳酸化合物就相应地转化为难溶的CaCO3和Mg(OH)2沉淀析出。
石灰软化剂处理时,所投加的Ca(OH)2与水中的各种不同的碳酸化合物先后发生作用,其反应式为
Ca(OH)2+CO2→CaCO3↓+H2O
Ca(OH)2+Ca(HCO3)2→CaCO3↓+H2O
Ca(OH)2+Mg(HCO3)2→CaCO3↓+Mg(CO)2+H2O
第五章汽、水化验的一般规定
1试剂等级:
无特殊注明者均为二级试剂:
2蒸馏水:
除在本方法中指定的氢离子交换水和无盐水外一律为电导率低于3μS/cm的蒸馏水。
3空白试验:
进行空白试验时,至少应平行做二份试验,所用的分析方法、试剂的用量,应和样品的规定完全一致。
4蒸发浓缩:
溶液体积大时,可先在低温电炉和电热板上进行,体积小时必须在水浴上进行。
5、恒重:
在一般情况下为最后两次称量之差,不大于0.4毫克,如本方法中另有规定者不在此限。
6、溶液:
本方法中无特殊规定者均指水溶液。
第六章水样采集方法
1采样前先将采样瓶彻底洗干净,采样时用水样冲洗采样瓶至少三次,采样后迅速将瓶塞盖上。
2采样时水样的流速应保持稳定,其流量应为每分钟500~700毫升,蒸汽样品应根据设计流速采样。
3给水、炉水和蒸汽的样品应保持常流,其他水样在采样前,应先把管道中的积水放尽后方能采集。
4水样采集数量,应满足分析和复核的要求。
5作控制试验水佯,要使用固定的采样瓶。
6水样采集后应尽快分析不宜存放。
标准液的配制与标定
⑴、2%氨—氯化铵缓冲溶液:
按称取20克氯化氨,加入100毫升氨水(浓氨水,0.90克/升),稀释成1000毫升。
⑵、0.5%酸性铬兰K:
称0.5克酸性铬兰K(C18H9O12S3Na3),加10毫升氨缓冲液,加40毫升无盐水,用96%乙醇稀至100ml。
⑶、0.1和0.01mol/L1/2EDTA的配制和标定
1、称取在800摄氏的马弗炉中到灼烧至恒重(30-40分钟)(准确至0.0002克)的氧化锌2克,用少许水(蒸馏水)湿润,加入1:
1的盐酸使氧化锌溶解。
(1:
1的盐酸是1体积浓盐酸和1体积水相混合),移入500毫升的容量瓶中,用蒸馏水稀释至刻度。
摇匀。
2、10%的氨缓冲液:
按10毫升稀释成25毫升的比例。
3、2%氨—氯化铵缓冲溶液:
按称取20克氯化氨,加入100毫升氨水(浓氨水,0.90克/升),稀释成1000毫升。
4、酸性铬兰K:
称取0.5克酸性铬兰K,加10毫升氨缓冲液,加40毫升无盐水,用96%的乙醇稀释至100毫升。
5、铬黑T指示剂:
称取0.5克铬黑T与4.5克盐酸羟胺混合后,加入10毫升氨缓冲液,用96%乙醇溶解稀释至10毫升。
6、0.1mol/L1/2EDTA的配制(EDTA即乙二胺四乙酸二钠分子量为372.26)
6.1、称取18.613克特利隆,用蒸馏水溶解并稀释至1000毫升。
7、标定:
7.1、取上面配制氧化锌20毫升,加入80毫升除盐水(蒸馏水或软化水),用10%的氨水溶液中和至PH为7-8,加5毫升缓冲液(2%氨—氯化铵缓冲溶液)中和至PH=10,加5滴酸性铬兰K,用0.1mol/L1/2EDTA滴定至溶液由紫红色变为纯蓝色。
7.2、计算:
C=m/(V*M)*20/500=0.04m/V*40.6895
式中:
C--------------标定的EDTA标准溶液的浓度mol/L
40.6895---1/2氧化锌的摩尔质量mg/mmol
m----氧化锌的质量mg
V-----滴定时消耗EDTA标准溶液的体积mL
0.04—500毫升中取20毫升滴定,相当于m的0.04倍
ZnO+2HCl=2Cl一+Zn2一+H2O
(20mLZnO溶液中的1/2Zn2一量为{(2g×65/81)/40.6895g/mmol}×20/500=1.6umol)
8、0.01mol/L1/2EDTA的配制:
取0.1mol/L1/2EDTA的溶液稀释10倍即可。
⑷、混合指示剂:
取0.085克亚甲基兰溶于50毫升酒精(96%)中再取0.125克甲基红溶于50毫升酒精中,全部溶尽后,可混合成100毫升溶液(可用乳钵磨细)。
⑸、(0.1mol/L1/2H2SO4)1、浓硫酸(密度:
1.84g/cm3)。
2、无水碳酸钠(基准试剂)。
3、(0.1mol/L1/2H2SO4):
3.1、量取3毫升浓硫酸(1.84g/cm3)缓缓注入1000毫升蒸馏水(或除盐水)中,摇匀。
3毫升浓硫酸(1.84g/cm3)所含1/2H2SO4的量为
(3mL×1.84g/mL×0.98/50g/mol)=0.1082mol
4、标定:
4.1、称取在270—300度灼烧(30-50分钟)至恒重0.2克(准确至0.0002g)的基准无水碳酸钠,溶于50毫升水中,加入2滴混合指示剂(甲基红—亚甲基蓝),用待标定的硫酸(0.1mol/L1/2H2SO4)溶液滴定至绿色变为紫色。
计算:
C=m/V*52.99
式中:
C---硫酸标准溶液的浓度mol/mL(1/2H2SO4)
m—碳酸钠物质的质量g
V---滴定碳酸钠消耗硫酸标准溶液的体积mL
55.99---1/2Na2CO3的摩尔质量,g/mol
Na2CO3+H2O=2Na一+CO32-
CO32-+H+→HCO3-
HCO3-+H+→H2O+CO2↑
0.2克无水碳酸钠中和成水所需/12H+量为
(0.2×60/106)/30=3.7736mmol
(0.01mol/L1/2H2SO4)用上述配好的硫酸稀释10倍即可。
⑹、5%铬酸钾溶液:
取50克化学纯铬酸钾用少量蒸馏水稀释,溶解,加入硝酸银溶液至刚生成红色沉淀为止,放一昼夜,过滤;用水稀至1000毫升。
⑺、(1mL相当于1mg氯离子,下面我们简写成1mL=1mgCl-)
1、称取5.0克硝酸银溶于1000毫升蒸馏水中,以氯化钠标准溶液标定。
AgNO3+H2O=Ag一+NO3一;5gAgNO3所含Ag一量为
(5g×108/170)/108g/mol=0.0294mol=3.1765g
2、氯化钠标准溶液(1mL=1mgCl-):
取基准氯化钠3—4克置于瓷坩埚内,于500度灼烧10分钟,然后放入干燥器内冷却至室温,准确称取1.649克氯化钠溶于少量蒸馏水,然后稀释至1000毫升。
NaCl+H2O=Na一+Cl一
1.649克氯化钠所含Cl一量为
(1.649g×34.5/57.5)/34.5g/mol=0.02868mol=0.9894g
3、于三角瓶中,用移液管注入10毫升氯化钠标准液,再加入90毫升蒸馏水稀释,及1毫升10%铬酸钾指示剂,用硝酸银标准溶液滴定至橙色。
4、硝酸银浓度T(mgCl-/mL)按下式计算:
T=10*1/V
式中:
V---氯化钠标准溶液消耗硝酸银标准溶液的体积,毫升。
10----氯化钠标准的体积,毫升。
1---氯化钠标准溶液的浓度,毫克/毫升。
最后调整硝酸溶液浓度,使其成为1mL相当于1mg氯离子。
NaCl+AgNO3→AgCl↓+NaNO3
Cl一与Ag一 的质量化合比为108/34.5=3.13≈3.1765/0.9894
⑻、甲基橙0.1%:
取0.1克甲基橙用水稀至1000毫升,并过滤。
⑼、1%酚酞:
取1克酚酞溶于80%酒精80毫升,用水稀至100毫升。
⑽、钼酸铵:
取10克钼酸铵,溶于100毫升水中,另配体积比1:
1浓度98%H2SO4300毫升冷却后,将钼酸铵溶液倒入硫酸溶液中。
钼酸铵[(NH4)6MoO24]
PO43-+12(NH4)2MoO4+27H+→[P(Mo2O7)6]+24NH4++10H2O
⑾、氯化亚锡:
取氯化亚锡(SnCl2)1克溶于15毫升化学纯盐酸中以防其氧化,溶解并待溶液澄清后,用水稀至60毫升(每天配一次。
为节约用药,可按比例减半配制)。
⑿、磷酸根标准液(0.05毫克PO43-/mL):
精称在105℃干燥的磷酸二氢钾0.1433克,同少量蒸馏水溶解后,在容量瓶中,稀至2000毫升。
0.1433克KH2PO4所含PO43-质量数为
0.1433g×79/120.1=0.09426g、每毫升含PO43-质量数为
0.09426g/2000mL=0.04713mg/mL
②钙红指示剂:
取1克钙红与100克NaCl研磨混匀。
0.1mol/L氢氧化钠(或KOH)的配制与标定
称取NaOH40克或KOH56克,以沸后冷却之蒸馏水溶解至1000ml此溶液浓度约为lmol/L。
然后取100ml稀至1000ml此液约为0.1mol/L。
a、0.1mol/L邻苯二甲酸氢钾标准液:
将邻苯二甲酸氢钾于105℃烘箱内烘30分钟,于干燥器内冷却,称取5.1055克置于容量瓶中,溶解稀至250ml。
b、标定:
吸取20ml邻苯二钾酸氢钾注入三角瓶,加80ml蒸馏水和二滴酚酞指示剂,用NaOH滴至微红色,标定三次,取平均值,然后调整浓度系数K=1.0000。
吸取20mlNaOH标准液注入三角瓶中,加80ml蒸馏水,加2~3滴甲基橙,用硫酸滴至由橙黄变为橙红色为终点。
然后调整浓度系数,使K=1.00000
浓度系数的调整
若需配制成浓度系数为1(K≈1.0000)的标准溶液,可在标定后,用添加蒸馏水,浓溶液或固体药品的方法进行调整。
a、当K>1时,添加蒸馏水可按下式计算。
V水=V(K-1)
式中:
V水――需加蒸馏水量,毫升。
V――调整前规定液体积(毫升)。
b、当K<1时,需加浓液按下式计算:
V2=
式中:
C1——欲配规定液的量浓度。
C2——所取浓液的量浓度。
V——调整前规定液体积,毫升。
C——调整前规定液的量浓度。
V2——所取浓液的体积,毫升。
c、当K<1时,需加标准药重量计算:
取标准药克数=(C1—C2)V×毫摩尔质量
式中:
Cl——欲配规定液的量浓量。
V2――调整前规定液的量浓度。
V——调整前规定液体积。
溶液
物质以分子、原子或离子状态分散于另一种物质中所构成的均匀而又稳定的体系叫溶液。
溶液有液态溶液、气态溶液、固态溶液,其中液态溶液有三种类型:
气-液、固-液和液-液。
水溶液是我们最常见的一种以水为溶剂的溶液,下面作为重点进行介绍。
第一节 溶液浓度及计算
一、溶液浓度的表示方法
1、质量百分浓度
每100份质量的溶液里所含溶质的质量份数称为该溶液的百分浓度,用百分数(%)表示。
溶液的百分比浓度(%)=
2、摩尔分数
溶质的摩尔分数(
)=
摩尔分数通常用小数表示。
溶质的摩尔分数和溶剂的摩尔分数之和等于1。
3、物质的量浓度
摩尔是国际单位制中的基本单位,用来表示物质的量。
如果一个物系中所含物质的基本原体的数目为6.022×1023个时,那么这个数量就叫做1个摩尔,符号是n,单位是mol。
摩尔的基本原体可以是分子、原子、离子、电子和粒子。
1mol物质的质量称为“摩尔质量”,单位常用g/mol表示。
任何元素原子的摩尔质量单位为g/mol时,数值上等于其原子量。
同理可以推广到分子、离子等微粒。
物质的量、质量和摩尔质量三者的关系为
=物质的量(mol)
用1L溶液中所含溶质的物质的量来表示的浓度称为物质的量浓度,符号为“c”,单位为mol/L。
4、质量浓度
溶质或成分质量除以混合物的体积,即为质量浓度。
符号是p,单位是g/L。
小硬度测定
原理:
水中钙离子与镁离子能与乙二胺四醋酸二钠(EDTA)化合生成稳定的复盐特利隆钙及特利隆镁。
因此选用遇钙、镁离子显色的酸性铬兰K为指示剂;用EDTA来滴定钙、镁盐类。
小碱度测定
原理:
蒸汽经冷却器蛇形管。
凝结成水经加热除去氨及二氧化碳,冷却后加混合指示剂,用0.01mol/L
H2SO4滴定,使H2SO4与水中碱起反应,使溶液由绿色变为紫灰色为终点。
复水及给水碱度亦用此法化验,但水样不必加热。
1碱度:
水中的碱度主要是由于水中所含的重碳酸盐、碳酸盐或氢氧化物以及偶然存在于水中的磷酸盐、硅酸盐等形式。
2原理:
以甲基橙为指示剂,用0.1mol/L
H2SO4滴定与水中氢氧化物、碳酸盐、磷酸酸盐等作用,而这些物质由于其碱性强弱不同,所以用酸滴定时反应不同,分述如下:
3、以酚酞为指示剂滴至终点时,水中碱度与酸的反应:
a、OH-+H+=→H2O
b、CO32-+H+→HCO3-
c、PO43-+H+→HPO42-
d、SiO32-+2H+→SiO2+H2O
4、 滴定到酚酞终点后加入甲基橙,继续用酸滴定到终点反应:
a、HCO3-+H+→H2O+CO2↑
b、HPO42-+H+→H2PO4-
c、腐植酸盐+H+→腐植酸+金属离子
5、试验方法:
取滤清的水样50ml(炉水)或100ml(给水)于250ml三角瓶中,加甲基橙2滴以0.1mol/L
H2SO4滴定至由橙黄色为转为橙红色为终点。
6、计算方法:
碱度(毫摩尔/升)
=
碱度(微摩尔/升)
=
当水样为100ml时,碱度(mmol/L)等于耗酸毫升数。
当水样为50ml时,碱度等于耗酸毫升数×2。
7、OH-=酚酞碱度-甲基橙碱度(此碱度非全碱度)
氯根测定法
1 原理:
此法基于中性水中,氯离子与硝酸根作用,生成氯化银白色沉淀,过剩的硝酸银与铬酸钾指示剂作用生成棕红色的铬酸银沉淀。
反应式:
NaCl+AgNO3→AgCl↓+NaNO3
K2CrO4+2AgNO3→Ag2CrO4↓+2KNO3
因碱与铬酸银起下列反应,使终点不明显。
反应式
AgCrO4+2NaOH=2AgOH↓+Na2CrO4
而:
2AgOH→Ag2O↓+H2O
因酸与铬酸银起下列反应,使终点不明显。
反应式:
Ag2CrO4+H2SO4→Ag2SO4+H2CrO4
H2CrO4→CrO3+H2O
磷酸根测定(比色法)
1、 原理:
在酸性溶液中磷酸根与钼酸铵作用生成磷钼复盐,用氯化亚锡来还原生成钼兰,故兰色的深浅与磷酸根的浓度成正比。
反应式:
PO43-+12(NH4)2MoO4+27H+→[P(Mo2O7)6]+24NH4+
+10H2O
第九节碱度的测定(容量法)
1概要:
当量浓度(毫摩尔/升)表示的水中氢氧根离子和其他弱酸阴离子的总浓度,叫做水的碱度。
随着这些阴离子浓度的不同,碱度可分氢氧根碱度,碳酸盐碱度,重碳酸盐碱度等(其中OH-与HCO3-不能共存)。
碱度是用酸中和的方法测定的,随指示剂不同分为酚酞碱度和甲基橙碱度。
3.7.11.2试剂
a、1%酚酞指示剂。
b、0.1%甲基橙指示剂。
c、混合指示剂(甲基红-亚甲基兰)。
d、0.1mol/L
H2SO4。
3.7.11.3测定手续:
取100ml水样于三角瓶中,加2~3滴酚酞,如呈红色用0.1mol/L
H2SO4滴定至无色,记耗量P,再加入2滴甲基橙,用0.1mol/L
H2SO4继续滴定至橙红色。
记第二次耗量M。
3.7.11.4 计算
P(mmol/L)=
M(mmol/L)=
(P为酚酞碱度,M为甲基橙碱度。
)
总碱度=P+M
第十节硬度的测定(铬合滴定法)
1概要:
水中钙镁离子的总浓度为水的硬度。
本法基于兰色的铬黑T能与钙镁离子能生成较不稳定的红色络合物。
EDTA能与络合物中的钙镁生成稳定的复盐,使溶液颜色发生变化。
2、试剂:
a、2%NH4OH-N