备战高考化学专题复习高无机综合推断的综合题附答案.docx
《备战高考化学专题复习高无机综合推断的综合题附答案.docx》由会员分享,可在线阅读,更多相关《备战高考化学专题复习高无机综合推断的综合题附答案.docx(14页珍藏版)》请在冰豆网上搜索。
备战高考化学专题复习高无机综合推断的综合题附答案
2020-2021备战高考化学专题复习高无机综合推断的综合题附答案
一、无机综合推断
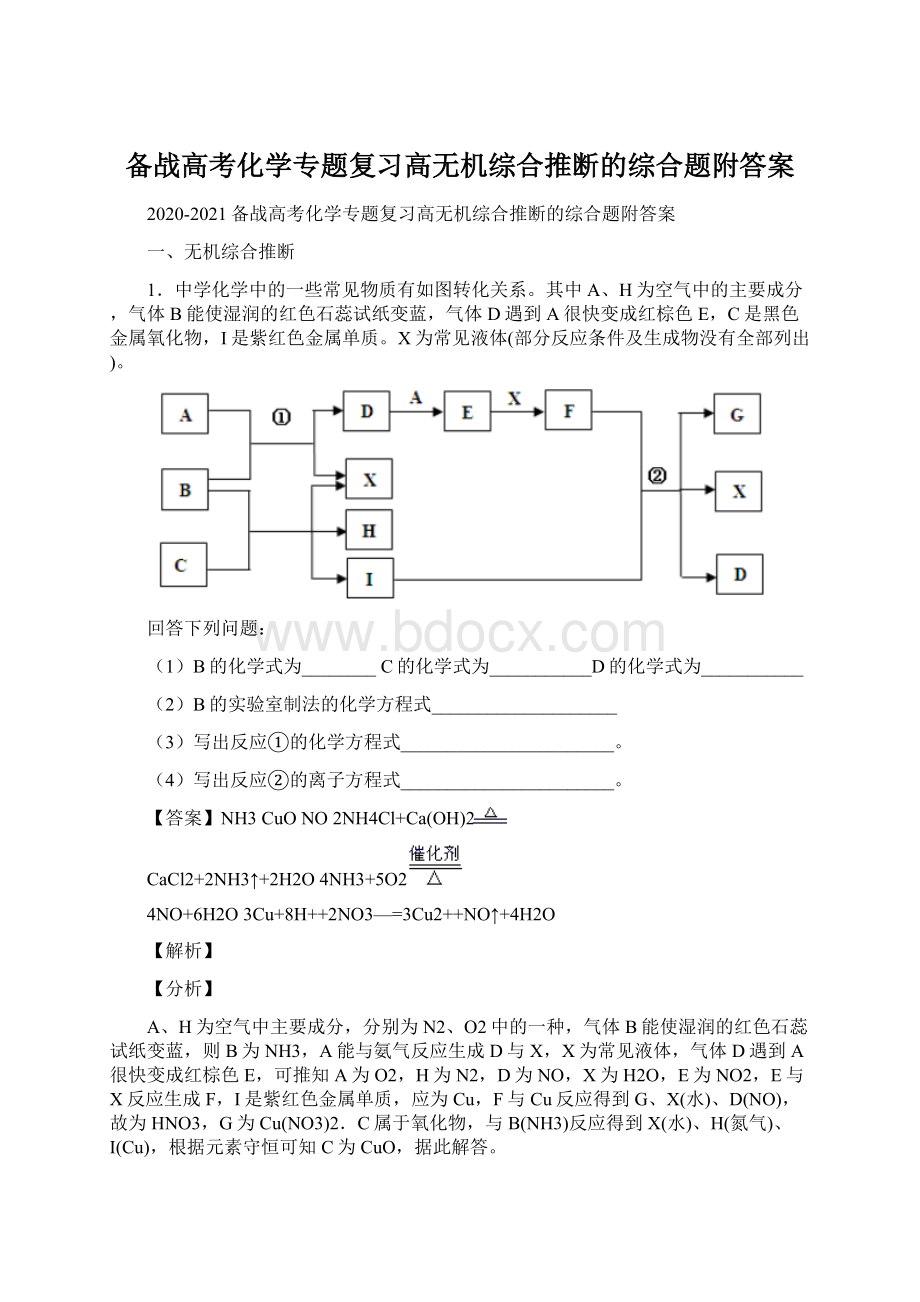
1.中学化学中的一些常见物质有如图转化关系。
其中A、H为空气中的主要成分,气体B能使湿润的红色石蕊试纸变蓝,气体D遇到A很快变成红棕色E,C是黑色金属氧化物,I是紫红色金属单质。
X为常见液体(部分反应条件及生成物没有全部列出)。
回答下列问题:
(1)B的化学式为________C的化学式为___________D的化学式为___________
(2)B的实验室制法的化学方程式____________________
(3)写出反应①的化学方程式_______________________。
(4)写出反应②的离子方程式_______________________。
【答案】NH3CuONO2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O4NH3+5O2
4NO+6H2O3Cu+8H++2NO3—=3Cu2++NO↑+4H2O
【解析】
【分析】
A、H为空气中主要成分,分别为N2、O2中的一种,气体B能使湿润的红色石蕊试纸变蓝,则B为NH3,A能与氨气反应生成D与X,X为常见液体,气体D遇到A很快变成红棕色E,可推知A为O2,H为N2,D为NO,X为H2O,E为NO2,E与X反应生成F,I是紫红色金属单质,应为Cu,F与Cu反应得到G、X(水)、D(NO),故为HNO3,G为Cu(NO3)2.C属于氧化物,与B(NH3)反应得到X(水)、H(氮气)、I(Cu),根据元素守恒可知C为CuO,据此解答。
【详解】
A、H为空气中主要成分,分别为N2、O2中的一种,气体B能使湿润的红色石蕊试纸变蓝,则B为NH3,A能与氨气反应生成D与X,X为常见液体,气体D遇到A很快变成红棕色E,可推知A为O2,H为N2,D为NO,X为H2O,E为NO2,E与X反应生成F,I是紫红色金属单质,应为Cu,F与Cu反应得到G、X(水)、D(NO),故为HNO3,G为Cu(NO3)2.C属于氧化物,与B(NH3)反应得到X(水)、H(氮气)、I(Cu),根据元素守恒可知C为CuO;
(1)由上述分析可知,B的化学式为NH3;C的化学式为CuO;D的化学式为NO;
(2)实验室利用氯化铵和氢氧化钙固体混合加热制NH3,发生反应的化学方程式为2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
(3)反应①为氨的催化氧化,发生反应的化学方程式为4NH3+5O2
4NO+6H2O;
(4)反应②为Cu溶于稀硝酸生成NO,发生反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。
【点睛】
此类题的解答一般有以下步骤:
思维起点的选择:
思维起点是指开始时的思维指向、思维对象或思维角度,推断题中的思维起点应是最具特征的某个条件(包括文字叙述或某个变化过程);思维过程的展开:
解题者在确定思维起点的基础上,利用题目所给信息,结合已有的化学知识和解题经验,不断地缩小问题状态与目标状态的距离;思维过程的检验:
将上述思维过程的结果代入题中,检查一下是否符合题中条件。
2.无机化合物X与Y均由三种相同短周期的非金属元素组成(X比Y的相对分子质量大),常温下均为无色液体,易水解,均产生酸性白雾。
取1.35gX与足量水完全反应,向反应后的溶液中滴加1.00mol·L-1的NaOH溶液40.0mL恰好反应,溶液呈中性,继续滴加BaCl2溶液至过量,产生不溶于稀盐酸的2.33g白色沉淀。
Y水解得到两种产物,其物质的量之比1:
2,且产物之一能使品红溶液褪色。
请回答:
(1)X的化学式______________。
白色沉淀属于_____________(填“强”、“弱”或“非”)电解质。
(2)Y与水反应的化学方程式_________________。
(3)二元化合物Z能与X化合生成Y。
一定条件下,0.030molZ与足量氨反应生成0.92gA(原子个数之比1:
1,其相对分子量为184)和淡黄色单质B及离子化合物M,且M的水溶液的pH<7。
将0.92gA隔绝空气加强热可得到0.64gB和气体单质C。
①写出Z与足量氨反应的化学方程式____________。
②亚硝酸钠和M固体在加热条件下_____________(填“可能”或“不能”)发生反应,判断理由是_________________。
③请设计检验离子化合物M中阳离子的实验方案:
_________________。
【答案】SO2Cl2或SCl2O2强SOCl2+H2O=2HC1+SO2↑6SCl2+16NH3=S4N4+2S+12NH4Cl可能NaNO2中N元素化合价为+3价,NH4C1中N元素化合价为-3价,发生氧化还原反应生成N2取少量M固体加水溶解,加入浓NaOH溶液加热,若产生能使湿润的红色石蕊试纸变蓝的气体,则证明有NH4+
【解析】
【分析】
X、Y常温下为无色液体,且水解产生白雾,证明产生氯化氢,1.35gX的水解产物能与0.04mol的NaOH,恰好完全反应,滴加氯化钡能产生难溶于酸的沉淀,则产生0.01mol的硫酸钡沉淀,Y的水解产物能使品红褪色,有二氧化硫产生,1.35gX中含有S:
0.01mol,Cl:
0.02mol,则氧元素的物质的量是(1.35g-0.32g-0.71g)÷16g/mol=0.02mol,故X为SO2Cl2;Y水解得到两种产物,其物质的量之比1:
2,且产物之一能使品红溶液褪色,因此Y为SOCl2;二元化合物Z能与X化合生成Y。
一定条件下,0.030molZ与足量氨反应生成0.92gA(物质的量是0.005mol)和淡黄色单质B及离子化合物M,且M的水溶液的pH<7,所以淡黄色固体B为S,M为氯化铵,0.92gA(原子个数之比1:
1,其相对分子量为184)隔绝空气加强热可得到0.64gB和气体单质C,可知气体C为氮气,0.64g单质硫的物质的量是0.02mol,根据质量守恒定律可知氮气的质量是0.92g-0.64g=0.28g,则氮原子的物质的量是0.02mol,所以由元素守恒可知Z为S4N4。
据此解答。
【详解】
(1)由分析可知X为SO2Cl2;白色沉淀为硫酸钡,为强电解质,故答案为:
SO2Cl2,强;
(2)Y与水反应的化学方程式:
SOCl2+H2O=2HC1+SO2↑;
(3)①Z与足量氨反应的化学方程式为:
6SCl2+16NH3=S4N4+2S+12NH4Cl;
②亚硝酸钠和M固体在加热条件下可能发生反应,NaNO2中N元素化合价为+3价,NH4C1中N元素化合价为-3价,发生氧化还原反应生成N2;
③检验M中的阳离子即检验铵根离子,方法为:
取少量M固体加水溶解,加入浓NaOH溶液加热,若产生能使湿润的红色石蕊试纸变蓝的气体,则证明有NH4+。
3.已知A为金属单质,它们之间能发生如下反应(部分产物未标出)
请根据以上信息回答下列问题:
(1)写出物质B的化学式:
___________
(2)写出下列反应的化学方程式:
反应①______________________________________________________________________
反应②______________________________________________________________________
(3)写出下列反应的离子方程式:
反应C→D______________________________________________________________________
反应D→C_____________________________________________________________________
(4)检验D中阳离子的方法:
_________________________________________________________
【答案】Fe3O44Fe(OH)2+O2+2H2O===4Fe(OH)33Fe+4H2O(g)
Fe3O4+4H22Fe2++Cl2=2Fe3++2Cl-2Fe3++Fe=3Fe2+取少量D溶液于试管中,滴加少量KSCN溶液,若溶液变红,证明D中含有Fe3+。
【解析】
红褐色固体固体出现,为氢氧化铁,说明金属单质A为铁,铁与盐酸反应生成氯化亚铁(C)和氢气(F),氯化亚铁被氯气氧化为氯化铁(D),氯化铁又被铁还原为氯化亚铁,氯化亚铁与氢氧化钠溶液反应生成白色沉淀氢氧化亚铁(E),接着被氧气氧化为红褐色固体氢氧化铁,铁与水蒸气加热条件下反应生成四氧化三铁(B)和氢气(F);
(1)B为四氧化三铁,正确答案为Fe3O4。
(2)正确答案:
①4Fe(OH)2+O2+2H2O===4Fe(OH)3;②3Fe+4H2O(g)
Fe3O4+4H2。
(3)氯化亚铁被氯气氧化为氯化铁:
2Fe2++Cl2=2Fe3++2Cl-;氯化铁又被铁还原为氯化亚铁:
2Fe3++Fe=3Fe2+;正确答案:
2Fe2++Cl2=2Fe3++2Cl-;2Fe3++Fe=3Fe2+。
(4)Fe3+检验方法:
①加入氢氧化钠溶液,生成红褐色沉淀;②加入硫氰化钾溶液,出现红色溶液,该方法简单易操作;正确答案:
取少量D溶液于试管中,滴加少量KSCN溶液,若溶液变红,证明D中含有Fe3+。
点睛:
推断题要抓住题眼:
红褐色固体为氢氧化铁,从而推出金属单质铁。
4.已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末。
其转化关系如图。
请回答:
(1)工业上制C用A不用H的原因______________________。
(2)写出C与K反应的化学方程式_________________,该反应的反应物总能量___________(填“大于”或“小于”)生成物总能量。
(3)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,接通电源(短时间)电解E水溶液的化学方程式___________________。
(4)写出E物质的电子式___________________。
(5)J与H反应的离子方程式为________________________。
(6)写出G与熟石灰反应制取漂白粉的化学方程式_______________________。
【答案】氯化铝是共价化合物,熔融状态下不导电2Al+Fe2O3
Al2O3+2Fe大于2KCl+2H2O
2KOH+H2↑+Cl2↑
Al3++3AlO2-+6H2O=4Al(OH)3↓2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
【解析】
【分析】
【详解】
形成D的元素的原子最外层电子数是次外层的3倍,原子只能有2个电子层,最外层电子数为6,则D为O2;K为红棕色固体粉末,K为Fe2O3;由于电解A得到C与D,则C与K生成A的反应为铝热反应,故A为Al2O3,L为Fe,C为Al;黄绿色气体G为Cl2,与C反应得到H为AlCl3;B的焰色反应呈紫色(透过蓝色钴玻璃),B中含有K元素,B在催化剂、加热条件下反应生成氧气,则B为KClO3,E为KCl,电解KCl溶液生成KOH、H2和Cl2,过量的F与氯化铝反应得到J,则I为H2,F为KOH,J为KAlO2;
(1)H为AlCl3,氯化铝是共价化合物,熔融状态下不导电,故工业上制Al用氧化铝不用氯化铝,故答案为氯化铝是共价化合物,熔融状态下不导电;
(2)C与K反应的化学方程式为:
2Al+Fe2O3
Al2O3+2Fe,该反应为放热反应,故该反应的反应物总能量大于生成物总能量,故答案为2Al+Fe2O3
Al2O3+2Fe;大于;
(3)Fe是目前应用最广泛的金属,用碳棒作阳极,Fe作阴极,接通电源(短时间)电解KCl水溶液的化学方程式为:
2KCl+2H2O
2KOH+H2↑+Cl2↑,故答案为2KCl+2H2O
2KOH+H2↑+Cl2↑;
(4)E为KCl,KCl的电子式为
,故答案为
;
(5)J与H反应的离子方程式为:
Al3++3AlO2-+6H2O=4Al(OH)3↓,故答案为Al3++3AlO2-+6H2O=4Al(OH)3↓;
(6)G为Cl2,G与熟石灰反应制取漂白粉的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
【点晴】
本题考查无机推断等,特殊颜色及D的原子结构、转化关系中特殊反应等是推断突破口,是对元素化合物知识及学生综合能力的考查,需对基础知识全面掌握。
推断题中常见的特征反应现象有:
(1)焰色反应:
Na(黄色)、K(紫色);
(2)使品红溶液褪色的气体:
SO2(加热后又恢复红色)、Cl2(加热后不恢复红色);(3)白色沉淀Fe(OH)2置于空气中最终转变为红褐色[Fe(OH)3](由白色→灰绿→红褐色);(4)在空气中变为红棕色:
NO;(5)气体燃烧火焰呈苍白色:
H2在Cl2中燃烧;在空气中点燃呈蓝色:
CO、H2、CH4;(6)使湿润的红色石蕊试纸变蓝:
NH3;(7)空气中出现白烟:
NH3与酸性气态物质(或挥发性酸如盐酸、硝酸)反应等。
5.某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如下图所示:
已知①A、B、C、D、G含有同种元素。
②
纯A(单质)
B溶液
D固体
G溶液
颜色
银白色
黄色
红棕色
浅绿色
③E是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,也能将一种氧化物氧化为F,F是含有三种元素的化合物,与A反应生成E、G。
依据以上信息填空:
(1)写出D的化学式:
___________________________________________。
(2)G生成C的过程中所出现的现象为_________________________。
(3)写出反应A→B的化学方程式:
_________________________________。
(4)B→F的离子方程式为________;G与次氯酸反应的离子方程式为________________________________。
【答案】Fe2O3先产生白色沉淀,迅速变为灰绿色,最后变为红褐色2Fe+3Cl2
2FeCl32Fe3++SO2+2H2O=2Fe2++SO42-+4H+H++2Fe2++HClO=2Fe3++Cl-+H2O
【解析】
【分析】
结合框图,D固体呈红棕色,则其为Fe2O3;A、B、C、D、G含有同种元素,B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,则B为FeCl3,G中含有Fe2+,A为Fe。
由“B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,也能将一种氧化物氧化为F,F是含有三种元素的化合物,与A反应生成E、G”,则F为H2SO4,G为FeSO4;E是通常情况下密度最小的气体,则E为H2。
由B→C→D的转化可推知,C为Fe(OH)3。
【详解】
(1)由以上分析可知,D为氧化铁,其化学式:
Fe2O3。
答案为:
Fe2O3;
(2)FeSO4生成Fe(OH)3,可先加碱、后氧化,所出现的现象为先产生白色沉淀,迅速变为灰绿色,最后变为红褐色。
答案为:
先产生白色沉淀,迅速变为灰绿色,最后变为红褐色;
(3)反应Fe→FeCl3需用Cl2将Fe氧化,反应方程式为2Fe+3Cl2
2FeCl3。
答案为:
2Fe+3Cl2
2FeCl3;
(4)FeCl3→H2SO4,应使用SO2,离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;FeSO4与次氯酸反应,生成Fe3+、Cl-和H+,离子方程式为H++2Fe2++HClO=2Fe3++Cl-+H2O。
答案为:
2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;H++2Fe2++HClO=2Fe3++Cl-+H2O。
【点睛】
利用框图进行物质推断时,先确定信息充足的物质,然后利用已知的少量信息、反应条件及未知物质前后的已知物质,推断出未知物质的组成。
6.如图所示每一方框表示一种反应物或生成物,其中A、C、D、E、F在通常情况下均为气体,且加热X生成的A与C的物质的量之比为1∶1,B为常见液体。
试回答下列问题:
(1)X是________(填化学式,下同),F是__________。
(2)A―→D反应的化学方程式为_______。
(3)G与Cu的反应中,G表现的性质为______。
(4)X与过量NaOH溶液反应生成C的离子方程式为_____________。
(5)以C、B、D为原料可生产G,若使amolC完全转化为G,理论上至少需要D___mol。
【答案】NH4HCO3NO22Na2O2+2CO2=2Na2CO3+O2酸性和氧化性NH4++HCO3—+2OH-=2H2O+CO32—+NH3↑2a
【解析】
【分析】
X能与盐酸、氢氧化钠反应都生成气体,应为弱酸铵盐,与盐酸反应得到气体A,A能与过氧化钠反应生成气体D,则A为CO2、D为O2,X与氢氧化钠反应得到气体C为NH3,A与C物质的量之比为1:
1,且B为常见液体,可以推知X为NH4HCO3、B为H2O,C(氨气)与D(氧气)反应生成E为NO,E与氧气反应生成F为NO2,F与水反应得到G能与Cu反应生成NO、NO2,则G为HNO3,据此解答。
【详解】
X能与盐酸、氢氧化钠反应都生成气体,应为弱酸铵盐,与盐酸反应得到气体A,A能与过氧化钠反应生成气体D,则A为CO2、D为O2,X与氢氧化钠反应得到气体C为NH3,A与C物质的量之比为1:
1,且B为常见液体,可以推知X为NH4HCO3、B为H2O,C(氨气)与D(氧气)反应生成E为NO,E与氧气反应生成F为NO2,F与水反应得到G能与Cu反应生成NO、NO2,则G为HNO3;
(1)由上述分析可知,X是NH4HCO3; F是NO2;
(2)A→D为Na2O2和CO2反应生成碳酸钠和O2,发生反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2;
(3)Cu与硝酸反应生成硝酸铜与氮的氧化物,反应中N元素的化合价部分为不变化,部分降低,故硝酸表现酸性、氧化性;
(4)NH4HCO3与过量NaOH溶液反应的离子方程式为NH4++HCO3—+2OH-
2H2O+CO32—+NH3↑;
(5)以NH3、H2O、O2为原料可生产HNO3,使a mol NH3完全转化为HNO3,根据电子转移守恒,理论上至少需要氧气的物质的量=
=2amol。
7.有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。
三种金属单质A、B、C与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:
A__________;G___________。
(2)写出反应①的化学方程式:
__________;写出反应②的离子方程式:
_________。
(3)说出黄绿色气体乙的一种用途__________________。
(4)区别E、F两种溶液最简单的方法是______,实验室检验G中所含的金属离子时,常在G的溶液中加入_____溶液
【答案】NaFeCl3Fe+2HCl=FeCl2+H2↑2Al+2OH-+2H2O=2AlO2-+3H2↑制漂白粉观察法KSCN
【解析】
【分析】
金属A焰色反应为黄色,故A为金属Na,与水反应生成NaOH与氢气,则D为NaOH,气体甲为H2;氢氧化钠与金属B反应生成氢气,故金属B为Al,黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.氢氧化钠与物质G反应生成红褐色沉淀H是Fe(OH)3,故物质G中含有Fe3+,由转化关系:
HCl+金属C→物质F,F+氯气→物质G,可知金属C为Fe,物质F为FeCl2,物质G为FeCl3,结合物质的性质解答该题。
【详解】
金属A焰色反应为黄色,故A为金属Na,与水反应生成NaOH与氢气,则D为NaOH,气体甲为H2;氢氧化钠与金属B反应生成氢气,故金属B为Al,黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.氢氧化钠与物质G反应生成红褐色沉淀H是Fe(OH)3,故物质G中含有Fe3+,由转化关系HCl+金属C→物质F,F+氯气→物质G,可知金属C为Fe,物质F为FeCl2,物质G为FeCl3;
(1)根据上面的分析可知:
A的化学式为Na;G的化学式为FeCl3;
(2)反应①为Fe和稀盐酸反应生成FeCl2和H2,发生反应的化学方程式为Fe+2HCl=FeCl2+H2↑;反应②为Al与NaOH溶液作用生成H2和NaAlO2,发生反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)黄绿色气体乙为氯气,可用于自来水的消毒或制漂白粉等。
(4)E为稀盐酸、F为FeCl2溶液,区分这两种溶液最简单的方法是观察法,盐酸是无色溶液,而FeCl2溶液是浅绿色;G为FeCl3溶液,含有Fe3+,检验时向FeCl3的溶液中加入KSCN溶液,可观察到溶液显血红色;
8.某含氧物质X仅含三种元素,在198℃以下比较稳定,温度高时易分解.,某研究小组设计并完成如下实验:
试回答如下问题:
(1)X的化学式为__________,写出X与H2O反应的离子方程式__________________
(2)工业上由红棕色固体2可以制备其单质,写出化学方程式____________________
(3)保存X时应注意_________________.
【答案】K2FeO44FeO42﹣+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH﹣Fe2O3+3CO
3CO2+2Fe避免吸潮和受热
【解析】
【分析】
根据题中各物质转化关系,X与水反应生成溶液Ⅰ焰色反应为紫色,则X中含钾元素,溶液2应为氯化钾溶液,X与水反应生成胶体,沉淀后灼烧得红棕色固体2,则红棕色固体2为氧化铁,胶体为氢氧化铁,所以X中含有铁元素,某含氧物质X仅含三种元素,所以X由Fe、K、O组成,由于固体1为氯化钾,质量为1.49g,则其中钾元素的物质的量为0.02mol,固体2为氧化铁,质量为0.80g,则铁元素的物质的量为0.01mol,所以X中氧元素的物质的量为
mol=0.04mol,所以X中Fe、K、O的物质的量之比为0.01:
0.02:
0.04=1:
2:
4,所以X的化学式为K2FeO4,根据氧化还原反应中电子得失守恒可知,X与水反应生成的无色气体为氧气,据此分析解答。
【详解】
(1)根据上面的分析可知,X的化学式为K2FeO4,X与H2O反应的离子方程式为:
4FeO42﹣+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH﹣;
(2)工业上由氧化铁制备铁的化学方程式为:
Fe2O3+3CO
3CO2+2Fe;
(3)由于K2FeO4与水会反应,所以保存K2FeO4时应注意避免吸潮和受热。
9.已知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如下反应关系。
(1)若A是一种红色金属单质,B是一种常见的挥发性