电化学基础知识点总结doc.docx
《电化学基础知识点总结doc.docx》由会员分享,可在线阅读,更多相关《电化学基础知识点总结doc.docx(21页珍藏版)》请在冰豆网上搜索。
电化学基础知识点总结doc
电化学基础知识点总结
电化学基础知识点总结
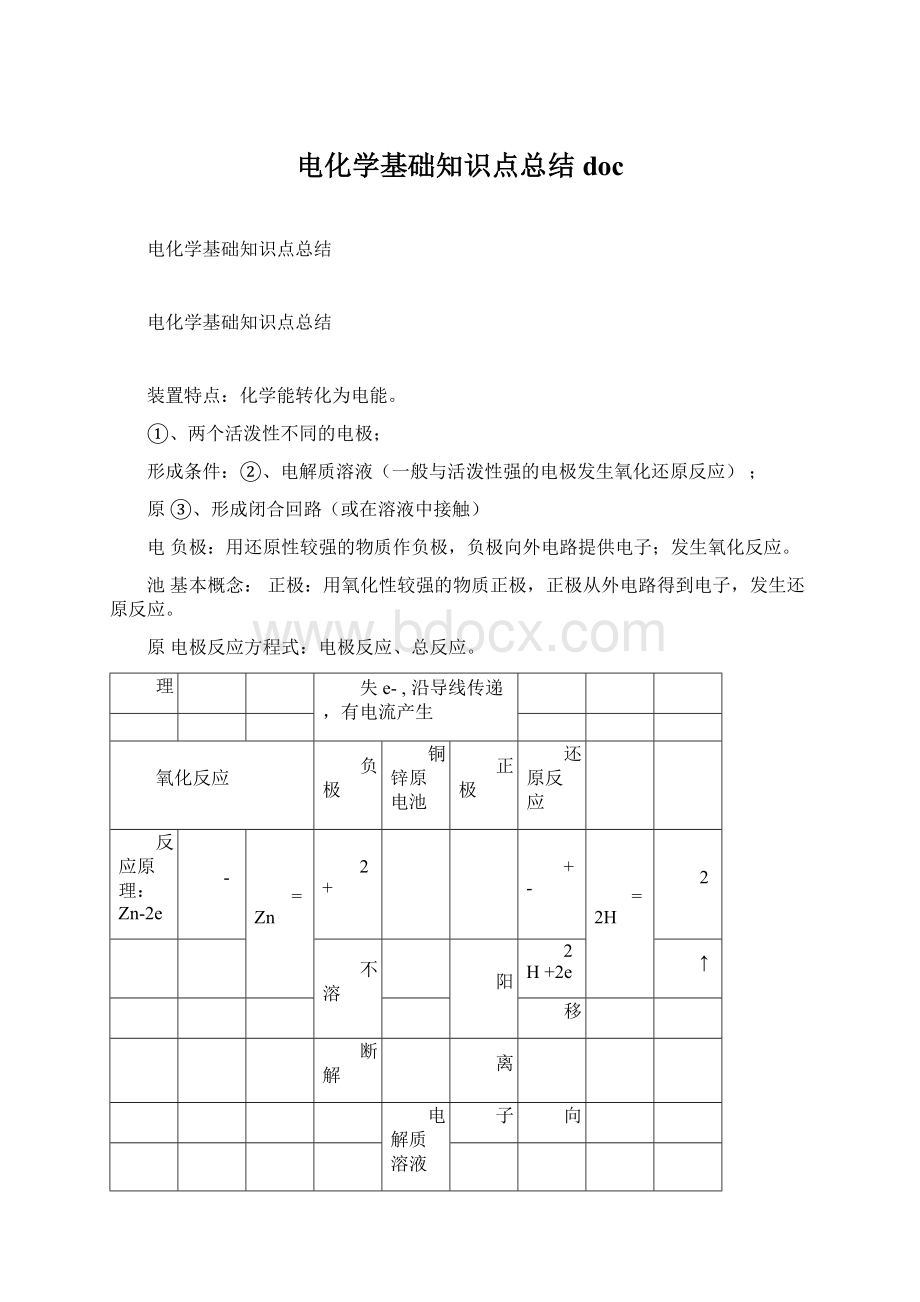
装置特点:
化学能转化为电能。
①、两个活泼性不同的电极;
形成条件:
②、电解质溶液(一般与活泼性强的电极发生氧化还原反应);
原③、形成闭合回路(或在溶液中接触)
电负极:
用还原性较强的物质作负极,负极向外电路提供电子;发生氧化反应。
池基本概念:
正极:
用氧化性较强的物质正极,正极从外电路得到电子,发生还原反应。
原电极反应方程式:
电极反应、总反应。
理
失e-,沿导线传递,有电流产生
氧化反应
负极
铜锌原电池
正极
还原反应
反应原理:
Zn-2e
-
=Zn
2+
+-
=2H
2
不溶
阳
2H+2e
↑
移
断解
离
电解质溶液
子
向
1.下列变化中,属于原电池反应的是()
A.在空气中金属铝表面迅速氧化形成保护
层
B.镀锌铁表面有划损时,也能阻止铁被氧
化
C.红热的铁丝与水接触表面形成蓝黑色保
护层
D.铁与稀H2SO4反应时,加入少量CuSO4
溶液时,可使反应加速
2.100mL浓度为2mol/L的盐酸跟过量的
锌片反应,为加快反应速率,又不影响生成氢气
2/15
的量,可采用的方法是()
A.加入适量的6mol/L的盐酸
B.加入数滴氯化铜溶液
C.加入适量的蒸馏水
D.加入适量的氯化钠溶液
3.称取三份锌粉,分别盛于甲、乙、丙三
支试管中,按下列要求另加物质后,塞上塞子,
定时测定生成氢气的体积。
甲加入50mLpH=3
的盐酸,乙加入50mLpH=3的醋酸,丙加入
50mLpH=3的醋酸及少量胆矾粉末。
若反应终
了,生成氢气的体积一样多,且没有剩余的锌。
请用“>”“=”或“<”回答下列各题。
(1)开始时,反应速率的大小为__________。
(2)三支试管中参加反应的锌的质量为
__________。
(3)反应终了,所需时间为__________。
(4)在反应过程中,乙、丙速率不同的理由是
(简要说明)__________。
新课标第一网
3/15
电极反应:
负极(锌筒)Zn-2e-=Zn2+
正极(石墨)2NH4++2e-=2NH3+H2↑
①、普通锌——锰干电池
总反应:
Zn+2NH4
+=Zn2++2NH3+H2↑
干电池:
电解质溶液:
糊状的
NH4Cl
特点:
电量小,放电过程易发生气涨和溶液
②、碱性锌——锰干电池
电极:
负极由锌改锌粉(反应面积增大,放电电流增加)
;
电解液:
由中性变为碱性(离子导电性好)。
正极(PbO2)PbO2+SO42-
+
-
42
O
+4H+2e=PbSO+2H
负极(Pb)
Pb+SO42--2e-=PbSO4
铅蓄电池:
总反应:
PbO2+Pb+2H2SO4
放电
2PbSO4+2H2O
充电
电解液:
1.25g/cm3~1.28g/cm3的H2SO4溶液
化
蓄电池
特点:
电压稳定。
Ⅰ、镍——镉(Ni——Cd)可充电电池;
学
电
其它蓄电池
Cd+2NiO(OH)+2H2O
放电
Cd(OH)2+2Ni(OH)2
源
放电`
简
Ⅱ、银锌蓄电池
介
锂电池
①、燃料电池与普通电池的区别
不是把还原剂、氧化剂物质全部贮藏在电池内,而是工作时不断
从外界输入,同时
燃料
电极反应产物不断排出电池。
电池②、原料:
除氢气和氧气外,也可以是
CH4、煤气、燃料、空气、氯气等氧化剂。
负极:
2H2+2OH--4e-=4H2O;正极:
O2+2H2O+4e-=4OH-
③、氢氧燃料电池:
总反应:
O2+2H2=2H2O
特点:
转化率高,持续使用,无污染。
废旧电池的危害:
旧电池中含有重金属(Hg2+)酸碱等物质;回收金属,防止污染。
1、镍氢电池是近年开发出来的可充电电池,
它可以取代会产生污染的镍镉电池。
氢镍电池的
总反应式是0.5H2+NiO(OH)Ni(OH)2。
根据
此反应式判断,下列叙述中正确的是
()
A.电池充电时,氢元素被还原
B.电池充电时,镍元素被氧化
4/15
C.电池放电时,负极周围溶液的pH不断
增大D.电池放电时,负极反应为H2-2e-=2H+
2、研究人员研制出一种锂水电池,可作为
鱼雷和潜艇的储备电源。
该电池以金属锂和钢板
为电极材料,以LiOH为电解质,使用时加入水
即可放电。
关于该电池的下列说法不正确的是
()
A.水既是氧化剂又是溶剂
B.放电时正极上有氢气生成
C.放电时OH-向正极移动
D.总反应为2Li+2H2O===2LiOH+H2↑
3.研究人员最近发现了一种“水”电池,这
种电池能利用淡水与海水之间含盐量差别进行
发电,在海水中电池总反应可表示为5MnO2+
2Ag+2NaCl===Na2Mn5O10+2AgCl,下列
“水”电池在海水中放电时的有关说法正确的是
()
A.正极反应式:
Ag+Cl--e-=AgCl
5/15
B.每生成1molNa2Mn5O10转移2mol
电子
C.Na+不断向“水”电池的负极移动
D.AgCl是还原产物
腐蚀概念:
金属或合金与周围接触到的气体或液体进行化学反应而腐蚀损耗的过程。
概述:
腐蚀危害:
腐蚀的本质:
M-ne-→Mn+(氧化反应)
分类:
化学腐蚀(金属与接触到的物质直接发生化学反应而引起的腐蚀)
、电化腐蚀
定义:
因发生原电池反应,而使金属腐蚀的形式。
金
负极(Fe):
Fe-2e-=Fe2+;正极(C):
O2+2H2O+4e-=4OH-
属
电化
吸氧腐蚀:
总反应:
2Fe+O2+2H2O=Fe(OH)2
的
腐
腐蚀
后继反应:
4Fe(OH)2+O2+2H2O=4Fe(OH)3
蚀
△
与
2Fe(OH)3
钢铁的腐蚀:
Fe2O3+3H2O
防
负极(Fe):
Fe-2e-=Fe2+;
护
析氢腐蚀:
正极(C):
2H+-
2
+2e=H
↑
总反应:
Fe+2H+=Fe2++H2↑
影响腐蚀的因素:
金属本性、介质。
金属的防护:
①、改变金属的内部组织结构;
保护方法:
②、在金属表面覆盖保护层;
③、电化学保护法(牺牲阳极的阴极保护法)
规律总结:
金属腐蚀快慢的规律:
在同一电解质溶液中,金属腐蚀的快慢规律如下:
电解原理引起的腐蚀>原电池原理引起的腐蚀
>化学腐蚀>有防腐措施的腐蚀
防腐措施由好到坏的顺序如下:
外接电源的阴极保护法>牺牲负极的正极保护法>有一般防腐条件的腐蚀>无防腐条件的腐蚀
6/15
1.分别放置在图中所示装置(都盛有0.1
mol·L-1的H2SO4溶液)中的四个相同的纯锌
片,腐蚀最慢的
2.结合右图判断,下列叙述正确的是
(A)
A.Ⅰ和Ⅱ中正极均被保护
Fe→
←Zn
→2+←Cu
B.Ⅰ和Ⅱ中负极反应均是
Fe-2eˉ=Fe
C.Ⅰ和Ⅱ中正极反应均是
O+2H
2
O+4eˉ
=4OHˉ
2
3%NaCl溶液
经酸化3%
D.Ⅰ和Ⅱ中分别加入少量
3
I
6
IINaCl溶液
K
[Fe(CN)]溶液,
均有蓝色沉淀
3.为了避免青铜器生成铜绿,以下方法正确的是()
A.将青铜器放在银质托盘上
B.将青铜器与直流电源的正极相连
C.将青铜器保存在潮湿的空气中
D.在青铜器的表面覆盖一层防渗的高分子膜
4.下列叙述不正确的是()
...
A.钢铁在干燥的空气中不易被腐蚀
B.可以用船尾连锌块的方法来保护船身
C.金属的电化学腐蚀比化学腐蚀更普遍
D.用铝质铆钉铆接铁板,铁板易被腐蚀
7/15
定义:
使电流通过电解质溶液而在阴阳两极引起氧化还原反应的过程。
装置特点:
电能转化为化学能。
①、与电源本连的两个电极;
形成条件②、电解质溶液(或熔化的电解质)
③、形成闭合回路。
电极阳极:
与直流电源正极相连的叫阳极。
电概念
阴极:
与直流电源负极相连的叫阴极。
解
电极反应:
池
原
原理:
谁还原性或氧化性强谁先放电(发生氧化还原反应)
理
离子放电顺序:
阳极:
阴离子还原性
S2->I->Br->Cl->OH->SO42-(含氧酸根)>F-
阴极:
阳离子氧化性
Ag+>Fe3+>Cu2+>Pb2+>Sn2+>Fe2+>Zn2+>H+>Al3+>Mg2+>Na+
电子流向
e-
e-
氧化反应
阳极
阴极
还原反应
反应原理:
4OH-
-4e
-
2
2
Cu
2+
-
=2HO+O
阴
移
阳移
+2e=Cu
离
向
离
子
子向
电解质溶液
电解
电解结果:
在两极上有新物质生成。
总反应:
2CuSO4+2H2O
2Cu+2H2SO4+O2↑