透明质酸行业分析报告.docx
《透明质酸行业分析报告.docx》由会员分享,可在线阅读,更多相关《透明质酸行业分析报告.docx(23页珍藏版)》请在冰豆网上搜索。
透明质酸行业分析报告
2019年透明质酸行业分析报告
2019年7月
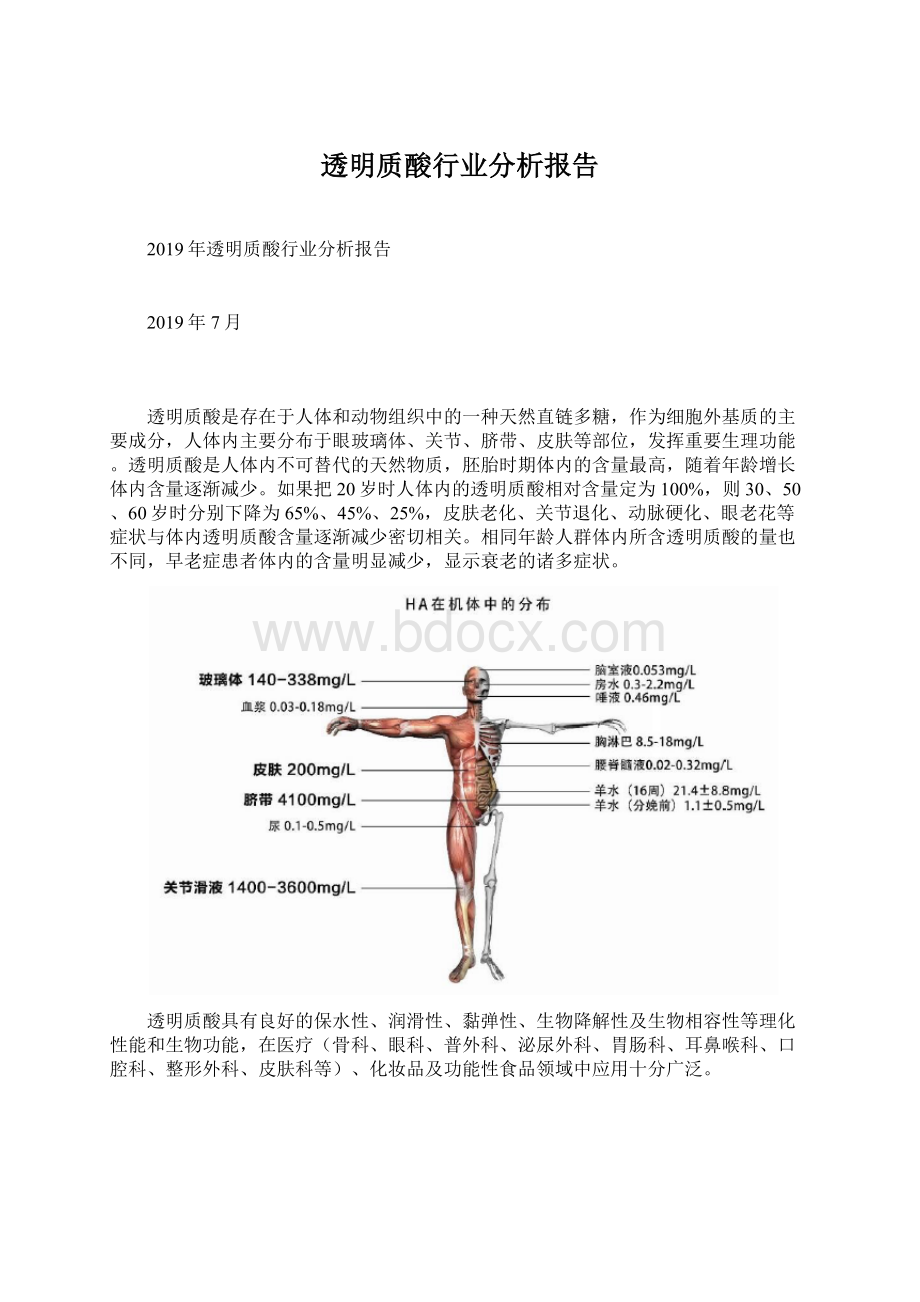
透明质酸是存在于人体和动物组织中的一种天然直链多糖,作为细胞外基质的主要成分,人体内主要分布于眼玻璃体、关节、脐带、皮肤等部位,发挥重要生理功能。
透明质酸是人体内不可替代的天然物质,胚胎时期体内的含量最高,随着年龄增长体内含量逐渐减少。
如果把20岁时人体内的透明质酸相对含量定为100%,则30、50、60岁时分别下降为65%、45%、25%,皮肤老化、关节退化、动脉硬化、眼老花等症状与体内透明质酸含量逐渐减少密切相关。
相同年龄人群体内所含透明质酸的量也不同,早老症患者体内的含量明显减少,显示衰老的诸多症状。
透明质酸具有良好的保水性、润滑性、黏弹性、生物降解性及生物相容性等理化性能和生物功能,在医疗(骨科、眼科、普外科、泌尿外科、胃肠科、耳鼻喉科、口腔科、整形外科、皮肤科等)、化妆品及功能性食品领域中应用十分广泛。
一、行业管理
1、行业主管部门
国家药品监督管理局对全国药品、医疗器械和化妆品进行监督管理,负责药品、医疗器械和化妆品的安全监督管理、标准管理、注册管理、质量管理、上市后风险管理、组织指导监督检查以及监督管理领域对外交流与合作。
国家发展和改革委员会是综合研究拟订经济和社会发展政策、指导总体经济体制改革的宏观调控机构,主要负责拟订和组织实施各行业产业政策,研究拟订行业发展计划,指导行业结构调整和实施行业管理。
此外,公司医药级原料、医疗器械类产品的境外销售活动还受到产品销售地医疗监管机构的监督管理,主要包括美国食品药品监督管理局(FDA)、欧洲药品管理局(EMA)、欧洲药品质量管理局(EDQM)、韩国国家食品药品安全部(MFDS)等。
2、行业监管体制
(1)国内医药行业监管体制
①国家药品标准制度
国家药品标准是指国家为保证药品质量所制定的质量指标、检验方法以及生产工艺等技术要求,包括《中华人民共和国药典》、药品注册标准和其他药品标准。
《中国药典》是国家药品标准体系的核心内容,《中国药典》2015版在品种收载、标准体系的系统完善、质控水平的整体提升方面进一步完善了药品及药用辅料的标准体系。
②药品注册管理制度
药品注册是指国务院药品监督管理部门根据药品注册申请人的申请,依照法定程序,对拟上市销售药品的安全性、有效性、质量可控性等进行审查,并决定是否同意其申请的审批过程。
在中华人民共和国境内申请药物临床试验、药品生产和药品进口,以及进行药品审批、注册检验和监督管理,适用《药品注册管理办法》。
③药品生产许可证制度
根据《中华人民共和国药品管理法》和《中华人民共和国药品管理法实施条例》,开办药品生产企业,须经企业所在地省、自治区、直辖市人民政府药品监督管理部门批准并发给《药品生产许可证》。
无《药品生产许可证》的,不得生产药品。
《药品生产许可证》应当标明有效期和生产范围,到期重新审查发证。
④药品生产质量管理规范制度
根据《中华人民共和国药品管理法》,药品生产企业必须按照国务院药品监督管理部门制定的《药品生产质量管理规范》组织生产。
药品监督管理部门按照规定对药品生产企业是否符合《药品生产质量管理规范》的要求进行认证,对认证合格的,发给认证证书(药品GMP证书)。
⑤原料药、药用辅料和药包材关联评审制度
2017年11月,国务院药品监督管理部门发布的《总局关于调整原料药、药用辅料和药包材审评审批事项的公告》(2017年第146号)规定:
“自公告发布之日起,各级食品药品监督管理部门不再单独受理原料药、药用辅料和药包材注册申请,国家食品药品监督管理总局药品审评中心建立原料药、药用辅料和药包材登记平台与数据库,有关企业或者单位可通过登记平台按本公告要求提交原料药、药用辅料和药包材登记资料,获得原料药、药用辅料和药包材登记号,待关联药品制剂提出注册申请后一并审评”。
原辅包企业可登陆国家药品审评中心的“原辅包登记平台”,提交电子登记资料后获得登记号。
(2)国内医疗器械行业监管体制
我国目前对医疗器械实施分类管理,监管范围不仅包括医疗器械产品,也包括医疗器械生产、经营企业。
①医疗器械产品分类管理
根据《医疗器械监督管理条例》,国家对医疗器械按照风险程度实行分类管理,共分三类。
第一类是风险程度低,实行常规管理可以保证其安全、有效的医疗器械;第二类是具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械;第三类是具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械。
国务院药品监督管理部门负责制定医疗器械的分类规则和分类目录,并根据医疗器械生产、经营、使用情况,及时对医疗器械的风险变化进行分析、评价,对分类目录进行调整。
制定、调整分类目录,应当充分听取医疗器械生产经营企业以及使用单位、行业组织的意见,并参考国际医疗器械分类实践,医疗器械分类目录应当向社会公布。
②医疗器械产品注册与备案制度
为加强医疗器械生产监督管理,规范医疗器械生产行为,保证医疗器械安全、有效,国务院药品监督管理部门制定了《医疗器械注册管理办法》,在中华人民共和国境内销售、使用的医疗器械,应当按照规定申请注册或者办理备案。
第一类医疗器械实行备案管理;第二类、第三类医疗器械实行注册管理。
境内第一类医疗器械备案,备案人向设区的市级药品监督管理部门提交备案资料。
境内第二类医疗器械由省、自治区、直辖市药品监督管理部门审查,批准后发给医疗器械注册证。
境内第三类医疗器械由国家药品监督管理总局部门审查,批准后发给医疗器械注册证。
③医疗器械生产许可与备案制度
为加强医疗器械生产监督管理,规范医疗器械生产行为,保证医疗器械安全、有效,国务院药品监督管理部门制定了《医疗器械生产监督管理办法》,在中华人民共和国境内从事医疗器械生产活动及其监督管理,应当遵守本办法。
开办第一类医疗器械生产企业,应当向所在地设区的市级食品药品监督管理部门备案;开办第二类、第三类医疗器械生产企业,应当向所在地省、自治区、直辖市药品监督管理部门申请生产许可。
对于符合规定条件的准予许可并发给《医疗器械生产企业许可证》。
许可证有效期5年,有效期届满延续的,应当自有效期届满6个月前向原发证部门提出延续申请。
④医疗器械经营许可与备案制度
《医疗器械经营监督管理办法》规定:
按照医疗器械经营实施分类管理。
开办一类医疗器械经营的企业,不需要许可和备案。
开办二类医疗器械经营的,经营企业应当向所在地设区的市级人民政府药品监督管理部门备案。
开办第三类医疗器械经营的,经营企业应当向所在地设区的市级人民政府药品监督管理部门申请经营许可。
(3)国外行业监管体制
①美国FDA监管政策
美国食品药品监督管理局(FDA)是在美国境内负责对药品、医疗器械、食品进行监督管理。
根据美国《联邦食品、药品和化妆品法案》的要求,任何生产和销售在美国上市的食品/保健品及相应原料,药品/原料药,医疗器械,以及特殊化妆品的公司都必须在美国FDA进行注册。
所有关于药品的生产、加工、包装等过程均应严格符合动态药品生产管理规范(cGMP)的要求,包括起始物料或药用中间体的接收、生产、包装、标签、质量控制、储存和配送等过程。
原料药出口到美国一般会向FDA递交药物主文件(DrugMasterFile,DMF)。
递交的DMF文件应对原料药的生产和质量控制的全过程以及原料药质量进行详尽的描述。
当DMF文件登记完成、使用该原料药的制剂生产企业提出药品申请以后,FDA专员将对原料药企业进行cGMP符合性现场检查,通过对生产管理和质量管理等药品生产全过程的全面考察,判断该原料药企业的生产设施和质量管理体系是否符合cGMP标准。
FDA对制剂企业和原料药企业的现场检查完成并签发通过后,引用该DMF的药品将获得美国市场的准入,并纳入FDA的监管体系。
除非特殊规定,在美国生产和销售的医疗器械产品都必须取得FDA注册。
FDA根据不同风险等级将医疗器械产品分为三类进行管理和注册,其中Ⅰ类属于低风险产品,Ⅱ类属于中等风险产品,Ⅲ类属于高风险产品。
不同风险等级的医疗器械实施不同的备案或审核程序:
对于风险较小的Ⅰ和Ⅱ类产品,大部分在上市前需要向FDA递交申请并获得上市前许可(PremarketNotification,PMN,又称510(K)许可);一些风险很小的Ⅰ和Ⅱ类产品也可以无需取得510(K)许可;对于风险更大的Ⅲ类产品,大部分需要获得上市前批准(PremarketApproval,PMA),企业需根据FDA的相关指南提供包括产品测试、临床验证等相关资料由FDA进行审查。
产品注册审核过程中,FDA会根据产品风险等级、审核制度等决定是否进行现场审核。
产品上市后,FDA会通过定期对企业进行质量体系检查来开展上市后监督。
通常风险等级越高、品种及销售量越多检查越频繁,如果未能通过FDA的现场检查,可能导致相关产品被禁止进入美国市场。
②欧盟监管政策
通过欧洲药典适应性认证(CEP认证)是原料药产品进入欧盟市场的重要途径。
CEP认证是欧洲药品质量管理局(EDQM)对已经收载到欧洲药典中的原料药设置的独立质量评价程序。
原料药生产商可独立地向EDQM提出申请,同时生产商必须承诺其产品生产过程的质量管理严格遵循欧盟GMP标准,在文件审查和可能的现场检查通过之后,EDQM会向原料药的生产商颁发CEP证书。
如果拟上市的药品中使用的原料药已获得CEP证书,该药品的上市许可申请即可直接使用该证书,审评当局不再对该原料药的质量进行评价。
同时,已获得CEP证书的原料药产品可以用于欧洲药典协定公约成员国内的所有药物制剂生产厂家的制剂生产。
对于医疗器械产品,欧盟国家执行通用的欧盟进口政策进行CE认证。
完成CE认证以后,某些进口国卫生监管部门还要求进行登记备案。
欧盟国家卫生监管部门登记备案需要提供产品的CE认证、说明书、维修手册、产品标签等资料文件。
欧盟对不同管理类别的医疗器械产品制定了不同的符合性评估程序,除部分低风险器械外,基本均由CE公告机构负责执行,CE公告机构由欧盟各成员国负责指定并告知欧盟委员会。
③其他国家和地区
不同国家和地区对医药、医疗器械等产品的准入条件、注册时长和程序存在一定差异,一般要求取得该国或该地区卫生监管部门或其授权机构的相应注册。
大部分国家都要求进口医药或医疗器械产品取得相应的产品注册认证,每个国家的注册认证周期不同。
3、行业主要法律法规和产业政策
(1)主要法律法规
(2)主要产业政策
①《中国制造2025》
2015年5月,国务院印发了《中国制造2025》,作为我国实施制造强国战略第一个十年的行动纲领。
文件提出瞄准新一代信息技术、高端装备、新材料、生物医药等战略重点,引导社会各类资源集聚,推动优势和战略产业快速发展。
针对生物医药及高性能医疗器械领域,要求发展针对重大疾病的化学药、中药、生物技术药物新产品;提高医疗器械的创新能力和产业化水平;实现生物3D打印、诱导多能干细胞等新技术的突破和应用。
②《“十三五”国家科技创新规划》
2016年7月,国务院印发《“十三五”国家科技创新规划》,提出要瞄准世界科技前沿,抢抓生物技术与各领域融合发展的战略机遇,坚持超前部署和创新引领,以生物技术创新带动生命健康、生物制造、生物能源等创新发展,加快推进我国从生物技术大国到生物技术强国的转变。
重点部署生物医用材料等技术,以组织替代、功能修复、智能调控为方向,重点布局新一代植介入医疗器械等重大战略性产品,提升医用级基础原材料的标准,构建新一代生物医用材料产品创新链,提升生物医用材料产业竞争力。
③《“十三五”国家战略性新兴产业发展规划》
2016年11月,国务院印发了《“十三五”国家战略性新兴产业发展规划》,提出加快生物产业创新发展步伐,培育生物经济新动力,到2020年,生物产业规模达到8—10万亿元,形成一批具有较强国际竞争力的新型生物技术企业和生物经济集群。
规划提出构建生物医药新体系,加快开发具有重大临床需求的创新药物和生物制品,加快推广绿色化、智能化制药生产技术,强化科学高效监管和政策支持,推动产业国际化发展,加快建设生物医药强国;利用增材制造等新技术,加快组织器官修复和替代材料及植介入医疗器械产品创新和产业化。
④《“十三五”生物产业发展规划》
2016年12月,国家发展改革委印发《“十三五”生物产业发展规划》,提出加速生物产业在生产、生活、生态各领域的广泛应用,推动生物产业开展全球合作,促进产业迈向中高端,加速形成经济新支柱。
规划提出要构建生物医药新体系,立足基因技术和细胞工程等先进技术带来的革命性转变,加快新药研发速度,提升药物品质,更好满足临床用药和产业向中高端发展的需求;提升生物医学工程发展水平,推动植(介)入产品创新发展,加速新材料技术应用,针对骨科、眼科等临床治疗需求,继续加快植(介)入医疗器械新产品的创新和产业化;推动生物制造规模化应用,提高生物制造产业创新发展能力,推动新型发酵产品等的规模化生产与应用,推动绿色生物工艺在医药、食品等行业的应用示范。
⑤《“健康中国2030”规划纲要》
2016年10月,中共中央、国务院印发了《“健康中国2030”规划纲要》。
规划纲要提出促进医药产业发展,加强医药技术创新,提升产业发展水平,大力发展生物药、高性能医疗器械等,推动重大药物产业化,加快医疗器械转型升级,提高具有自主知识产权的医学诊疗设备、医用材料的国际竞争力;推动健康科技创新,推进医学科技进步,发展医学前沿技术,加强关键技术突破,重点部署创新药物开发、医疗器械国产化等任务,显著增强重大疾病防治和健康产业发展的科技支撑能力。
⑥《关于促进医药产业健康发展的指导意见》
2016年3月,国务院办公厅印发《关于促进医药产业健康发展的指导意见》。
意见明确要加强生物活性、等效性、利用度等生物药性能研究,增强发酵和细胞培养等生物学过程易变性控制能力。
利用现代生物技术改进传统生产工艺,大力推广基因工程、生物催化等生物替代技术,积极采用生物发酵方法生产药用活性物质。
二、透明质酸行业概况
1、透明质酸简介及发展概况
透明质酸是一种由N-乙酰氨基葡萄糖和D-葡萄糖醛酸为结构单元的天然高分子粘多糖。
广泛存在于脊椎动物结缔组织和体液中,如关节滑液、眼玻璃体、脐带、皮肤等。
透明质酸具有独特的黏弹性和优良的保水性、组织相容性和非免疫原性,在临床和日常生活中有着广泛的应用。
20世纪70年代,EndreBalazs博士和他的研发团队开发了一种从鸡冠和人脐带中分离纯化透明质酸的工艺,并实现了透明质酸在眼科黏弹剂的小范围使用,但产量较低,难以满足不断扩展的终端应用市场。
20世纪80年代,日本首次报道使用链球菌发酵法生产透明质酸。
20世纪80年代,国内科研机构先后设计研究了利用人脐带、公鸡冠及动物眼玻璃体等原料提取制备透明质酸的工艺,并取得了一定进展。
20世纪90年代,国内部分科研机构进行了发酵法制备透明质酸工艺的研究,推动了我国透明质酸生产的发展。
国家科委对发酵法生产透明质酸项目非常重视,先后将此项目列入国家“八五”和“九五”重点科技攻关项目计划。
经过二十多年的发展,我国透明质酸的发酵技术水平以及产量和质量均已达到国际先进水平,我国已成为全球最大的透明质酸原料生产国之一。
20世纪末,链球菌发酵法成为透明质酸生产的主流方法。
因为发酵技术的引入,透明质酸的生产规模得以迅速扩大,质量显著提高,生产成本显著降低。
提取法和发酵法的主要区别如下:
随着微生物发酵生产透明质酸逐步实现大规模产业化,透明质酸在医药、生物医用材料、化妆品、食品等领域的应用得到极大普及和推广,并逐渐扩展至新的应用领域,如肿瘤治疗、组织工程、药物载体、口腔、胃肠、耳鼻喉等,拓展了透明质酸的应用领域。
得益于对透明质酸认识的不断深入、监管政策的持续开放和市场需求的增长,近年来透明质酸原料的销量保持快速增长。
根据研究机构Frost&Sullivan的分析,2018年,全球透明质酸原料销量达到500吨,2014-2018年复合增长率为22.8%,预计未来五年将保持18.1%的高复合增长率,预计2023年销量可增长至1,150吨。
2018年,食品级、化妆品级和医药级透明质酸原料的销量分别达到230吨、250吨和20吨,2014-2018年复合增长率分别为29.4%、18.0%和22.1%,预计2023年销量可分别增长至654.3吨、454.5吨和41.2吨。
2、透明质酸的应用
(1)透明质酸在医药和临床诊治中的应用
透明质酸在医药和临床诊治中的主要应用包括:
黏弹性手术、黏弹性补充疗法、黏弹性填充、黏弹性阻隔和黏弹性防护。
另外,透明质酸在药物传递和组织工程等方面也有应用。
①黏弹性手术(Viscosurgery)
透明质酸应用于眼科手术时,可起到支撑前房、保护眼部组织、维持手术操作空间的作用。
另外,透明质酸也应用于关节内窥镜手术、耳外科手术和内窥镜下黏膜切除术等。
具体应用领域包括:
②黏弹性补充疗法(Viscosupplementation)
黏弹性补充疗法是指在病理状态下用透明质酸溶液来补充或替代关节滑液,减轻疼痛并促进关节内损伤的愈合。
黏弹性补充疗法可通过恢复关节滑液的黏弹性、减少摩擦、提高关节活动性来改善病变关节的生理环境。
具体应用领域包括:
③黏弹性填充(Viscoaugmentation)
黏弹性填充是用透明质酸凝胶来填充并扩张皮肤、括约肌、声带和咽部结缔组织等,以改善填充部位的缺陷。
具体应用领域包括:
④黏弹性阻隔(Viscoseparation)
黏弹性阻隔是指用透明质酸将相邻组织隔离以防止术后粘连的发生,减少疤痕的形成。
具体应用领域包括:
⑤黏弹性防护(Viscoprotection)
黏弹性防护是指用透明质酸溶液来保护组织表面,使其免受脱水和有害物质的损伤,并促进表面创伤的愈合。
具体应用领域包括:
⑥药物载体(DrugDelivery)
由于透明质酸具有高黏附性和安全性,使其作为肠道及非肠道给药的药物载体应用受到更多关注。
透明质酸材料作为药物载体时,可以是微粒或凝胶形式,由透明质酸、透明质酸衍生物或透明质酸与其它高聚物的结合物制成。
透明质酸可作用于在肿瘤细胞中过度表达的CD44受体,因此,也可作为治疗肿瘤的靶向药物载体。
此外,含透明质酸的药物通过皮下注射用于非肠道系统时还表现出缓释特性。
⑦透明质酸的其它潜在应用
(2)透明质酸在化妆品中的应用
透明质酸的保水作用是其最重要的生理功能之一,其理论保水值高达500ml/g以上。
与其他常用保湿剂相比,透明质酸受环境湿度影响较小,在低相对湿度(33%)下的吸湿量高,在高相对湿度(75%)下吸湿量低。
这种独特的性质,适应了皮肤在不同季节、不同湿度环境下的保湿要求,因此称为理想的智能保湿剂。
透明质酸不但具有极高的保水性能,而且具备皮肤屏障的特性。
透明质酸可同时减少紫外线透射,并通过促进表皮细胞增殖分化和清除氧自由基,修护紫外线所致的皮肤损伤,达到双重保护。
皮肤轻度烧伤时,表面涂抹含透明质酸水剂化妆品可减轻疼痛,加速受伤部位愈合。
随着透明质酸的产业化和技术发展,拥有不同物理与生物特性的透明质酸和透明质酸衍生物推向护肤与彩妆市场,如超低分子透明质酸钠(<10kDa)、透明质酸钠交联聚合物、乙酰化透明质酸钠(AcHA)、油分散透明质酸钠、透明质酸钠络合物等,被广泛应用于护肤精华、口红、水乳膏霜、面膜、喷雾等。
(3)透明质酸在食品中的应用
20世纪末,日本市场首次推出口服透明质酸护肤保健食品,充分肯定了其食用安全性。
近年,透明质酸已广泛应用于各种食品及饮料。
研究显示,口服透明质酸具有补水、改善关节功能和骨质疏松、修复胃黏膜损伤、促进创伤愈合、改善心血管系统、改善软骨病症状、提高人体免疫力、促血管生成等功效。
2008年5月,国家卫生部按照《新资源食品管理办法》的规定发布相关公告,批准透明质酸钠作为新资源食品用作保健食品原料,仅能用于保健食品。
我国已上市的含透明质酸钠的保健食品有二十余种,申报功能大多为改善皮肤水分和增加骨密度。
美国、英国、加拿大、捷克、日本、中国台湾等国家和地区也有多款含透明质酸的保健食品上市,透明质酸作为食品原料已在多个国家或地区得到认可。
三、透明质酸应用领域的发展概况
1、医疗健康行业发展概况
随着近年来新兴国家经济快速增长,以及发达国家及部分发展中国家人口老龄化规模持续扩大,全球医疗健康市场规模得以稳步增加。
根据研究机构Frost&Sullivan的分析,2017年度全球医疗健康行业市场的总销售规模约为1.77万亿美元。
(1)医药和医疗器械行业发展概况
①医药行业发展概况
2017年全球制药和生物技术行业的销售规模约为1.20万亿美元。
从市场结构来看,美欧日等发达国家市场仍居全球药品消费主导地位,但市场增速将放缓。
而新兴市场如亚洲等,受益于当地较高的经济增速、人口数量的增长、政府投入的增加、发达国家原研药物专利到期等有利因素,有望迎来良好发展机遇、保持较高增速。
中国医药市场是医药健康产业的重要组成部分,根据中国医药工业中心发布的《中国健康产业蓝皮书2017版》,2016年,中国医药市场规模约14,436亿元,较上年同比增长8.1%,未来将保持稳健的增长趋势。
②医疗器械行业发展概况
医疗器械是指直接或间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料及其他相关物品。
2017年全球医疗器械行业的销售规模约为4,650亿美元。
以中国为代表的新兴市场是全球最具潜力的医疗器械市场,产品普及需求与升级换代需求并存,增长速度较快。
我国医疗器械市场近年来增长率均保持在20%左右,2017年行业市场规模达到4,450亿元。
我国是人口大国,医疗器械行业属于国家重点支持的战略新兴产业,随着人口老龄化的到来和经济的快速发展,行业发展前景十分广阔。
(2)生物医用材料行业发展概况
生物医用材料是医疗器械的重要组成部分,是一类用于诊断、治疗、修复和替代人体组织、器官或增进其功能的新型高技术材料。
2017年,全球生物医用材料市场规模近2,000亿美元,其中,中国生物医用材料市场规模超过2,000亿元,同比增速近20%,增长十分迅速。
透明质酸因其良好的保水性、润滑性、黏弹性、生物降解性及生物相容性,被广泛应用于骨科、眼科、软组织填充等领域的各类生物医用材料中,受益于旺盛的终端需求增长,市场规模不断扩大。
①骨科应用概况
世界卫生组织统计数据显示,全球关节炎患者达3.55亿人;在中国,现有骨关节炎患者超过1.2亿。
年龄与骨科类疾病发病率呈正相关,根据卫计委发布的《2018中国卫生健康统计年鉴》,45岁以上人口骨科类疾病发病率明显较高。
目前我国治疗关节炎的常用注射类药物有四类:
非甾体类抗炎药、镇痛药物、糖皮质激素和其他关节腔注射药物(玻璃酸钠注射液为骨科关节腔注射用液)。
其中市场份额最高的是其他关节腔注射药物,其次为糖皮质激素。
根据研究机构Frost&Sullivan的分析,2018年中国骨关节炎注射类药物市场规模约98亿元,其中医药级透明质酸骨科终端产品的市场规模约为15.7亿元。
玻璃酸钠注射液作为关节补充滑液,可保护病损软骨,且具备良好的生物相容性,不良反应较少,其市场有望保持增长。
②眼科应用概况
在眼科领域,以高纯度透明质酸钠制作的黏弹剂作为手术垫主要应用于白内障手术,起到临时支撑手术空间,避免眼组织受到手术器械的机械损伤。
白内障是全球首位致盲性眼病。
我国60岁以上的老年人白内障发病率达80%以上,手术是治疗白内障的唯一方式。
根据中国防盲治盲网数据,以2017年我国每百万人白内障手术率(CSR)为2205人推算,我国2017